Variabilités morphologiques de quelques populations de Plantago albicans L. le long d’un transect nord-sud dans la région du Sud-Oranais (Ouest algérien)
Reçu le 11 novembre 2019, accepté le 18 novembre 2020, mis en ligne le 18 janvier 2021
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
Résumé
Description du sujet. Plantago albicans est une psammophyte pastorale dont la variabilité morphologique est observable sur le terrain. L’évaluation de l’influence des conditions du milieu sur les caractères morphologiques de l’espèce a été étudiée.
Objectifs. L’objectif du présent travail est d’analyser la variabilité morphologique de quelques populations de P. albicans dans la région du Sud-Oranais (Ouest algérien).
Méthode. Deux-cents-quarante individus répartis en 12 populations ont été récoltés le long d’un transect nord-sud et sont issus de biotopes différents. Ces individus ont fait l’objet de mesures morphométriques sur lesquelles des analyses univariées et multivariées sont appliquées.
Résultats. L’étude a révélé une variabilité inter-populations qui serait liée à la combinaison de facteurs stationnels et à la diversité biologique des biotopes. Des coupes anatomiques réalisées sur des axes aphylles érigés entre la rosette de feuilles et la racine ont permis de conclure à une structure anatomique adaptée de la tige de P. albicans qui, au fur et à mesure de la croissance de la rosette, surélève la partie feuillée photosynthétique évitant l’ensevelissement de la plante lors d’un ensablement trop important.
Conclusions. La variabilité des caractères morphologiques de P. albicans (longueur et largeur de la feuille, longueur de la hampe florale, de l’épi et de l’axe aphylle) semble traduire une plasticité phénotypique, c'est-à-dire une aptitude à exprimer le phénotype qui s’accommode le mieux aux conditions du milieu et souligne la capacité de l’espèce à occuper des milieux fortement ensablés.
Abstract
Morphological variability of some populations of Plantago albicans L. along a north-south transect in the region of South Oran (Western Algeria)
Description of the subject. Plantago albicans is a pastoral psammophyte whose morphological variability is observable in the field. Assessment of the influence of environmental conditions on the morphological characters was studied.
Objectives. The aim of the present study was to analyze the morphological variability of some populations of P. albicans in the South Oran region (Western Algeria).
Method. Two hundred and forty individuals, divided into 12 populations, were collected along a north-south transect, from different biotopes. These individuals were the subject of morphometric measurements on which univariate and multivariate analyses were applied.
Results. The study revealed inter-population variability, which could be related to the combination of site factors and biological diversity of biotopes. Anatomical cuts made on aphyllous axes, erected between the leaf rosette and the root, led to the identification of an adapted anatomical structure of P. albicans which, as the rosette grows, raises the photosynthetic foliage to prevent the plant from being buried under the sand during excessive silting up.
Conclusions. Variability of the morphological characteristics of P. albicans (leaf length and width, floral stem length, ear length and aphyllous axis length) reflects a phenotypic plasticity, which produces the phenotype that adapts best to environmental conditions and underlines the species’ capacity to occupy very sandy soil environments.
1. Introduction
1Plantago albicans L. est un hémicryptophyte à rosette de feuilles basales de la famille des Plantaginaceae reconnaissable à son aspect velu et soyeux, ses feuilles à bords ondulés (Quézel & Santa, 1962) et ses épis longs et étroits dépassant les feuilles (Ozenda, 1977). Sa valeur pastorale est indiquée dès la fin du 19e siècle dans la flore d'Algérie par Battandier & Trabut (1888). Son aire de répartition se concentre sur le bassin méditerranéen avec une avancée à l'est jusque dans le sud de l’Iran (Puech, 1987 ; Greuter et al. 1989 ; Tutel et al., 2005 ; Pedrol, 2009) et au sud dans les zones arides d’Afrique du Nord (Battandier & Jahandiez, 1920 ; Ayyad et al., 1984 ; El Hakim, 1986). Très commun en Algérie, on le rencontre sur les Hauts Plateaux et dans la région présaharienne, mais il est plus rare dans le Tell littoral (Ozenda, 1958 ; Quézel & Santa, 1962).
2Plantago albicans est présent dans les groupements steppiques à Macrochloa tenacissima (L.) Kunth, Artemisia herba-alba Asso et Lygeum spartum Loefl. ex L. d’Afrique du Nord (Le Houerou, 1969 ; Djebaili, 1978 ; Kaabeche, 1990 ; Aidoud-Lounis, 1997 ; Kadi-Hanifi, 1998) et même dans des milieux à proximité de zones salées comme décrit en Égypte par Zahran (2010). Pouget (1980) classe l’espèce parmi celles « qui paraissent se satisfaire d'un simple voile sableux en surface, quelle que soit par ailleurs la nature du sol sous-jacent ». Elle serait favorisée par des dépôts éoliens qui ne doivent pas pour autant dépasser une épaisseur de 10 cm, comme précisé par Bendali et al. (1990) et Hanifi (2007).
3À ce caractère psammophile (Le Houerou, 1995) s’ajoute une variabilité morphologique (Battandier & Trabut, 1888 ; Puech, 1987 ; Puech, 1988 ; Puech, 1992) qui peut se traduire par des garnitures chromosomiques caractérisant des populations soumises à des conditions de milieu différentes (Fahmy, 1955 ; Humphries et al., 1978 ; Puech, 1987 ; Hanifi, 1988 ; Puech, 1988 ; Puech, 1992 ; Pramanick & Raychaudhuri, 1997 ; Puech, 1998 ; Amin et al., 2002 ; Ronsted et al., 2002 ; Veiga-Barbosa & Perez-Garcia, 2014 ; Maamri et al., 2016).
4L’influence des conditions du milieu sur la variation des caractères morphologiques mais également sur la croissance et la reproduction a été démontrée par de nombreuses études réalisées en zone aride pour des taxons appartenant aux Cyperaceae, Poaceae, Fabaceae et aux Plantaginaceae dont P. albicans (Gorenflot, 1959 ; Aronson et al., 1992 ; Chaieb et al., 1992 ; Chaieb & Henchi, 1992 ; Van Tienderen, 1992 ; Naczi et al., 1998 ; Benfadel et al., 2000 ; Del Pozo et al., 2002 ; Kigel et al., 2011). Les travaux de Puech (1987, 1988, 1992) sur des populations de P. albicans de Tunisie et du Maroc ont permis de mettre en évidence une réduction de la taille des individus en relation avec la taille et la production des graines chez les populations des zones arides par rapport à celles des zones humides traduisant, selon l’auteur, « une adaptation aux conditions climatiques ». Chaieb & Henchi (1992) ont montré l’influence des contraintes hydriques sur le cycle de développement et la teneur de certains métabolites chez des populations de P. albicans en zone aride tunisienne. En Algérie, les travaux réalisés sur cette pastorale à rosette sont fragmentaires. Hormis ceux qui ont essentiellement concerné les caryotypes des populations du Sud-Oranais (Hanifi, 1988) et du Sud-Algérois (Maameri et al., 2016), l’analyse écologique de l’espèce et son intérêt indicateur (Benhamada-Driouèche, 2000), peu d’auteurs se sont intéressés à la variabilité des caractères morphologiques de P. albicans. Comme la variabilité des caractères morphologiques de P. albicans est observable sur le terrain, et soulignée dès la fin du 19e siècle, l’objectif de cette étude est d’établir une relation entre cette variabilité et les facteurs écologiques des milieux dont sont issues plusieurs populations de cette espèce récoltées au Sud-Ouest algérien le long d’un transect nord-sud. À cet effet, nous avons testé in situ la variabilité morphologique de cette psammophyte en mesurant les caractères les plus variables selon Lamarck (1804) et qui concernent le port de la plante ainsi que la taille des feuilles et des épis. Parallèlement, les facteurs stationnels ont été décrits pour chaque milieu dont est issue la population.
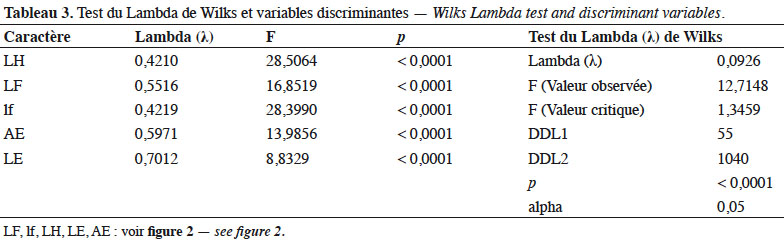
2. Matériel et méthodes
2.1. Zone d’étude
5La zone d'étude est située dans la partie ouest des Hautes Plaines steppiques du Sud-Oranais. Elle s’étend le long d’un transect reliant, sur plus de 200 km, la région d'El Aricha au nord à celle de Ain Sefra au sud sur le piémont nord de l’Atlas (Figure 1).
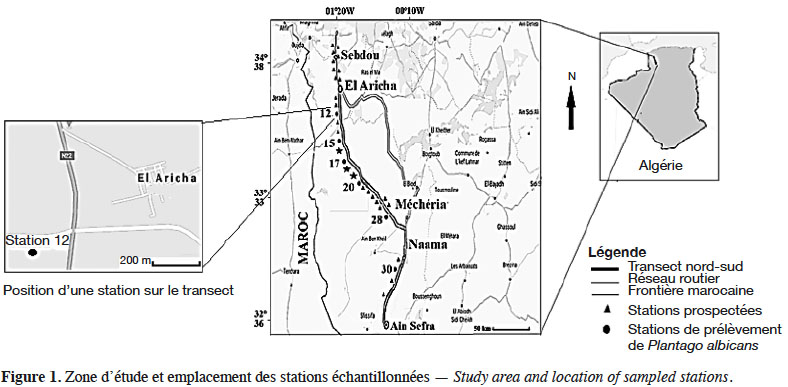
6Du point de vue climatique, selon les données de l’Office national de Météorologie pour la période 1985-2013, la pluviosité moyenne annuelle varie de 325 mm à 270 mm au sud d’El Aricha (12 et 15), de 250 à 220 mm au nord et au sud de Abdelmoula (17, 20 et 28). Elle atteint 292 mm au sud de Naama (30) (Figure 1). Les températures maximales du mois le plus chaud (M) varient de 34,7 °C à 36,4 °C dans l’ensemble des stations. Les températures minimales du mois le plus froid (m) oscillent entre 1,35 °C et 1,9 °C et atteignent 0,5 °C au sud de Naama. Les valeurs du quotient pluviothermique d’Emberger (Q2), calculées pour la période 1985-2013, permettent de classer l’ensemble de la zone d’étude dans l’étage bioclimatique aride frais. La végétation, largement dominée par le complexe à M. tenacissima, A. herba-alba et L. spartum (Aidoud-Lounis, 1984), a subi de profonds changements sur le plan dynamique durant les 40 dernières années (Slimani & Aidoud, 2018). L’alfa, qui se présentait en mélange avec l’armoise au nord et avec le Lygeum au sud de Méchéria (Benhamada-Driouèche, 2000) a disparu de certaines stations tel que cela est rapporté par Lahmar-Zemiti & Aidoud (2016) et Slimani & Aidoud (2018). Les formations à A. herba-alba sont représentées par les faciès dégradés typiques à Peganum harmala L. dans les zones de campement des nomades. Les faciès à Noaea mucronata (Forssk.) Asch. & Schweinf. recouvrent les zones planes décapées pourvues d’une fine pellicule de glaçage (Achour, 1983). Selon Omari (2005), Hirche et al. (2011), Lahmar-Zemiti & Aidoud (2016) et Slimani & Aidoud (2018), l’armoise aurait tendance à être supplantée par Salsola et Atractylis indiquant l’intensité de la dégradation par le surpâturage. Hourizi et al. (2017) confirment l’extension actuelle de la steppe à Atractylis serratuloides (Cass.) DC. sur des étendues très vastes. Entre El Aricha et Abdelmoula, l’espèce est en mélange avec A. herba-alba et N. mucronata et avec L. spartum dans les mekmènes ensablés1. Au sud de Naama et à des altitudes plus élevées, A. serratuloides s’associe à M. tenacissima et L. spartum. Ce dernier, selon Hourizi (2017) et Slimani & Aidoud (2018), semble occuper peu à peu les espaces d’où l’alfa a été éliminé. La steppe à Arthrophytum scoparium (Pomel) Ilijn, dont la dominance s’accentue avec l’aridité, est observée dans la région d’Ain Sefra. La géomorphologie est dominée par des glacis d’érosion du quaternaire ancien, moyen et récent soumis à des phénomènes d’érosion et d’apport éolien (CRBT, 1978).
2.2. Espèce étudiée
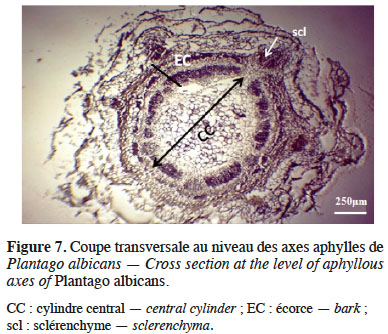
7Notre description des plants de P. albicans restitue celles des flores de Coste (1906), Lamarck & de Candolle (1805). C’est une petite herbacée vivace de 10 à 40 cm de hauteur, un peu gazonnante, à souche ligneuse qui émet des rameaux épigés. La racine est ligneuse, blanchâtre, souvent divisée au sommet. Les feuilles, dressées, lancéolées linéaires, pointues, ondulées, rétrécies en pétiole, couvertes de poils argentés, s’insèrent en rosette radicale. Les hampes florales cylindriques, couvertes de poils, dépassent les feuilles. L'épi cylindrique, lâche, est souvent interrompu à sa base. Dans certains biotopes, sous la rosette de feuilles, des axes érigés brun foncé font jonction avec la racine comme représenté dans la figure 2. Il est à souligner que cette particularité morphologique, dont il faudrait déterminer la nature de tige ou de racine, s’observe dans les biotopes affectés par des phénomènes de dépôts-déflation du voile sableux. Nous avons cependant gardé le nom d’axe aphylle pour éviter toute confusion avec la tige qui, rappelons-le, est habituellement très courte dans le cas de P. albicans.

2.3. Échantillonnage à l’échelle régionale
8L’échantillonnage systématique adopté le long d’un transect nord-sud dans le Sud-Oranais pour l'étude des communautés végétales (Benhamada-Driouèche, 2000) nous a permis de prospecter 32 stations. Six stations dans lesquelles la représentativité de P. albicans se prêtait à une analyse morphométrique ont été retenues (Figure 1) et différents biotopes ont été définis en fonction de l’hétérogénéité phytoécologique de chaque station. Ces biotopes, échantillonnés à plus de 200 m de l’axe routier, représentent les touffes des espèces dominantes physionomiquement : Macrochloa tenacissima (St), Atractylis serratuloides (As) et Noaea mucronata (Nm) et les zones inter-touffes. Ces dernières sont différenciées en fonction de l’importance respective des éléments à la surface du sol : éléments grossiers (Eg) vs voile sableux (Vs). La quantité de ces éléments est mesurée par la lecture d’une ligne de 10 m comportant 100 points de lecture espacés de 10 cm selon la technique de Daget & Poissonnet (1971). L’épaisseur du voile sableux a été mesurée en enfonçant une tige métallique dans le sable. La moyenne de 10 mesures de la partie enfoncée de la tige métallique a été retenue (Tableau 1).
2.4. Analyse morphométrique
9Dans chacun des 12 biotopes, nous avons récolté 20 échantillons en fin de floraison. Les mesures morphométriques ont ainsi porté sur 240 individus représentant 12 populations. Pour les feuilles, nous avons retenu les plus âgées situées à l’extrémité de la spirale fondamentale en raison de l’indice phyllotaxique (3/8) de P. albicans (Nultsch, 1998). Pour chaque individu, nous avons mesuré la longueur de la hampe florale (LH), la longueur de l’épi (LE) et des axes aphylles (AE), la longueur (LF) et la largeur (lf) des feuilles (Figure 2).
2.5. Analyse statistique
10Les données quantitatives organisées dans une matrice regroupant les 240 individus et les cinq variables morphologiques ont été traitées par une Analyse en Composantes Principales (ACP). Cette analyse descriptive permet de dégager des groupes d’unités homogènes et d’évaluer les corrélations entre les variables. En raison du caractère psammophile de P. albicans, nous avons introduit la variable écologique « épaisseur de sable » en élément supplémentaire dont la fonction est uniquement explicative et dont la relation avec les variables morphologiques est appuyée par des tests de régressions linéaires.
11Afin d’évaluer le degré de significativité des différences observées entre les populations et de mettre en évidence les caractères morphologiques distinctifs, nous avons appliqué une Analyse Factorielle Discriminante (AFD) sur la matrice des 240 individus et les cinq variables morphologiques. Cette méthode, à la fois explicative et prédictive, permet de vérifier si les groupes auxquels appartiennent les observations sont bien distincts et d’identifier les caractéristiques des groupes sur la base de variables explicatives à la fois quantitatives (caractères morphologiques) et qualitatives (les biotopes), ce qui en fait un outil décisionnel. L’ensemble des tests statistiques a été réalisé par le biais du logiciel XLSTAT 2014.5.
2.6. Nature anatomique des axes aphylles (AE)
12Les axes érigés entre la rosette de feuilles et la racine ont fait l’objet de coupes anatomiques selon le principe de la technique histologique afin de déterminer leur structure.
3. Résultats
3.1. Corrélation entre caractères
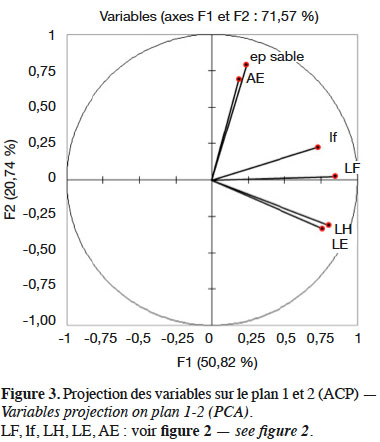
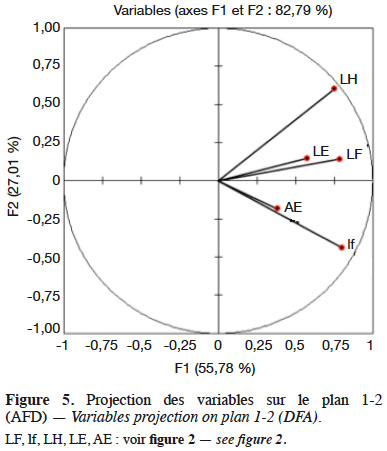
13Selon la figure 3, l’axe factoriel 1 qui extrait plus de 50 % de l’information est corrélé à la longueur (LF) et la largeur (lf) de la feuille et à la taille de la hampe florale (LH) et de l’épi (LE). L’axe 2, qui extrait 20,74 % de l’information, est corrélé à la longueur des axes aphylles (AE) et à l’épaisseur du sable (ep).
14La figure 4 montre l’organisation des populations sur le plan des axes 1-2 en trois ensembles :
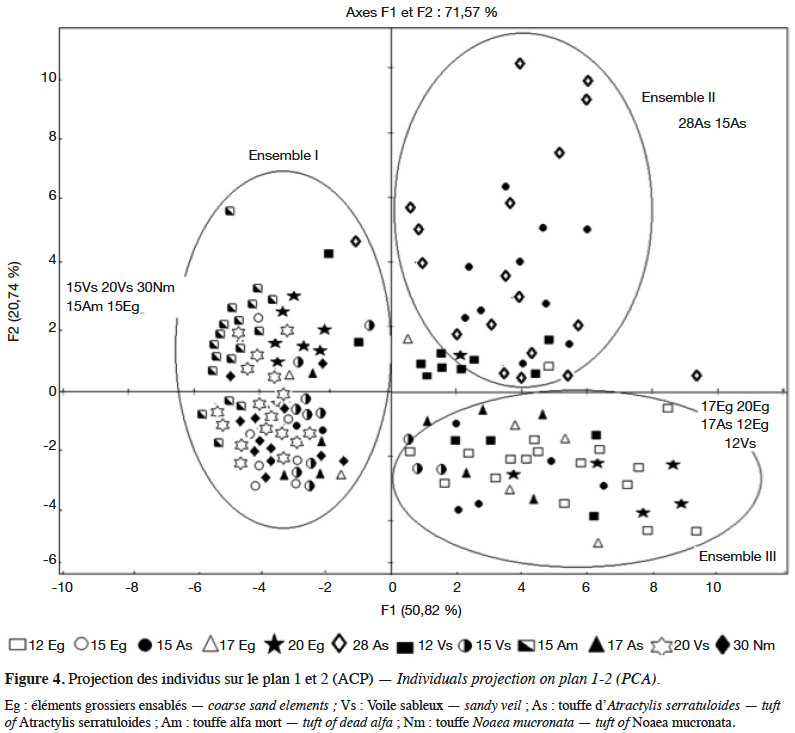
15– l’ensemble I, dans la partie négative de l’axe 1, regroupant des populations avec des hampes florales et des épis courts, des feuilles étroites et courtes et des axes aphylles courts (15Eg, 15Vs, 20Vs, 30Nm, 15Am) ;
16– l’ensemble II, dans les portions des parties positives des axes 1 et 2, rassemblant des populations à hampes florales et épis de grande taille, feuilles longues et larges et axes aphylles longs (28As et 15As) ;
17– l’ensemble III, dans la partie positive de l’axe 1 et négative de l’axe 2, incluant des populations avec des hampes florales et des épis de grande taille, des feuilles longues et des axes aphylles plus courts (12Eg, 12Vs, 17Eg, 20Eg, 17As).
18L’axe 1 oppose, dans sa partie négative, les populations de petite taille (ensemble I) à celles de grande taille (ensembles II et III) dans sa partie positive. L’axe 2 distingue les ensembles II et III en fonction de la « longueur des axes aphylles » : les plus grands dans la partie positive (II) et les plus petits dans la partie négative (III).
3.2. Relation entre les caractères morphologiques et l’épaisseur du voile sableux
19Les résultats des régressions linéaires recherchées entre l’épaisseur du voile sableux (ep) et les caractères morphologiques montrent que 57 % de la variance de la longueur de l’axe aphylle sont expliqués par la variation de l’épaisseur du voile sableux. Cette proportion est plus faible pour les autres variables morphologiques (Tableau 2).
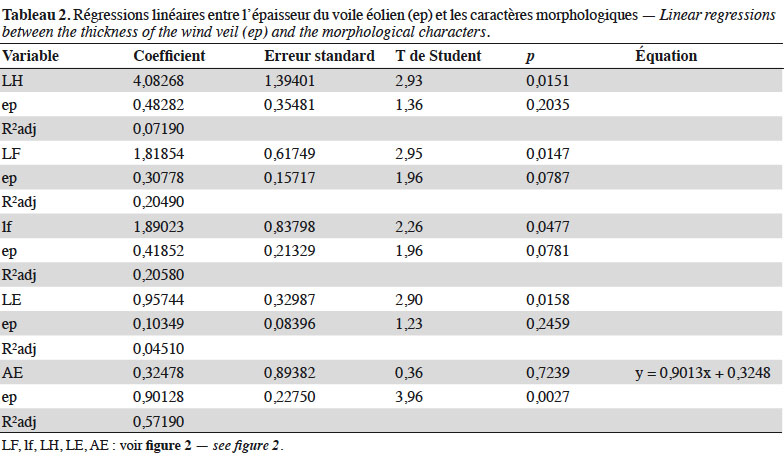
3.3. Caractères discriminants
20La figure 5 désigne comme variables contributives à l’axe 1, qui extrait 55,78 % de la variance, la longueur (LF) et la largeur (lf) de la feuille et la longueur de la hampe florale (LH).
21Une meilleure discrimination (λ = 0,0926, p < 0,0001) pour les populations est assurée en fonction de l’axe 1 par la longueur de la hampe florale (λ = 0,4210 ; p < 0,0001) et la largeur de la feuille (λ = 0,4219 ; p < 0,0001) (Tableau 3).
22La représentation graphique des 240 individus, classés avec 65,83 % de succès sur la base des cinq caractères inclus dans le modèle, permet de distinguer trois ensembles (Figure 6) :
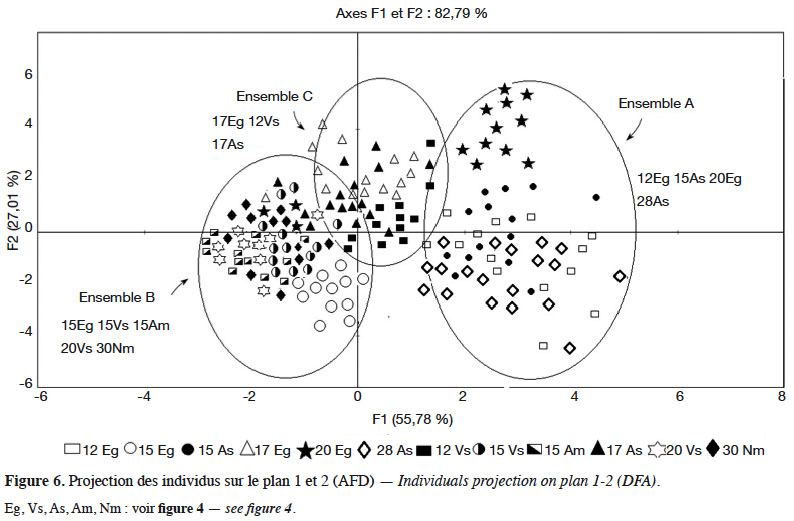
23– l’ensemble A dans la partie positive de l’axe 1 englobe les populations avec de grandes hampes florales et des feuilles larges (28As, 15As, 12Eg, 20Eg) ;
24– l’ensemble B, globalement dans la partie négative des axes 1 et 2, rassemble les populations avec des feuilles étroites et des hampes florales courtes (15Eg, 15Vs, 20Vs, 15Am, 30Nm) ;
25– l’ensemble C, moins individualisé que les précédents sur lesquels il empiète, est centré sur l’axe 1 tout en s’étendant en grande partie sur la partie positive de l’axe 2. Il réunit les populations caractérisées par de grandes hampes florales et des feuilles étroites (17Eg, 17As, 12Vs).
3.4. Structure anatomique des axes aphylles
26Les coupes anatomiques réalisées sur les axes aphylles (Figure 7) révèlent un cylindre central plus important que l’écorce, une superposition franche du xylème et du phloème avec la présence d’un tissu aérifère autour d’un amas de sclérenchyme cortical et un épiderme stomatifère, ce qui nous permet de conclure à une structure anatomique de tige.
4. Discussion
27Plantago albicans est une plante pastorale à haute valeur nutritive (Le Houerou & Ionesco, 1973) très commune en Algérie. C’est une psammophyte (Bendali, 1987 ; Le Houerou, 1995) qui se satisfait d’un simple voile sableux en surface (Pouget, 1980), mais peut tolérer un ensablement allant jusqu’à 10 cm d’épaisseur selon Bendali et al. (1990) et Hanifi (2007). Dans la région du Sud-Oranais, la tolérance de P. albicans à l’ensablement semble être en relation avec la variation de la taille des axes aphylles. Au fur et à mesure de la croissance de la tige, de nouvelles feuilles sont insérées et les plus anciennes, situées à la périphérie, sont perdues (Gorenflot, 1959). Cette partie de la plante dépourvue de feuilles, dont les coupes anatomiques ont révélé une structure de tige, est plus ou moins enfouie sous le sable. Lorsque l’ensablement est trop important, cet axe surélève la partie feuillée photosynthétique évitant ainsi l’ensevelissement de la plante « par allongement des tiges », comme le note Bowers (1982). Une réaction similaire de L. spartum à l’ensevelissement dans une plaine alluviale dans le Sud-Algérois est décrite par Aidoud-Lounis (1989).
28Lorsque les dépôts sableux sont plus faibles, ils favorisent la croissance et le développement des plantes (Melzi, 1993) en rentabilisant le mieux l’eau de pluie (Bendali, 1987 ; Rognon, 1993) et en réduisant l’évaporation par l’effet self mulching (Aidoud-Lounis, 1984 ; Le Floc’h et al., 1995 ; Sidi Mohamed et al., 2002 ; Henni & Mehdadi, 2012). En conséquence, des réponses morphologiques différentes sont observées chez les populations de P. albicans selon les niveaux des dépôts sableux dans les différents biotopes « inter-touffes ». Ces réponses sont exprimées essentiellement par les caractères de la feuille, la largeur en particulier et la longueur de la hampe florale. Les populations à hampes florales longues et à feuilles larges se distinguent de celles à hampes florales courtes et feuilles étroites. La corrélation de ces deux variables à celle de l’épi suggère une relation entre la taille de l’appareil végétatif et celle de l’appareil reproducteur déjà montrée par Gorenflot (1959) pour Plantago coronopus L. et par Puech (1987) pour P. albicans. Ainsi, dans les biotopes « Eg » où le sable est piégé par les éléments grossiers, la taille des feuilles et de l’appareil reproducteur est plus grande chez les populations 12Eg et 20Eg prélevées sur un voile sableux d’épaisseur moyenne de 3,59 à 4,27 cm. Lorsque l’épaisseur du sable est plus faible (1,85 cm - 2,97 cm), conjuguée à une installation de la pellicule de glaçage (28 % à 31 %), la taille des feuilles et de l’appareil reproducteur est plus réduite (17Eg et 15Eg). Cela pourrait s’expliquer par une faible utilisation de l’eau du sol par ces populations en raison d’une aridité édaphique (Floret et al., 1992) accentuée par une faible infiltration de l’eau à travers la pellicule de glaçage (Bendali, 1987 ; Sidi Mohamed et al., 2002). Dans le biotope « Vs », l’effet bénéfique du voile sableux éolien sur la végétation (Floret & Pontanier, 1978) semble amoindri par l’extension de la surface pelliculaire (31 à 40 %) dans ces biotopes et qui s’accompagne très souvent, selon Bendali (1987), d’une baisse des capacités de stockage de l’eau utile à la végétation. En conséquence, nous remarquons une réduction de la taille des feuilles et celle de l’appareil reproducteur chez les populations 15Vs et 20Vs.
29Les biotopes « touffes », représentés par les espèces pérennes structurantes (A. serratuloides, N. mucronata et M. tenacissima mort), sont dits safe sites par Harper (1977). Ces espèces pérennes à port végétatif dressé créent des conditions micro stationnelles de « température, d’humidité et de matière organique favorables à l’installation des petites vivaces et éphémères » (Floret, 1982 ; Bendali et al., 1990). Nous constatons des réponses morphologiques différentes des populations de P. albicans qui semblent être étroitement liées au type du couvert végétal et à la teneur en matière organique. En effet, la taille des feuilles et de l’appareil reproducteur est plus grande sous A. serratuloides (15As, 28As) où le taux de matière organique est élevé (1,15 % - 1,48 %), elle est plus réduite sous M. tenacissima mort et sous N. mucronata (15Am, 30Nm) où le taux est faible (0,15 %-0,22 %). Selon Leprun (1988), les teneurs élevées en matière organique s’accompagnent d’une amélioration de la structure du sol, de la facilité d’infiltration de l’eau et de l’accroissement de sa capacité de rétention dont « l’efficacité d’utilisation dépend étroitement du couvert végétal » (Floret & Pontanier, 1978 ; Floret, 1982). Il semble ainsi que les réserves hydriques sont plus disponibles sous A. serratuloides, permettant une meilleure croissance des feuilles et de l’appareil reproducteur, et plus déficientes sous M. tenacissima mort et sous N. mucronata, réduisant la taille de l’appareil reproducteur et celle des feuilles, particulièrement la largeur, comme le confirme Elhaak (1990). Par ailleurs, lorsque la matière organique est rapidement minéralisée, comme c’est le cas sous A. serratuloides (C/N = 4,11-10,2), l’absorption optimale des éléments nutritifs nécessaires au développement de la plante et des racines est stimulée par l’azote libéré (N’dayegamiye et al., 2007 ; Ben Hassine et al., 2008), ce qui favoriserait la croissance foliaire et celle de l’appareil reproducteur. Sous M. tenacissima mort et sous N. mucronata, la décomposition de la matière organique est plus lente (C/N = 18-16,58), l’azote reprend sa forme organique qui n’est plus directement disponible pour les plantes (Giroux & Audesse, 2004), ce qui justifierait la réduction de la taille des variables mesurées chez ces populations.
30La variabilité morphologique, mise en évidence par les différents tests statistiques, ne semble pas être sous l’influence du bioclimat, comme il ressort dans les travaux réalisés sur le genre Plantago ou sur d’autres espèces des régions arides (Puech, 1987 ; Puech, 1988 ; Aronson et al., 1992 ; Puech, 1992 ; Van Tienderen, 1992 ; Naczi et al., 1998 ; Del Pozo et al., 2002 ; Kigel et al., 2011) en raison de la relative homogénéité bioclimatique de notre dition. Elle serait liée à la combinaison de facteurs stationnels et à la diversité biologique des biotopes caractérisant les stations étudiées, comme développé par Chaieb & Henchi (1992) pour P. albicans et par Benfadel et al. (2000) pour Hedysarum carnosum Desf. et Argyrolobium uniflorum Harv. dans la zone aride tunisienne. Cette variabilité semble s’expliquer par une plasticité phénotypique qui permet à P. albicans de s’accommoder des conditions caractérisant chaque biotope (Ozenda, 1982). Cette plasticité phénotypique traduit l’aptitude d’une espèce à exprimer différents phénotypes en fonction de son environnement (Bradshaw, 1965 ; Schlichting, 1986 ; Scheiner, 1993 ; Ghalambor et al., 2007).
5. Conclusions
31La différence morphologique observée entre les populations de P. albicans du Sud-Oranais est particulièrement prononcée pour la largeur de la feuille et la longueur de la hampe florale. Ces caractères, fortement discriminants, sont corrélés à la longueur de la feuille et à celle de l’épi, suggérant une relation entre l’appareil végétatif et l’appareil reproducteur. La diversité des biotopes dans les stations étudiées exprimée par les touffes des espèces pérennes structurantes et les espaces inter-touffes et qui se traduit par une différence dans la constitution chimique du sol peut être à l’origine de différences entre les populations et expliquer la variabilité des caractères. Ainsi, une meilleure performance est observée chez les populations récoltées sous les touffes à A. serratuloides et sur éléments grossiers ensablés où la matière organique et le voile sableux permettent une bonne infiltration de l’eau et un enrichissement du sol en éléments minéraux en faveur d’une croissance foliaire et de celle de l’appareil reproducteur. Cette performance est moins perceptible et plus faible sous les touffes de M. tenacissima mort et sur voile sableux éolien où les conditions hydriques et de matière organique sont moins favorables, conjuguées à une extension de la surface pelliculaire. La variabilité des caractères des populations de P. albicans semble traduire une plasticité phénotypique, c'est-à-dire l’aptitude de l’espèce à exprimer différents phénotypes selon les conditions du milieu et souligne sa capacité à occuper des milieux fortement ensablés en surélevant la partie photosynthétique par des axes aériens aphylles. Cette phénoplasticité reste à évaluer. En outre, et pour mieux comprendre les réactions morphologiques de P. albicans aux conditions du milieu dans la région du Sud-Oranais, il serait intéressant d’élargir les variables mesurées à celles des inflorescences et des fleurs, de tester la productivité des graines et leur pouvoir germinatif et vérifier la relation entre la variabilité morphologique et la garniture chromosomique.
32Les auteurs remercient le professeur N. Bouguedoura, S. Trabsi, Z. Khedache et R. Hourizi de l’USTHB pour leurs contributions, ainsi que l’ingénieur N. Chabhouni du CRZA (Centre de Recherche sur les Zones Arides) pour son assistance technique.
Bibliographie
Achour H., 1983. Étude phytoécologique des formations à alfa (Stipa tenacissima) du Sud-Oranais, wilaya de Saida. Thèse de doctorat : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Aidoud-Lounis F., 1984. Contributions à la connaissance des groupements à sparte (Lygeum spartum L.) des hauts plateaux sud-oranais. Étude phytoécologique et syntaxonomique. Thèse de doctorat : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Aidoud-Lounis F., 1989. Les groupements végétaux du bassin versant du chott Ech-Chergui (hauts plateaux Sud-Oranais), caractérisation phytoécologique. Biocénose, 4, 1-27.
Aidoud-Lounis F., 1997. Le complexe alfa-armoise-sparte (Stipa tenacissima L., Artemisia herba-alba Asso, Lygeum spartum L.) des steppes arides d’Algérie : structure et dynamique des communautés végétales. Thèse de doctorat : Université d’Aix-Marseille (France).
Amin A.W., Migahid M.M., El-Bakatoshi R.F. & El-Sadek L.M., 2002. Molecular characterization of Plantago albicans L. populations to response to edaphic variations. J. Biol. Sci., 5(9), 983-987, doi.org/10.3923/pjbs.2002.983.987
Aronson J. et al., 1992. Restoration and rehabilitation of degraded ecosystems in arid and semi-arid lands. I. A view from the south restauration. Ecology, 1, 8-17, doi.org/10.1111/j.1526-100x.1993.tb00004.x
Ayyad M., Abdel-Razik M. & Mehenna A., 1984. Climatic and vegetation gradients in the Mediterranean desert of Egypt. Bull. Soc. Bot. Fr. Actual. Bot., 131(2-4), 129-143, doi.org/10.1080/01811789.1984.10826655
Battandier J.A. & Trabut L., 1888. Flore de l’Algérie. Alger : Typographie Adolphe Jourdan.
Battandier J.A. & Jahandiez E., 1920. Plantes recueillies au Maroc. Bull. Soc. Hist. Nat. Afr. Nord, 2(6), 129-180.
Belouam N., Beraud-Faved F. & Claudin J., 1975. Étude écologique de la Z.D.I.P. d’El Biod (Méchéria). Alger : Étude D.E.M.R.H.
Ben Hassine H. et al., 2008. Évaluation quantitative et rôles de la matière organique dans les sols cultivés en zones subhumides et semi-arides méditerranéennes de la Tunisie. Agrosolutions, 2, 4-17.
Bendali F., 1987. Dynamique de la végétation et mobilité du sable en Jeffara tunisienne. Médenine, Tunisie : Institut des Régions Arides ; Paris : ORSTOM ; Montpellier, France : Centre Louis Emberger, CNRS.
Bendali F., Floret C., Le Floc’h E. & Pontanier R., 1990. The dynamics of vegetation and sand mobility in arid regions of Tunisia. J. Arid Environ., 18, 21-32.
Benfadel N., Zouali Y. & Boussaid M., 2000. Aptitude de deux légumineuses pastorales (Hedysarum carnosum Desf. et Argyrolobium uniflorum Jamb & Spach.) à la réhabilitation des parcours en milieu aride de la Tunisie. In : Sulas L., ed. Legumes for Mediterranean forage crops, pastures and alternative uses. Zaragoza : CIHEAM, 95-98.
Benhamada-Driouèche N., 2000. Contribution à la compréhension des processus de désertification : étude écologique de populations végétales dans les écosystèmes du sud-ouest algérien. Thèse de magister : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Bradshaw A.D., 1965. Evolutionary significance of phenotypic plasticity in plants. In: Dhavendra K., ed. Advances in Genetics, Vol. 13, 115-155, doi.org/10.1016/s0065-2660(08)60048-6
Bowers J.E., 1982. The plant ecology of inland dunes in Western North America. J. Arid Environ., 5, 199-220, doi.org/10.1016/s0140-1963(18)31444-7
Chaieb M. & Henchi B., 1992. Influence de l’aridité sur le cycle de développement, le potentiel hydrique foliaire et la teneur en certains métabolites chez Plantago albicans. Bull. Soc. Nat. Tunisie, 22, 18-22.
Chaieb M., Floret C., Le Floc’h E. & Pontanier R., 1992. Life history strategies and water ressource allocation in five pasture species of the Tunisian arid zone. Arid Soil Res. Rehabil., 6, 1-10.
Coste H., 1906. Flore descriptive et illustrée de la France, de la Corse et des contrées limitrophes. Paris : Librairie des Sciences Naturelles Paul Klincksieck.
CRBT (Centre de Recherche sur les Ressources Biologiques et Terrestres), 1978. Rapport phytoécologique et pastoral sur les Hautes Plaines steppiques de la wilaya de Saida. Alger : CRBT.
Daget P. & Poissonnet J., 1971. Une méthode d’analyse phytoécologique des prairies. Critères d’application. Ann. Agron., 22, 5-41.
Del Pozo A., Ovalle C., Aronson J. & Avendano J., 2002. Ecotypic differentiation in Medicago polymorpha L. along an environmental gradient in central Chile. I. Phenology, biomass production and reproductive patterns. Plant Ecol., 159, 119-130.
Djebaili S., 1978. Recherches phytosociologiques et écologiques sur la végétation des Hautes Plaines steppiques et de l’Atlas saharien algérien. Thèse de doctorat : Université des Science et Techniques du Languedoc, Montpellier (France).
El Hakim W., 1986. Enumeratio plantarum syriae. Nat. Monspeliensia, 51.
Elhaak M.A., 1990. Response of Plantago albicans leaves of environmental drought. Feddes Repertorium, 101, 645-650, doi.org/10.1002/fedr.19901011115
Fahmy T.Y., 1955. La cytologie du Plantago albicans en Tunisie. Montpellier, France : Recueil des travaux des Laboratoires de Botanique, Géologie et Zoologie de la Faculté des Sciences de l’Université de Montpellier, Série Botanique, Fascicule 7, 115-126.
Floret C.H., 1982. L’aridité en Tunisie présaharienne : climat, sol, végétation et aménagement. Thèse de doctorat : Université des Science et Techniques du Languedoc, Montpellier (France).
Floret C. & Pontanier R., 1978. Étude des relations climat-sol-végétation de quelques formations végétales naturelles du Sud Tunisien (production-bilan hydrique des sols). Médenine, Tunisie : Institut des Régions Arides ; Montpellier, France : Centre Louis Emberger, CNRS.
Floret C., Le Floc’h E. & Pontanier R., 1992. Perturbations anthropiques et aridification en zone présaharienne. In : L’aridité, une contrainte au développement. Paris : ORSTOM, 449-463.
Ghalambor C.K., Mckay J.K., Carroll S.P. & Reznick D.N., 2007. Adaptive versus non-adaptive phenotypic plasticity and the potential for contemporary adaptation in new environments. Funct. Ecol., 21, 394-407, doi.org/10.1111/j.1365-2435.2007.01283.x
Giroux M. & Audesse P., 2004. Comparaison de deux méthodes de détermination des teneurs en carbone organique, en azote total et du rapport C/N de divers amendements organiques et engrais de ferme. Agrosol, 15, 107-109.
Gorenflot R., 1959. Le polymorphisme de Plantago coronopus L. Ses manifestations et ses causes. Rev. Cytol. Biol. Vég., 20, 237-499.
Greuter W.R., Burdet H.M. & Long G., 1989. Med-cheklist. Genève : Conservatoire et Jardin Botanique.
Hanifi N., 1988. Contribution à l’inventaire caryologique de quelques espèces steppiques d’Algérie. Ann. Inst. Nat. Agron. El Harrach, 12, 716-727.
Hanifi N., 2007. La régénération des populations végétales selon un transect bioclimatique nord-sud en Algérie. Thèse de doctorat : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Harper J.L., 1977. Population biology of plants. London: Academic Press.
Henni M. & Mehdadi Z., 2012. Évaluation préliminaire des caractéristiques édaphiques et floristiques des steppes à armoise blanche dégradées réhabilitées par la plantation d’Atriplex dans la région de Saïda (Algérie occidentale). Acta Bot. Gallica, 159, 43-52.
Hirche A. et al., 2011. Landscape changes of desertification in arid areas: the case of south-west Algeria. Environ. Monit. Assess., 179, 403-420, doi.org/10.1007/s10661-010-1744-5
Hourizi R., 2017. Suivi de la désertification des steppes à Lygeum spartum par l’utilisation de la télédétection et des systèmes d’informations géographiques. Thèse de doctorat : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Hourizi R., Hirche A., Djellouli Y. & Nedjraoui D., 2017. Changements spatio-temporels des paysages steppiques d’Algérie. Cas de la région de Méchéria. Rev. Ecol. Terre Vie, 72, 33-47.
Humphries C.J., Murray B.G., Bocquet G. & Vasudevan K., 1978. Chromosome numbers of phanerogams from Morocco and Algeria. Botaniska Notiser, 131, 391-406.
Kaabeche M., 1990. Les groupements végétaux de la région de Bou-Saada. Essai de synthèse sur la végétation steppique du Maghreb. Thèse de doctorat : Université Paris-Sud (France).
Kadi-Hanifi-Achour H., 1998. L’alfa en Algérie. Syntaxonomie, relation milieu-végétation, dynamique et perspectives d’avenir. Thèse de doctorat : Université des Sciences et de la Technologie Houari Boumédiène, Alger (Algérie).
Kigel J. et al., 2011. Relationships between flowering time and rainfall gradients across Mediterranean-desert transects. Israel J. Ecol. Evol., 57, 91-109, doi.org/10.1560/ijee.57.1-2.91
Lahmar-Zemiti B. & Aidoud A., 2016. Suivi à long terme dans la steppe d’armoise blanche (Artemisia herba-alba Asso) du Sud-Oranais (Algérie). Rev. Ecol. Terre Vie, 71, 168-177.
Lamarck J.P. & De Candolle A.P., 1805. Flore française ou descriptions succinctes de toutes les plantes qui croissent naturellement en France, disposées selon une nouvelle méthode d’analyse et précédées par un exposé des principes élémentaires de la botanique. Vol. 3. 3e ed. Paris : H. Agasse.
Lamarck J.P., 1804. Encyclopédie méthodique. Vol. 5. Paris : Libraire Panckoucke, 367-394.
Le Floc'h E., Neffati M., Chaïeb M. & Pontanier R., 1995. Un essai de réhabilitation en zone aride. Le cas de Menzel Habib (Tunisie). In : Pontanier R., ed. L'homme peut-il refaire ce qu'il a défait ? Paris : John Libbey Eurotext, 139-160.
Le Houerou H.N., 1969. La végétation de la Tunisie steppique. Ann. Inst. Nat. Rech. Agron. Tunis, 42(5).
Le Houerou H.N. & Ionesco T., 1973. L’appétibilité des espèces de la Tunisie steppique. Rome : FAO.
Le Houerou H.N., 1995. Bioclimatologie et biogéographie des steppes arides du Nord de l’Afrique : diversité biologique, développement durable et désertisation. Montpellier, France : CIHEAM.
Leprun J. C., 1988. Matière organique et conservation des sols, exemples brésiliens. Cah. ORSTOM Sér. Pédol., 24(4), 333-334.
Maamri F. et al., 2016. Karyotype studies on eight populations of Plantago albicans L. from Algeria. Caryologia, 69(2), 102-110, doi.org/10.1080/00087114.2015.1109952
Melzi S., 1993. Évolution de la végétation et du milieu dans la région présaharienne des steppes algériennes. Sécheresse, 4, 113-116.
N’dayegamiye A., Giroux M. & Gasser M., 2007. La contribution en l’azote du sol reliée à la minéralisation de la matière organique : facteur climatique et régies agricoles influençant les taux de minéralisation d’azote. In : Colloque sur l’azote, 28 mars 2007, CRAAG, OAQ (Ordre des Agronomes du Québec), Drummondville, Canada, 1-11.
Naczi R.F.C., Reznicek A.A. & Ford B.B., 1998. Morphological, geographical and ecological differenciation in the Carex willdenowii complex (cyperaceae). Am. J. Bot., 85, 434-447, doi.org/10.2307/2446335
Nultsch W., 1998. Botanique générale. Bruxelles : De Boeck Université.
Omari L., 2005. Contribution à l’étude d’un écosystème à Artemisia herba-alba dans le Sud-Oranais : diagnostic phytoécologique et cartographique par télédétection spatiale. Mémoire : Université des Sciences et Technologies Houari Boumédiène, Alger (Algérie).
Ozenda P., 1958. Flore du Sahara septentrional et central. Paris : CNRS.
Ozenda P., 1977. Flore et végétation du Sahara. Paris : CNRS.
Ozenda P., 1982. Les végétaux dans la biosphère. Paris : Doin.
Pedrol J., 2009. Plantago L. In : Benedi C., Rico E., Güemes J. & Herrero A., eds. Flora Iberica. Vol. 13. Madrid : CSIC, Real Jardin Botanico, 4-38.
Pouget M., 1980. Les relations sol-végétation dans les steppes sud-algéroises. Paris : ORSTOM.
Pramanick S. & Raychaudhuri S S., 1997. DNA content, chromosome composition and isozyme pattern in Plantago L. Bot. Rev., 63, 124-139, doi.org/10.1007/bf02935929
Puech S., 1987. Fertilité, aptitudes germinatives et caryotype dans deux populations de Plantago albicans L. (Plantaginaceae) en Tunisie. Bull. Soc. Bot. Fr. Lett. Bot., 134, 145-154, doi.org/10.1080/01811797.1987.10824738
Puech S., 1988. Graines, aptitudes germinatives et caryotype de populations de Plantago albicans L. (Plantaginaceae) de Tunisie. 2. Bull. Soc. Bot. Fr. Lett. Bot., 135, 353-359, doi.org/10.1080/01811797.1988.10824811
Puech S., 1992. Productions inflorescentielles, aptitudes germinatives et garnitures chromosomiques de populations de Plantago albicans (Plantaginaceae) du Maroc. Bull. Soc. Bot. Fr. Lett. Bot., 139, 155-160, doi.org/10.1080/01811797.1992.10824951
Puech S., Rascol J.P., Michel V. & Andary C., 1998. Cytogenetics and adaptation to increasingly arid environments: the example of Plantago albicans L. (Plantaginaceae). Biochem. Syst. Ecol., 26, 267-283, doi.org/10.1016/s0305-1978(97)00111-7
Quézel P. & Santa S., 1962. Nouvelle flore de l’Algérie et des régions désertiques méridionales. Paris : CNRS.
Rognon P., 1993. Désertification et dégradation des sols. In : Séminaire, Médenine, Tunisie, programme Med-Campus.
Ronsted N., Chase M.W., Albach D.C. & Bello M.A., 2002. Phylogenetic relationships within Plantago (Plantaginaceae): evidence from nuclear ribosomal ITS and plastid trnL-F sequence data. Bot. J. Linn. Soc., 139, 323-338, doi.org/10.1046/j.1095-8339.2002.00070.x
Scheiner S.M., 1993. Genetics and evolution of phenotypic plasticity. Ann. Rev. Ecol. Syst., 24, 35-68.
Schlichting C.D., 1986. The evolution of phenotypic plasticity in plants. Ann. Rev. Ecol. Syst., 17, 667-693.
Sidi Mohamed Y.O., Neffati M. & Henchi B., 2002. Effet du mode de gestion des phytocénoses sur leur dynamique en Tunisie présaharienne : cas du parc national de Sidi Toui et de ses environs. Sécheresse, 13, 195-203.
Slimani H. & Aidoud A., 2018. Quarante ans de suivi dans la steppe du Sud-Oranais (Algérie) : changement de diversité et de composition floristiques. Rev. Ecol. Terre Vie, 73(3), 293-308.
Tutel B., Kandemir I., Kus S. & Kence A., 2005. Classification of Turkich Plantago L., species using numerical taxonomy. Turk J. Bot., 29, 51-61.
Van Tienderen P.H., 1992. Variation in a population of Plantago lanceolata along a topographical gradient. Oikos, 64, 560-572, doi.org/10.2307/3545176
Veiga-Barbosa L. & Pérez-Garcia F., 2014. Germination of mucilaginous seeds of Plantago albicans (Plantaginaceae): effects of temperature, light, pre-sowing treatments, osmotic stress and salinity. Austr. J. Bot., 62, 141-149, doi.org/10.1071/bt14034
Zahran M.A., 2010. Climate-vegetation: Afro-Asian Mediterranean and Red Sea coastal lands. Springer.
Notes
1 dépressions fermées, profondes, à bordures abruptes où affleurent de puissants bancs de calcaires lacustres (Belouam et al., 1975).

