- Home
- Volume 17 (2013)
- numéro 2
- Limites du riz Bt dans le contexte entomologique de la riziculture en Afrique sub-saharienne et à Madagascar (synthèse bibliographique)
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Limites du riz Bt dans le contexte entomologique de la riziculture en Afrique sub-saharienne et à Madagascar (synthèse bibliographique)

Editor's Notes
Reçu le 30 septembre 2012, accepté le 6 février 2013
Résumé
Dans les pays d’Afrique sub-saharienne et dans l’ile de Madagascar, la riziculture héberge de nombreuses espèces d’insectes qui ont été répertoriées et étudiées depuis près de 40 ans. La gestion des insectes ravageurs du riz au moyen d’insecticides chimiques de synthèse n’y est pas fréquente. En Asie, des variétés de riz génétiquement modifié résistantes à certains insectes (riz Bt) ont été créées dans les années 1990. Deux variétés de riz Bt ont reçu en 2009 une autorisation de commercialisation sur le territoire chinois. Aucun pays africain ne cultive du riz Bt. Il nous a semblé important d’analyser la littérature publiée sur le riz Bt et de confronter les données recueillies en Asie à la réalité du contexte entomologique de la riziculture africaine. La définition du spectre d’activité et d’efficacité des toxines de Bt constitue une première limitation rencontrée avec l’emploi des riz Bt actuellement disponibles. Par exemple, l’effet des toxines de Bt vis-à-vis des Diptères Diopsidae n’est pas connu puisque ces espèces sont uniquement présentes en Afrique. Sur le continent africain et à Madagascar, il apparait essentiel d’actualiser les connaissances en taxonomie, en biologie et en écologie des ravageurs du riz, ainsi que de mesurer plus précisément l’impact des diverses espèces d’insectes sur les rendements. Le large spectre d’espèces présentes sur le riz, qui comprend les insectes vecteurs de maladies, le risque de développement de résistance aux toxines de Bt par les insectes-cibles et le manque d’évaluation économique nous conduisent à penser que, dans l’état actuel des connaissances en Afrique, il n’apparait pas opportun d’y introduire les riz Bt actuellement disponibles.
Abstract
Limitations of Bt rice in the entomological rice cropping context in sub-Saharan Africa and Madagascar. A review. In sub-Saharan African countries and Madagascar, rice crops host many insect species, which have been inventoried and studied for almost 40 years. Management of these rice pests using synthetic chemical pesticides is not common practice. In Asia, genetically modified rice varieties (Bt rice) resistant to some insects were engineered in the 1990s. In 2009, two Bt rice varieties were authorized to be marketed in China. Bt rice is not grown in African countries. We therefore decided to analyze the published literature on Bt rice and to compare the findings with the current insect pest situation in African rice fields. The activity spectrum and the efficacy of Bt toxins represent the first limitation encountered in the use of currently available Bt rice varieties. For instance, the effect of Bt toxins against Diptera (Diopsidae) species is unknown, since these species only occur in Africa. On the African continent and in Madagascar, it would be essential to enhance or promote taxonomic, biological and ecological knowledge concerning rice pests and to more accurately measure the impact of various insect species on crop yields. The broad range of rice insect pests, including insect vectors of disease, the risk of target insects developing resistance to Bt toxins and the lack of economic assessments suggest that, with the current state of knowledge in Africa, it would be inappropriate to introduce currently available Bt rice varieties there.
Table of content
1. Introduction
1Dans les pays d’Afrique sub-saharienne et dans l’ile de Madagascar, la riziculture héberge de nombreuses espèces d’insectes qui ont été répertoriées et étudiées depuis près de 40 ans (Brenière, 1969 ; Brenière, 1983 ; Pollet, 1977). Parmi ces insectes, quelques espèces provoquent des dégâts considérés comme économiquement importants. Ces dégâts correspondent à des destructions de plantules ou des prélèvements directs au champ de parties végétales, prélèvements externes (feuilles) ou internes (tiges) qui peuvent affecter la production de panicules, ou affaiblissent la plante. Un rôle de vecteur de maladies est également attribué à d’autres espèces, comme celles reconnues vectrices des virus de la panachure jaune, maladie endémique à l’Afrique. Après la récolte, les insectes habituellement rencontrés dans les denrées stockées constituent des ravageurs importants.
2En Afrique, les pertes de production liées aux facteurs biotiques ont souvent été évaluées en employant de façon expérimentale une protection chimique de la culture. Dans sa revue de littérature, Agyen-Sampong (1988) rapporte des pertes cumulées en grains dues aux dégâts d’insectes atteignant jusqu’à 25 %, ce qui représente en Côte d’Ivoire près d’une tonne de grains non décortiqués par hectare. Parmi le complexe [maladies/mauvaises herbes/animaux], une plus grande importance est généralement accordée à l’effet des mauvaises herbes sur les pertes de rendement. Mais les pertes de récolte causées par les oiseaux avant la récolte ont été estimées à près de 12 %, en moyenne, dans la vallée du fleuve Sénégal (de Mey et al., 2010). Ainsi, sur le continent africain et à Madagascar, les problèmes liés aux insectes sont considérés comme des facteurs prioritaires de limitation de la production de riz, par exemple à Madagascar (Fujisaka et al., 1990), ou non (AfricaRice, 2011). Au demeurant, la question ne peut être tranchée sans un état des lieux quantitatif et l’on peut raisonnablement supposer que, dans de nombreux cas, même si leur abondance varie, les insectes constituent une cause importante de perte de récoltes. La large gamme de vecteurs de la panachure jaune du riz fait qu’il est probablement plus efficace d’aborder la résistance génétique du riz à cette maladie plutôt que d’étudier de manière très détaillée la maitrise de chacun des vecteurs.
3Sur le continent africain et à Madagascar, le contrôle des insectes ravageurs du riz par des insecticides chimiques de synthèse n’est pas fréquent. Il est le plus souvent réalisé avec des méthodes liées aux savoirs traditionnels, méthodes parfois réévaluées par les chercheurs, telle que la culture en bandes alternées de riz et de maïs (Nwilene et al., 2011a). L’emploi d’extraits de plantes comme le neem (Azadirachta indica A. Juss.) (Nwilene et al., 2008a), ou de leurres telles que des pousses de bambou, contre les termites (Nwilene, 2010), sont des techniques qui ont été éprouvées et recommandées. Les autres composantes de la protection intégrée employées sont la résistance génétique et une meilleure gestion de l’habitat. La mise en œuvre de cette dernière méthode doit entrainer une préservation ou une augmentation de la régulation biologique naturelle exercée par les ennemis naturels des ravageurs (Nwilene et al., 2008b).
4La technologie des plantes génétiquement modifiées résistantes à certains insectes, qui sont porteuses d’un ou de deux gènes de la bactérie Bacillus thuringiensis, d’où leur nom de plantes Bt, a été adoptée dans le cas du cotonnier et du maïs, en 1997 et 1998, respectivement, en Afrique du Sud et le cotonnier Bt (porteur des gènes cry1Ac et cry2Ab) est cultivé au Burkina Faso depuis 2008.
5En Asie, les pertes de récolte totales dues au complexe [mauvaises herbes/maladies/animaux] sont comprises entre 24 et 41 % (Savary et al., 2000). Sur ce continent, des variétés de riz génétiquement modifiées, variétés appelées « riz Bt » dans cet article, ont été créées dans les années 1990. Les premiers essais de riz Bt au champ ont été effectués dès 1997 et 1998 en Chine (Matteson, 2000) et en 2001 en Inde (High et al., 2004). Une lignée (Huahui 1) et un hybride (Bt Xianyou ou Shanyou 63), tous deux porteurs du gène fusionné cry1Ab/Ac, ont été autorisés en grande culture en 2009, en Chine (Chen et al., 2011). Mais à ce jour, aucune variété de riz Bt ne semble avoir été commercialisée (Manimaran et al., 2011).
6Compte tenu du nombre relativement faible de méthodes de lutte disponibles en Afrique, de leur efficacité partielle et de la diffusion des variétés NERICA (NEw RICe for Africa) obtenues par croisement interspécifique entre Oryza sativa L. et Oryza glaberrima Steud., il a semblé opportun, avant toute introduction de riz Bt en Afrique, d’analyser la littérature publiée sur le riz Bt et de confronter les données recueillies à la réalité du contexte entomologique actuel de la riziculture africaine.
2. Les espèces signalées comme ravageurs sur le continent africain et à Madagascar
7Le tableau 1 présente les principales espèces de Diptères et de Lépidoptères phyllophages ou foreurs de tiges de riz rencontrées sur le continent africain et leur degré d’importance selon les diverses modalités de culture du riz. Parmi les Diptères, le foreur de tiges Orseolia oryzivora Harris et Gagné (Cecidomyiidae), ou African rice gall midge, est présent dans une vingtaine de pays africains (Nwilene et al., 2011b). Ses dégâts caractéristiques sont des galles en forme de feuilles d’oignon. L’espèce est considérée comme un ravageur majeur au Nigeria (Williams et al., 2002), le plus grand pays producteur de riz en Afrique. Les Diopsidae représentent une autre famille de Diptères dont les larves forent les tiges de riz, ce qui provoque les symptômes de « cœurs morts ».
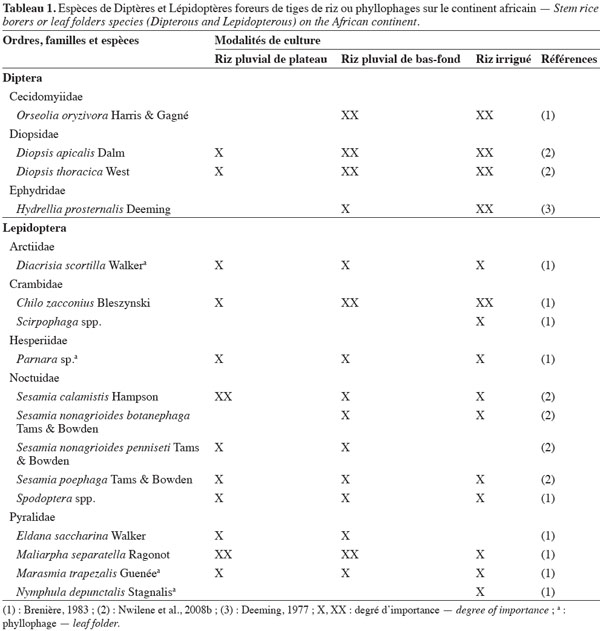
8Parmi les Lépidoptères, les espèces phyllophages des Pyralidae Marasmia trapezalis Guenée et Maliarpha separatella Ragonot (Pyralidae), ainsi que les foreurs de tiges des familles Crambidae (Chilo zacconius Bleszynski) et Noctuidae (Sesamia calamistis Hampson) sont des insectes qui interviennent de façon chronique, avec des pics de populations localisées dans l’espace et dans le temps (Alam, 1988). Le Lépidoptère Nymphula depunctalis Stagnalis (Pyralidae) est exclusivement observé en culture irriguée (Brenière, 1983). La présence de l’espèce phyllophage Cnaphalocrocis medinalis (Guenée) (Crambidae), très étudiée en Asie, a été rapportée à Madagascar (Brenière, 1983) ainsi qu’au Kenya (Kuoko, 1997). Cette espèce serait davantage présente en Afrique de l’Est. Le Crambidae Chilo partellus (Swinhoe), reconnu comme un ravageur majeur du maïs en Afrique de l’Est après son introduction accidentelle sur le continent, a été signalé au Togo (Togola, comm. pers.).
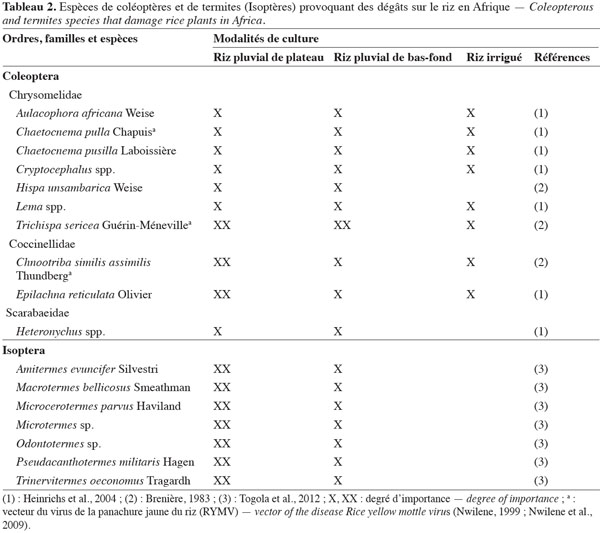
9Le tableau 2 mentionne les espèces d’Isoptères (termites) qui provoquent des dégâts sur le riz en Afrique sub-saharienne, par destruction des plants. À l’inverse des Diptères, les termites font davantage de dégâts dans les régions à pluviométrie plus faible (Togola et al., 2012). Les principaux Coléoptères Chrysomelidae vecteurs de la panachure jaune (Rice yellow mottle virus, RYMV) sont également signalés dans le tableau 2. Cette maladie a été observée pour la première fois en Afrique de l’Est où le Chrysomelidae Sesselia pusilla (Gerstaeker) a été reconnu comme vecteur (Bakker, 1970). Mais d’autres insectes vecteurs de cette maladie sont rapportés dans l’ordre des Orthoptères, avec différentes familles et espèces concernées : Tettigoniidae Conocephalus longipennis de Haan, Acrididae Oxya hyla Audinet-Serville, Pyrgomorphidae Zonocerus variegatus L., Tetrigidae Parattetix spp., Gryllidae Euscyrtus spp. (Nwilene, 1999 ; Nwilene et al., 2009).
10Des Homoptères de la famille des Aphrophoridae sont recensés comme piqueurs-suceurs de feuilles ainsi que des espèces vectrices de la panachure jaune du riz comme les Cicadellidae Cofana spectra (Distant), Cofana unimaculata (Signoret) et le Cercopidae Locris rubra (F.) (Nwilene et al., 2009). En complément des espèces déjà citées, des Hémiptères polyphages des familles Pentatomidae et Alydidae sont fréquemment rencontrés suçant les grains au stade laiteux (Heinrichs et al., 2004).
11La faune entomologique présente dans les rizières de l’ile de Madagascar a été répertoriée depuis les premiers travaux de Brenière et al. (1962) portant sur le foreur de tige M. separatella, important ravageur en riziculture pluviale de bas-fonds et sur les collines appelées « tanety » dans la région Sud Est (Raveloson Ravaomanarivo, comm. pers.). Dans le cas particulier des Coléoptères, les larves de troisième stade de certaines espèces de Melolonthidae des genres Encya, Enaria, et Hoplochelus sont responsables de dégâts majeurs sur les racines, en culture pluviale (Randriamanantsoa et al., 2010). Le traitement de semences améliore la protection des plantules contre ces insectes tout en augmentant le rendement (Ratnadass et al., 2012). Les adultes de Dynastidae des genres Heteroconus et Heteronychus sont également responsables de dégâts sur le riz. Leurs larves, essentiellement détritivores, ne s’attaquent pas aux cultures.
12L’importance économique des insectes semble être bien perçue par les producteurs de riz, tant au niveau du champ pour les foreurs de tige (Togola et al., 2010a) que dans les lieux de stockage (Togola et al., 2010b). Cependant, les pertes quantitatives imputables plus précisément aux diverses espèces d’insectes sont difficiles à évaluer. Cette évaluation est souvent faite de façon expérimentale, sur des plants en cage, au laboratoire ou en serre, dans des conditions assez éloignées de celles des rizières. Il serait pourtant essentiel de mieux estimer les pertes de rendement si l’on souhaite évaluer l’intérêt économique d’une mesure de limitation d’un groupe de ravageurs particulier, par exemple les foreurs de tiges.
3. Les riz Bt en Asie : ravageurs visés et toxines étudiées
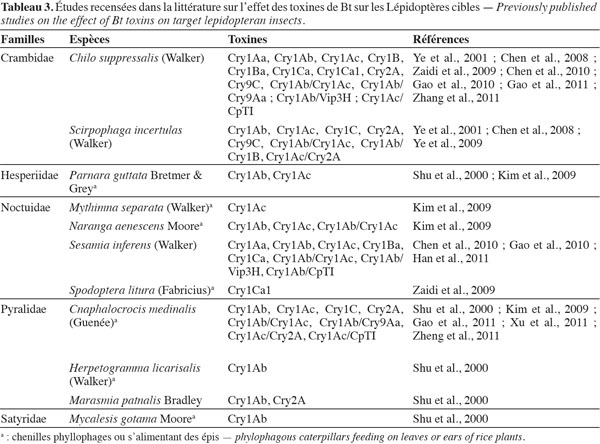
13La première transformation du riz avec un gène de la bactérie Bacillus thuringiensis (Bt) a été réalisée, selon les auteurs consultés, par Yang et al. (1989) ou Fujimoto et al. (1993). Le ou les gènes de Bt présents dans les variétés transformées appartiennent au groupe des cry (Chen et al., 2011). Les toxines de Bt produites par les plantes sont létales après ingestion par les chenilles de Lépidoptères foreurs de tiges ou les chenilles phyllophages. Le tableau 3 présente, par espèce de ravageur, les toxines évaluées. Dans cette mini-revue, seules les publications récentes sont mentionnées et font référence à des études antérieures. Les évaluations ont été réalisées au laboratoire selon la méthode des essais biologiques, avec des larves alimentées sur des milieux artificiels ou des portions de plants génétiquement transformés, ou avec les méthodes d’étude des liaisons entre toxines et récepteurs membranaires de la paroi du tube digestif. De nombreuses évaluations de plein champ ont également été réalisées, avec des plants porteurs d’un gène de Bt, ou de plusieurs gènes associés (Yang et al., 2011). Parfois, l’association a été faite avec d’autres types de gènes comme celui de l’inhibiteur de protéase digestive CpTI (Tableau 3). Les plants de riz porteurs du gène cry1Ab ont été les plus fréquemment évalués. Les Lépidoptères ravageurs sur lesquels la majorité des études a porté en Asie sont deux Crambidae, Chilo suppressalis (Walker) et Scirpophaga incertulas (Walker), le Noctuidae Sesamia inferens (Walker) et le Pyralidae Cnaphalocrocis medinalis (Guenée).
14En Asie, les dégâts occasionnés par les chenilles de ces différentes espèces sont spectaculaires sur les plantes non-Bt (non modifiées) : dégâts foliaires, talles blanches et flétries, panicules blanches. La différence visuelle entre des variétés de riz Bt et des variétés non-Bt est immédiatement perçue par les agriculteurs, qui mesurent ainsi l’efficacité des toxines produites par les plantes transformées.
15Curieusement, un faible nombre de publications rapportent l’impact obtenu sur les rendements enregistrés au champ. L’effet espéré d’augmentation du rendement est bien signalé (Xia et al., 2011 ; Wang et al., 2012a), mais pas de façon systématique. Au contraire, des pertes de rendements peuvent être notées lorsque la pression des foreurs visés par les toxines est faible (Xia et al., 2010 ; Wang et al., 2012b).
16De très nombreuses études, non présentées dans cette courte revue, ont concerné les impacts des toxines de Bt sur les communautés d’Arthropodes phytophages non cibles (Chen et al., 2012) et la faune auxiliaire (revues de Cohen et al., 2008 et de Bai et al., 2012). Les Arthropodes non cibles sont notamment les insectes piqueurs de la famille des Delphacidae tels que Nilaparvata lugens (Stål) et des Cicadellidae, comme Nephotettix cinctipes (Uhler) ou Nephotettix virescens (Distant). À la suite d’un excès d’usage d’insecticides (Matteson, 2000), mais aussi d’autres facteurs tels que la réduction des périodes de jachères, la présence de paysages comportant des parcelles cultivées avec des dates de semis très différentes, les populations de N. lugens ont provoqué de sérieux dégâts dès les années 1970. De son côté, l’espèce N. virescens constitue le principal vecteur du tungro, une maladie virale extrêmement grave. Pour la faune auxiliaire, les études réalisées n’ont pas révélé de risques majeurs sur les prédateurs, parasitoïdes et les Arthropodes présents dans ou sur le sol (insectes prédateurs ou détritivores).
4. Discussion : le riz Bt en regard du contexte entomologique de la riziculture africaine
17Le spectre d’activité et d’efficacité vis-à-vis des espèces cibles des toxines de Bt constitue une première limitation rencontrée avec l’emploi des riz Bt actuellement disponibles. En Afrique comme en Asie, une très grande diversité d’insectes est rencontrée sur les plants de riz. Les espèces africaines des genres Chilo, Sesamia et Scirpophaga seront probablement sensibles aux toxines qui affectent les espèces de ces mêmes genres présentes en Asie, mais cela reste à confirmer, de même que pour d’autres espèces de Lépidoptères comme Maliarpha separatella.
18Cependant, à notre connaissance, l’efficacité des toxines présentes dans les riz Bt n’a pas été déterminée vis-à-vis de plusieurs autres ravageurs foreurs de tiges dont l’importance économique est vraisemblable en Afrique, tels que le Diptère Cecidomyiidae Orseolia oryzivora. L’espèce asiatique du même genre, Orseolia oryzae Wood-Mason, n’apparait en effet que comme secondaire en Asie (Chen et al., 2011). De même, l’effet des toxines de Bt vis-à-vis des Diptères Diopsidae n’est pas connu puisque ces espèces sont uniquement présentes en Afrique.
19Une forte mortalité des Coléoptères par l’effet des toxines produites par les gènes de types cry1 ou cry2 actuellement introduits dans les riz Bt est peu probable, si l’on en juge par la sélectivité des toxines recensée récemment par Van Frankenhuyzen (2009). Ces insectes sont généralement plus sensibles au groupe de toxines cry3 comme par exemple la toxine Cry3Bb1 produite par le maïs génétiquement transformé pour éliminer Diabrotica virgifera virgifera LeConte (Chrysomelidae) (Vaughn et al., 2005).
20Cette diversité des espèces d’insectes à contrôler a conduit les chercheurs à proposer l’insertion simultanée de plusieurs gènes dans la même plante, pour élargir le spectre d’activité et pour retarder le risque de développement rapide de résistance aux toxines actuellement produites dans les riz Bt. Les gènes cry4Cc1, cry30Ga1, cry56Aa1 ont ainsi été proposés en Asie pour mieux maitriser les foreurs de tige (Chen et al., 2011). Des plants porteurs de gènes de lectines ont été créés afin de maitriser les insectes homoptères (Yarasi et al., 2008 ; Bharathi et al., 2011).
21Une augmentation des rendements n’est pas toujours observée avec l’emploi de riz Bt. Il faut donc étudier la question du gain économique réel qui serait apporté aux producteurs africains par les plants de riz transformés résistants aux seuls Lépidoptères phyllophages et foreurs de tige. Les connaissances sur les impacts économiques, par groupe de ravageurs, doivent être davantage développées, ou remobilisées à partir des études antérieures (Nacro et al., 1996). En Asie, par exemple, où la pression des foreurs de tiges apparait importante, les pertes de rendement sont évaluées à 2,3 % (médianes, Savary et al., 2000), 3,1 % en Chine (moyennes, Cohen et al., 2008) ou encore de 5 à 10 % (maximales, High et al., 2004). Un autre aspect important à évaluer au plan économique serait le cout des semences payé par les producteurs. En effet, pour d’autres cultures comme le cotonnier Bt, le montant des taxes technologiques à payer a pu entrainer un surcout des semences très important, y compris dans un contexte de forte compétition entre fournisseurs de semences, comme le marché chinois décrit par Fok et al. (2011).
22Enfin, une préoccupation majeure qui concerne l’ensemble des plantes Bt réside dans le risque de sélection d’insectes résistants aux toxines de Bt, qui entrainerait la perte d’efficacité des toxines vis-à-vis des insectes visés. Le cas a déjà été documenté, en Afrique du Sud, où le Lépidoptère Busseola fusca (Fuller) (Noctuidae) est considéré comme résistant à la toxine Cry1Ab produite par le maïs Bt cultivé (Van Rensburg, 2007).
23Les gènes cry1Ab et cry1Ac, présents dans certaines variétés de riz Bt parmi les plus étudiées, ont également été introduits dans d’autres plantes comme le maïs ou le cotonnier. En cas d’usage de ces types de plantes dans le même environnement que le riz, les insectes polyphages s’alimentant par exemple sur le riz et le maïs, tels que le Noctuidae Sesamia calamistis en Afrique, seraient ainsi confrontés à la même toxine avec un risque accru de développement de la résistance aux toxines.
24La stratégie « Haute Dose – Refuge », soutenue par des modèles de simulation basés sur des considérations théoriques, a été largement divulguée (Gould, 1998). Son application est recommandée après la libération commerciale d’une culture Bt. Un pré-requis indispensable pour l’application de cette stratégie est la présence de zones refuges. Ces zones doivent comprendre des plantes-hôtes des espèces d’insectes visées par les toxines de Bt, afin de favoriser le maintien dans les populations d’individus sensibles de même espèce, puisque non soumis à la pression de sélection par les toxines présentes dans les plants transformés. Ces insectes pourront ensuite se croiser avec des partenaires porteurs de gènes de résistance et ainsi réduire la fréquence de la résistance éventuelle aux toxines dans l’ensemble de la population concernée.
25Or en Asie, en dehors du riz, très peu de plantes ont été inventoriées comme véritables plantes-hôtes des Lépidoptères foreurs de tiges Chilo suppressalis et Scirpophaga incertulas (Cuong et al., 2002). La présence de populations de ces deux ravageurs non soumises à la pression de sélection des toxines de Bt n’est donc pas garantie. De plus, la mobilité des larves de ces deux espèces a été démontrée, ce qui leur permet de passer d’un plant Bt à un plant non-Bt au champ, en cas de mélanges de ces deux types de plants. L’exposition des larves à de fortes doses de toxines n’est donc pas non plus garantie.
26Ces réflexions faites en Asie nous éclairent sur les difficultés d’application de cette stratégie auprès de petits agriculteurs africains. Sur le continent africain et à Madagascar, les connaissances en taxonomie, en biologie et en écologie des ravageurs du riz sont importantes à développer, afin de répertorier les plantes-hôtes disponibles, et de caractériser les interactions ravageur/plante-hôte/ennemis naturels aux différentes échelles, du plant au paysage, démarche proposée par Savary et al. (2012). Cette approche a été réalisée dans le cas du Miridae Stenotus rubrovitattus (Matsumura), ravageur des grains de riz au Japon (Takada et al., 2012).
27Dans l’état actuel de nos connaissances et après analyse du contexte entomologique, il n’apparait donc pas opportun d’introduire les riz Bt actuellement disponibles dans les conditions africaines. En revanche, la maitrise des problèmes d’insectes par des moyens comme la gestion raisonnée des habitats, basée sur une meilleure compréhension des interactions à différentes échelles d’espace et de temps, constitue une perspective de recherche et d’application intéressante.
Bibliographie
AfricaRice (Africa Rice Center), 2011. Boosting Africa’s rice sector: a research for development strategy 2011-2020. Cotonou: CGIAR, AfricaRice.
Agyen-Sampong M., 1988. Assessment of on-farm losses in rice due to insect pests. Insect Sci. Appl., 9, 691-695.
Alam M.S., 1988. Seasonal abundance of rice stem borer species in upland and irrigated rice in Nigeria. Insect Sci. Appl., 9, 191-195.
Bai Y.Y. et al., 2012. Field response of aboveground non-target arthropod community to transgenic Bt-Cry1Ab rice plant residues in postharvest seasons. Transgenic Res., 21, 1023-1032.
Bakker W., 1970. Rice yellow mottle, a mechanically transmissible virus disease of rice in Kenya. Neth. J. Plant Pathol., 76, 53-63.
Bharathi Y. et al., 2011. Pyramided rice lines harbouring Allium sativum (asal) and Galanthus nivalis (gna) lectin genes impart enhanced resistance against major sap-sucking pests. J. Biotechnol., 152, 63-71.
Brenière J., 1969. Importance des problèmes entomologiques dans le développement de la riziculture de l’Afrique de l’Ouest. Agron. Trop., 24, 906-927.
Brenière J., 1983. Principaux ennemis du riz en Afrique de l’ouest et leur contrôle. 2e ed. Monrovia : ADRAO.
Brenière J., Rodriguez H. & Ranaivosoa H., 1962. Un ennemi du riz à Madagascar. Maliarpha separatella Rag. ou borer blanc. Agron. Trop., 17, 223-302.
Chen H., Zhang G., Zhang Q. & Lin Y., 2008. Effect of transgenic Bacillus thuringiensis rice lines on mortality and feeding behavior of rice stem borers (Lepidoptera: Crambidae). J. Econ. Entomol., 101, 182-189.
Chen M., Shelton A. & Ye G.Y., 2011. Insect-resistant genetically modified rice in China: from research to commercialization. Annu. Rev. Entomol., 56, 81-101.
Chen Y. et al., 2010. Transgenic rice plants expressing a fused protein of Cry1Ab/Vip3H has resistance to rice stem borers under laboratory and field conditions. J. Econ. Entomol., 103, 1444-1453.
Chen Y. et al., 2012. Bt rice expressing Cry1Ab does not stimulate an outbreak of its non-target herbivore, Nilaparvata lugens. Transgenic Res., 21, 279-291.
Cohen M.B. et al., 2008. Bt rice in Asia: potential benefits, impact, and sustainability. In: Romeis J., Shelton A.M. & Kennedy G.G., eds. Integration of insect-resistant genetically modified crops within IPM programs. Dordrecht, The Netherlands: Springer, 223-248.
Cuong N.L. & Cohen M.B., 2002. Field surveys and greenhouse evaluation of non-rice host plants of the striped stem borer, Chilo suppressalis (Lepidoptera: Pyralidae), as refuges for resistance management of rice transformed with Bacillus thuringiensis toxin genes. Bull. Entomol. Res., 92, 265-268.
Deeming J.C., 1977. A new species of Hydrellia Robineau-Desvoidy (Diptera : Ephydridae) attacking rice in southern Nigeria. Bull. Entomol. Res., 67, 337-341.
de Mey Y., Demont M. & Mitchell P.D., 2010. Estimated versus perceived damage control productivity: impact of birds on irrigated rice in the Senegal River Valley. In: Proceedings of the Africa Rice Congress, 22 to 26 March 2010, Bamako, Mali, 172.
Fok M. & Xu N., 2011. Variety market development: a Bt cotton cropping factor and constraint in China. AgBioForum, 14, 47-60.
Fujimoto H. et al., 1993. Insect resistant rice generated by introduction of a modified endotoxin gene of Bacillus thuringiensis. Biotechnology, 11, 1151-1155.
Fujisaka S. & FOFIFA team, 1990. Rice research priorities for Madagascar’s Middle West. IRRI Research paper Series, 144. Manila: IRRI.
Gao J. et al., 2011. Transgenic rice expressing a fusion protein of Cry1Ab and Cry9Aa confers resistance to a broad spectrum of lepidopteran pests. Crop Sci., 51, 2535-2543.
Gao Y. et al., 2010. Screen of Bacillus thuringiensis toxins for transgenic rice to control Sesamia inferens and Chilo suppressalis. J. Invertebr. Pathol., 105, 11-15.
Gould F., 1998. Sustainability of transgenic insecticidal cultivars-integrating pest genetics and ecology. Annu. Rev. Entomol., 43, 701-726.
Han L.Z. et al., 2011. Lethal and sub-lethal effects of transgenic rice containing cry1Ac and CpTI genes on the pink stem borer, Sesamia inferens (Walker). Agric. Sci. China, 10, 384-393.
Heinrichs E.A. & Barrion T.A., 2004. Rice-feeding insects and selected natural enemies in West Africa. Biology, ecology, identification. Los Baños, Philippines: International Rice Research Institute ; Abidjan: WARDA–The Africa Rice Center.
High S.M., Cohen M.B., Shu Q.Y. & Altosaar I., 2004. Achieving successful deployment of Bt rice. Trends Plant Sci., 9, 286-292.
Kim E.H. et al., 2009. Chloroplast-targeted expression of synthetic cry1Ac in transgenic rice as an alternative strategy for increased pest protection. Planta, 230, 397-405.
Kuoko, 1997. Review of Kenyan agricultural research. Vol. 15. Rice. Nairobi: KARI.
Manimaran P. et al., 2011. Bt rice evaluation and deployment strategies. GM Crops, 2(3), 135-137.
Matteson P.C., 2000. Insect pest management in tropical Asian irrigated rice. Annu. Rev. Entomol., 45, 459-474.
Nacro S., Heinrichs E.A. & Dakouo D., 1996. Estimation of rice yield losses due to African rice gall midge, Orseolia oryzivora Harris and Gagne. Int. J. Pest Manage., 42, 331-334.
Nwilene F.E., 1999. Current status and management of insect vectors of rice yellow mottle virus (RYMV) in Africa. Insect Sci. Appl., 19, 179-185.
Nwilene F., 2010. Termite management for NERICA rice in West Africa. Crop Prot., 29, 105-106.
Nwilene F.E. et al., 2008a. Efficacy of traditional practices and botanicals for the control of termites on rice at Ikenne, southwestern Nigeria. Int. J. Trop. Insect Sci., 28, 37-44.
Nwilene F.E. et al., 2008b. Integrated pest management (IPM) strategies for NERICA varieties. In: Somado E.A., Guei R.G. & Keya S.O., eds. NERICA®: the New Rice for Africa – a Compendium. Cotonou: Africa Rice Center (WARDA); Roma: FAO; Tokyo: Sasakawa Africa Association, 83-94.
Nwilene F.E. et al., 2009. New records of insect vectors of Rice yellow Mottle Virus (RYMV) in Côte d’Ivoire, West Africa. J. Entomol., 6, 198-206.
Nwilene F.E. et al., 2011a. Effect of intercropping maize and cassava with Upland NERICA rice varieties on stemborer attacks in Southwestern Nigeria. J. Entomol., 8, 417-448.
Nwilene F.E. et al., 2011b. Identification and differentiation of gall midge species from West Africa. Phytopathology, 101, 130-131.
Pollet A., 1977. Les insectes ravageurs du riz en Côte d’Ivoire. II. La faune rencontrée sur riz irrigué en Côte d’Ivoire centrale (Kotiessou). Cah. ORSTOM, 12, 3-23.
Randriamanantsoa R. et al., 2010. Les larves des Scarabeoidea (Insecta Coleoptera) en riziculture pluviale des régions des hautes et moyennes altitudes du Centre de Madagascar. Zoosystema, 32, 19-72.
Ratnadass A. et al., 2012. Protection of upland rice at lake Alaotra (Madagascar) from black beetle damage (Heteronychus plebejus) (Coleoptera : Dynastidae) by seed dressing. Afr. Entomol., 20, 177-181.
Savary S. et al., 2000. Rice pest constraints in tropical Asia: quantification of yield losses due to rice pests in a range of production situations. Plant Dis., 84, 357-369.
Savary S., Horgan F., Willocquet L. & Heong K.L., 2012. A review of principles for sustainable pest management in rice. Crop Prot., 32, 54-63.
Shu Q. et al., 2000. Transgenic rice plants with a synthetic cry1Ab gene from Bacillus thuringiensis were highly resistant to eight lepidopteran rice pest species. Mol. Breed., 6, 433-439.
Takada M.B. et al., 2012. Multiple spatial scale factors affecting mired bug abundance and damage level in organic rice paddies. Biol. Control, 60, 169-174.
Togola A. et al., 2010a. Connaissance paysanne des insectes foreurs de tiges du riz et leurs dégâts dans différentes zones écologiques du Bénin (Afrique de l’Ouest). Cah. Agric., 19, 262-266.
Togola A., Nwilene F.E., Chougourou D.C. & Agunbiade T., 2010b. Présence, populations et dégâts de l’alucite des céréales Sitotroga cerealella (Olivier) (Lepidoptera, Gelechiidae) sur les stocks de riz au Bénin. Cah. Agric., 19, 205-209.
Togola A. et al., 2012. Specific diversity and damages of termites on upland rice in Benin. J. Entomol., 9, 352-360.
Van Frankenhuysen K., 2009. Insecticidal activity of Bacillus thuringiensis crystal proteins. J. Invertebr. Pathol., 101, 1-16.
Van Rensburg J.B.J., 2007. First report of field resistance by the stem borer, Busseola fusca (Fuller) to Bt-transgenic maize. South Afr. J. Plant Soil, 24, 147-151.
Vaughn T. et al., 2005. A method of controlling corn rootworm feeding using a Bacillus thuringiensis protein expressed in transgenic maize. Crop Sci., 45, 931-938.
Wang F. et al., 2012a. Effects of N treatments on the yield advantage of Bt-SY63 over SY63 (Oryza sativa) and the concentration of Bt protein. Field Crops Res., 129, 39-45.
Wang F. et al., 2012b. Yield differences between Bt transgenic rice lines and their non-Bt counterparts, and its possible mechanism. Field Crops Res., 126, 8-15.
Williams C.T. et al., 2002. African rice gall midge research guide. Bouaké, Côte d’Ivoire: West Africa Rice development Association; Wallingford, UK: CAB International.
Xia H., Chen L., Wang F. & Lu B.R., 2010. Yield benefit and underlying cost of insect-resistance transgenic rice: implication in breeding and deploying transgenic crops. Field Crops Res., 118, 215-220.
Xia H. et al., 2011. Enhanced yield performance of Bt rice under target-insect attacks: implications for field insect management. Transgenic Res., 20, 655-664.
Xu X. et al., 2011. Field evaluation of effects of transgenic cry1Ab/cry1Ac, cry1C and cry2A rice on Cnaphalocrocis medinalis and its arthropod predators. Sci. China Life Sci., 54, 1019-1028.
Yang H. et al., 1989. Transgenic rice plants produced by direct uptake of δ-endotoxin protein gene from Bacillus thuringiensis into rice protoplasts. Sci. Agric. Sin., 22, 1-5.
Yang Z. et al., 2011. Development and characterization of transgenic rice expressing two Bacillus thuringiensis genes. Pest Manage. Sci., 67, 414-422.
Yarasi B. et al., 2008. Transgenic rice expressing Allium sativum leaf agglutinin (asal) exhibits high-level resistance against major sap-sucking pests. BMC Plant Biol., 8, 102.
Ye G.Y. et al., 2001. Field evaluation of resistance of transgenic rice containing a synthetic cry1Ab gene from Bacillus thuringiensis Berliner to two stem borers. J. Econ. Entomol., 94, 271-276.
Ye R. et al., 2009. Development of insect-resistant transgenic rice with Cry1C*-free endosperm. Pest Manage. Sci., 65, 1015-1020.
Zaidi M.A. et al., 2009. Transgenic rice plants expressing a modified cry1Ca1 gene are resistant to Spodoptera litura and Chilo suppressalis. Mol. Biotechnol., 43, 232-242.
Zhang Y. et al., 2011. Seasonal expression of Bt proteins in transgenic rice lines and the resistance against rice borer Chilo suppressalis (Walker). Environ. Entomol., 40, 1323-1330.
Zheng X. et al., 2011. Resistance performances of transgenic Bt rice lines T2A-1 and T1c-19 against Cnaphalocrocis medinalis (Lepidoptera : Pyralidae). J. Econ. Entomol., 104, 1730-1735.
To cite this article
About: Pierre Silvie
CIRAD. UPR Systèmes de Culture annuels. F-34398 Montpellier Cedex 5 (France). E-mail : pierre.silvie@cirad.fr – IRD. UR 072. Laboratoire Évolution, Génomes et Spéciation. F-91405 Orsay Cedex (France).
About: Abou Togola
Africa Rice Center (AfricaRice). 01 BP 2031. Cotonou (Bénin).
About: Cyrille Adda
Africa Rice Center (AfricaRice). 01 BP 2031. Cotonou (Bénin).
About: Francis Nwilene
Africa Rice Center (AfricaRice). Oyo Road. PMB 5320. Ibadan (Nigeria).
About: Lala Harivelo Raveloson Ravaomanarivo
Université d’Antananarivo. Faculté des Sciences. Département d’Entomologie. BP 906. Antananarivo 101 (Madagascar).
About: Philippe Menozzi
CIRAD. UPR Systèmes de Culture annuels. F-34398 Montpellier Cedex 5 (France) – Africa Rice Center (AfricaRice). 01 BP 2031. Cotonou (Bénin).






