- Portada
- Volume 18 (2014)
- numéro 4
- Explorer la banque de graines du sol pour mieux comprendre la dynamique de régénération des forêts tropicales africaines (synthèse bibliographique)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
Explorer la banque de graines du sol pour mieux comprendre la dynamique de régénération des forêts tropicales africaines (synthèse bibliographique)

Notes de la rédaction
Reçu le 18 novembre 2013, accepté le 30 juin 2014
Résumé
La banque de graines du sol des forêts denses humides africaines a été très peu étudiée, alors qu'elle pourrait jouer un rôle déterminant dans les cycles sylvigénétiques naturels. Elle pourrait également être avantageusement utilisée dans les programmes de restauration, à l'instar de ce qui se fait sur d'autres continents. La présente synthèse bibliographique fait le point sur les connaissances actuelles relatives à la banque de graines du sol, en mettant l'accent sur le continent africain. Elle montre qu'une meilleure caractérisation de la banque de graines du sol des différentes communautés végétales constituerait une contribution notable pour la gestion durable des forêts tropicales d’Afrique.
Abstract
Exploring the soil seed bank in order to gain a better understanding of the regeneration dynamic of African tropical forests. A review. The soil seed bank of the African moist forest has been very little studied in spite of the important role that it could play in natural sylvigenetic cycles. It could also be advantageously used in restoration programs, as has been seen on other continents. This review provides an update on the current knowledge regarding the soil seed bank, focusing, in particular, on the African continent. It reveals that a better characterization of the soil seed bank of different forest communities could constitute a significant contribution to the sustainable management of African tropical forests.
Tabla de contenidos
1. Introduction
1La régénération est un élément fondamental de la dynamique des écosystèmes tropicaux et de la restauration des terres forestières (Bakker et al., 2000). Le terme « régénération » est fréquemment utilisé, mais les définitions varient tant par rapport à l’élément pris en compte que par les processus mis en jeu et les échelles spatio-temporelles considérées. Ainsi, les forestiers considèrent la régénération comme l’ensemble des individus juvéniles du sous-bois des espèces arborescentes (Rollet, 1981). Cette définition se base sur ce qui est observable et dénombrable. En termes de démographie des populations, elle représente une vision du peuplement futur. Pour les écologues, la régénération est souvent perçue comme un ensemble de processus permettant à terme la reconstitution de la forêt (Alexandre et al., 1982).
2Après perturbation, les forêts peuvent se régénérer via trois compartiments :
3– le potentiel végétatif, qui correspond à la capacité des plantes à rejeter des souches ou à drageonner à partir des organes souterrains, il s’agit de régénération par voie de multiplication végétative ;
4– le potentiel séminal advectif, qui correspond aux graines déposées sur le sol, il s'agit de la pluie de graines ;
5– le potentiel séminal édaphique, qui correspond à la banque de graines du sol (Tesfaye et al., 2010).
6De ces trois composantes, la banque de graines du sol est certainement le compartiment le moins bien documenté, surtout dans les formations forestières (Garwood, 1989). Pourtant, la connaissance de la richesse, de la diversité et de l'abondance de la banque de graines du sol des forêts tropicales africaines pourrait être une source importante de régénération naturelle, notamment dans les forêts exploitées qui représentent 26 % du couvert forestiers d'Afrique centrale (Cheke et al., 1979 ; de Wasseige et al., 2009).
7La présente synthèse bibliographique ambitionne de dresser l’état des connaissances actuelles sur la banque de graines du sol des forêts tropicales, plus spécifiquement africaines. La banque de graines du sol sera d'abord définie et ses caractéristiques précisées. Ensuite, l’importance de la banque de graines du sol dans la conservation, la régénération et la restauration des écosystèmes naturels sera abordée. Ces éléments permettront finalement de cerner et d'identifier les aspects nécessitant davantage d'investigations scientifiques dans le contexte des forêts denses humides africaines.
8La recherche bibliographique ayant alimenté le présent document a été opérée via le moteur de recherche « Google Scholar » en utilisant les mots-clés suivants, en différentes combinaisons et énoncés entre guillemets afin de retrouver ces termes exacts : « soil seed bank », « seeds in the soil », « seed dormancy », « seed viability », « african tropical forest ».
2. Définitions de la banque de graines du sol
9La banque de graines du sol désigne l’ensemble des graines viables présentes dans le sol (Roberts, 1981). Il s’agit de graines non germées, mais capables de remplacer des plantes adultes qui ont disparu pour différentes raisons (Baker, 1989). Selon Simpson et al. (1989), la banque de graines du sol comprend également les graines viables présentes dans la litière et dans l’humus. Il s’agit de la banque de graines transitoires.
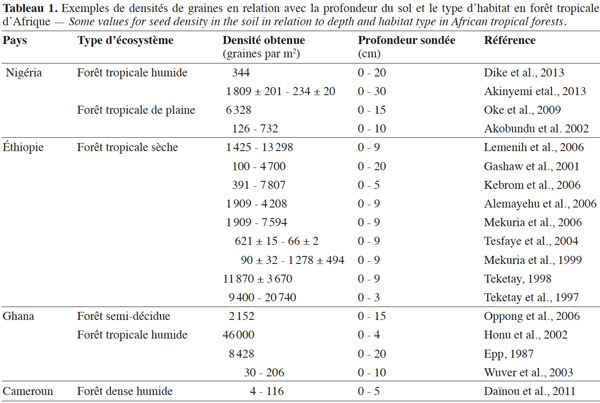
10Les questions relatives à la banque de graines du sol ont été posées initialement par Charles Darwin en 1857, lorsqu'il observa de jeunes plants émergeant d'échantillons de sols prélevés dans le fond d'un lac et c'est en 1882 que la première étude scientifique sur ce sujet fut publiée (Christoffoleti et al., 1998). L'importance de la banque de graines du sol n'a néanmoins pris de l'ampleur dans la communauté scientifique qu'après les travaux de Symington (1933) en forêts tropicales de Malaisie.
11Dans la mesure où la banque de graines du sol suppose intrinsèquement l'existence d'une forme quelconque de dormance des graines la constituant (Baskin et al., 2003), ce sont principalement les graines dites « orthodoxes » qui composent la banque du sol. En effet, selon Swaine et al. (1998), les graines se répartissent en deux principaux groupes :
12– les graines transitoires ou éphémères, encore appelées « graines récalcitrantes », car elles ne supportent pas la dessiccation et perdent rapidement leur viabilité lorsqu’elles sont stockées, du fait d'une teneur en eau élevée ;
13– les graines persistantes ou « graines orthodoxes », qui ont une longue viabilité dans le sol (Dalling et al., 1995).
14La composition de la banque de graines du sol est déterminée par la pluie de graines (Simpson et al., 1989). Celle-ci peut être définie comme le stock de graines qui arrivent sur le sol à la suite d’une diversité de modes de dispersion (Pickett et al., 1989). Elle est aussi définie comme l'ensemble des graines ou fruits libérés par une plante-mère, quelles que soient leurs destinées ultérieures en termes de dispersion et de survie (Jensen, 1998). En d'autres termes, la pluie de graines est constituée aussi bien de graines potentiellement dormantes que de graines récalcitrantes. Ces dernières sont condamnées à émerger rapidement ou à péricliter, tandis que les premières pourront être stockées durablement dans le sol en attendant des conditions de germination appropriées et/ou que leur dormance soit levée. Ces conditions peuvent survenir lors d'une ouverture de la canopée se traduisant par une modification de la température, de la quantité de lumière arrivant au sol et de sa composition spectrale (Charles-Dominique, 2003). En forêt tropicale, la forte variabilité saisonnière de la banque de graines du sol ne serait que le reflet de variations saisonnières de la pluie de graines (Hardesty et al., 2002).
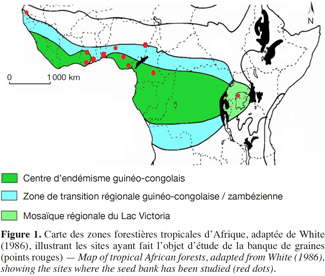
15En forêt tropicale d’Afrique, la plupart des études se sont focalisées sur la composition, la densité et la distribution spatiales de la banque de graines du sol (Figure 1). Concernant l’Afrique de l’Est, diverses études ont été publiées, telles que celles de Mekuria et al., 1999 ; Gashaw et al., 2001 ; Tesfaye et al., 2004 ; Alemayehu et al., 2006 ; Kebrom et al., 2006 ; Lemenih et al., 2006. Les mêmes tendances se dessinent en Afrique de l’Ouest (Epp, 1987 ; Akobundu et al., 2002 ; Honu et al., 2002 ; Wuver et al., 2003 ; Oppong et al., 2006 ; Oladipo et al., 2007 ; Oke et al., 2009 ; Akinyemi et al., 2013 ; Dike et al., 2013) et dans une moindre mesure en Afrique centrale (Daïnou et al., 2011). Quelques travaux ont concerné la pluie de graines (Clark et al., 2001 ; Carrière et al., 2002 ; Hardesty et al., 2002) mais, à notre connaissance, les relations entre pluie de graines et banque de graines du sol n'ont jamais été étudiées en forêt tropicale d’Afrique.
3. Dynamique des graines dans le sol
3.1. Variabilité spatiale et temporelle
16Divers mécanismes d'origines abiotique et biotique contribuent à la formation de la banque de graines du sol. Le fait que l'intensité de ces facteurs puisse significativement varier dans le temps et dans l'espace serait une des premières causes de son hétérogénéité (Plue et al., 2012).
17L'affaissement du sol autour de racines d'arbres et l'effet « splash » des gouttes de pluie recouvrant de terre les petites graines, participent à l'enfouissement des graines (Plue et al., 2012), à l'instar du rôle joué par divers rongeurs, vers de terre et arthropodes. Concernant ces derniers, il convient de signaler le rôle des disperseurs secondaires comme les bousiers qui déplacent les fèces déposées par les mammifères frugivores et dispersent les graines à courte distance (Feer et al., 2013).
18De nombreux autres facteurs expliquent cette hétérogénéité de la composition de la banque de graines, dont le degré d'ouverture de la canopée et la végétation environnante, bien que les données actuelles soient assez contradictoires (Hall et al., 1980). En milieu forestier tropical africain en particulier, la banque de graines du sol n'est que très partiellement le reflet de la végétation environnante. En général, moins de 20 % d’espèces arborescentes sont communes aux deux compartiments. En Afrique de l’Est, Mekuria et al. (2006) n’ont noté que 6 % d'espèces communes. Les mêmes tendances se dessinent en Afrique de l’Ouest avec des valeurs comprises entre 4,4 et 11 % (Akobundu et al., 2002 ; Oladipo et al., 2007 ; Oke et al., 2009 ; Akinyemi et al., 2013 ; Dike et al., 2013) et en Afrique centrale, de 3,5 à 7,6 % (Daïnou et al., 2011).
19En Amérique et en Asie, divers travaux (Alvarez-Aquino et al., 2005 ; de Camargos et al., 2013 ; dos Santos et al., 2013) indiquent des pourcentages qui n’atteignent guère 40 %.
20Ce constat, a priori surprenant, pourrait être expliqué par les faits suivants. Premièrement, les études liant la banque de graines du sol et la végétation se contentent généralement de décrire le peuplement environnant sur une étendue spatiale très limitée, négligeant de ce fait les capacités de dispersion à grande distance via la zoochorie, qui concerne 60 à 95 % des espèces tropicales forestières selon Howe et al. (1982) et Beaune et al. (2013).
21Par ailleurs, les graines de certains taxons peuvent survivre longtemps dans le sol, alors qu'ils ne seraient plus représentés dans la végétation environnante et inversement. La variabilité pourrait aussi être liée aux stades de la succession végétale. En effet, bien qu’il existe des graines dormantes dans tous les stades du cycle sylvigénétique (Garwood, 1989), les espèces pionnières des premiers stades de la succession présenteraient davantage de graines dormantes que les espèces des stades ultérieurs (Hall et al., 1980).
22Les espèces herbacées dominent dans la végétation exprimée de la banque de graines du sol, que ce soit en Afrique de l'Ouest (98 % d’espèces herbacées observées) (Oke et al., 2009 ; Dike et al., 2013), en Afrique de l'Est (78 à 80 %) (Gashaw et al., 2001 ; Alemayehu et al., 2006 ; Lemenih et al., 2006) ou en Afrique centrale (39,5 %) (Dainou et al., 2011).
23Enfin, l'hétérogénéité spatiale de la banque de graines du sol pourrait également être liée aux conditions édaphiques, principalement l'acidité et la porosité du sol, bien que ces influences n'aient été étudiées que dans les zones tropicales d’Asie et d’Amérique (Chen et al., 2013).
24En conséquence, la densité de la banque de graines du sol varie fortement d'une étude à l'autre.
25Une revue bibliographique effectuée par Garwood (1989) indique des densités allant de 25 à plus de 3 300 graines par m2. Celle effectuée par Skoglund (1992) rapporte des densités de 25 à plus de 6 800 graines par m2. La présente revue de littérature fondée sur les forêts tropicales d’Afrique révèle des densités allant de 30 à plus de 9 400 graines par m2 (Tableau 1).
26En général, la densité et la richesse floristique de la banque de graines du sol diminuent rapidement avec la profondeur, quel que soit le biotope considéré et ce, jusqu'à 50 cm de profondeur.
27Garwood (1989) précise que la grande majorité de la banque de graines du sol est concentrée dans les 25 premiers centimètres du sol, avec une meilleure abondance dans les 5 ou 10 premiers centimètres.
3.2. Durée de vie des graines de la banque du sol
28La durée de vie des graines dans la banque du sol est généralement évaluée par enfouissement expérimental de stocks de semences dans des conteneurs remplis de sols et placés en conditions défavorables de germination (faible luminosité, faible humidité, etc.) ou enterrés dans des sacs poreux placés dans des sols forestiers. Les stocks de graines sont ensuite exhumés à intervalles de temps réguliers et mis à germer en conditions optimales.
29Généralement, la durée de vie des espèces climaciques tend à être moindre que celle des taxons pionniers. Hopkins et al. (1987) ont montré que 60 % des graines de 27 espèces pionnières testées étaient toujours viables après deux ans, alors que toutes les semences de 11 espèces de forêts matures avaient perdu leur pouvoir germinatif. Sur la base de tests de germination et de « datation carbone », Dalling et al. (2009) ont montré que des graines de trois pionniers longévifs d'Amérique tropicale, collectées dans les trois premiers centimètres de sol, conservaient leur viabilité, bien qu'âgées de 18 à 38 ans. Soriano et al. (2014) ont testé la viabilité potentielle au laboratoire et in situ (en milieu forestier à 3 cm de profondeur du sol) de 18 espèces. Au laboratoire, les espèces étaient toujours viables après trois périodes de stockage (~3 ans). Et, en milieu forestier, les espèces étaient viables après deux périodes d’enfouissement (~2 ans). Peu d'études ont été menées sur le sujet en Afrique. Teketay et al. (1997) ont montré que sur 8 espèces étudiées par enfouissement à 5 cm de profondeur, Juniperus procera Hochst. ex Endl., Olea europaea L. et Podocarpus falcatus (Thunb.) Endl. ont conservé leur viabilité durant une période de 4 ans. A contrario, Marks et al. (1986), en étudiant selon la même méthodologie 15 espèces d'herbacées, ont mis en évidence une perte de viabilité de 13 d'entre elles avant 15 mois.
30La longévité des graines dans la banque du sol dépend de leur taille et de leur morphologie (Schwienbacher et al., 2010). Les graines persistant à long terme sont généralement de petite taille et de forme sphérique. En revanche, les graines transitoires sont souvent plus grandes et ont des formes variables (Bekker et al., 1998). Une petite taille permet une dispersion sur de longues distances (Hammond et al., 1995 ; Pouvelle et al., 2009). Par contre, elle présente deux désavantages : une moindre quantité de nutriments stockés et une plus grande difficulté à germer sous une épaisse couche de litière (Westoby et al., 1996).
4. Importance et rôle de la banque de graines du sol dans la conservation, la régénération et la restauration des écosystèmes naturels
31Plus tolérante aux conditions défavorables que la plante elle-même, la graine dormante joue un rôle crucial dans la conservation et le maintien de la diversité génétique de l’espèce (Blaney et al., 2001).
32La banque de graines du sol est un élément important de restauration de biodiversité végétale. Elle forme une réserve qui peut s'exprimer lors d'une perturbation du couvert arborescent (Symonides, 1986). L'importance de cette banque dans le recrutement forestier a été relativement peu étudiée en zone tropicale et la plupart des études ont concerné l'Amérique (Uhl, 1982 ; Young et al., 1987) et l'Asie (Putz et al., 1987 ; Lawton et al., 1988). Ces études concluent que la taille des trouées forestières jouerait un rôle déterminant dans l'implication de la banque de graines du sol dans les processus de recolonisation forestière. Dans les trouées de petite taille, ce sont surtout les plantules existant avant la survenue de l'ouverture (banque de plantules) qui bénéficieraient de celle-ci. La tendance serait inversée dans les grandes trouées où le recrû n'aurait que peu d'espèces communes avec la banque de plantules, mais serait davantage similaire à la banque de graines du sol (Garwood, 1989).
33Les espèces pionnières des premiers stades de la succession végétale produisent beaucoup plus de graines que les espèces de forêt mature et, par conséquent, présenteraient davantage de graines dormantes que les espèces de forêt mature. Ceci suggère que les forêts secondaires auraient un plus grand potentiel pour la restauration, tant en Amérique et en Asie (Young et al., 1987 ; Han et al., 2012 ; Chen et al., 2013) qu'en Afrique (Hall et al., 1980 ; Teketay, 1998 ; Tesfaye et al., 2004 ; Daïnou et al., 2011). Néanmoins, et bien que ne réfutant pas cette tendance générale, Garwood (1989) rappelle que la dormance n'est pas que l'apanage des graines des premiers stades de la succession et que la proportion de graines dormantes chez les espèces héliophiles longévives, voire tolérantes à l’ombre, n'est pas négligeable dans certaines forêts tropicales.
34Toutefois, bien que la banque de graines du sol ait été largement utilisée comme outil de restauration de certaines communautés végétales d’Amérique et d’Asie, très peu d'informations existent sur l'utilisation d'une telle stratégie en milieu forestier tropical africain. Seuls quelques cas peu documentés de restauration de parcs à grumes sont en cours dans plusieurs sociétés forestières (Doucet, comm. pers.).
5. Conclusion et perspectives
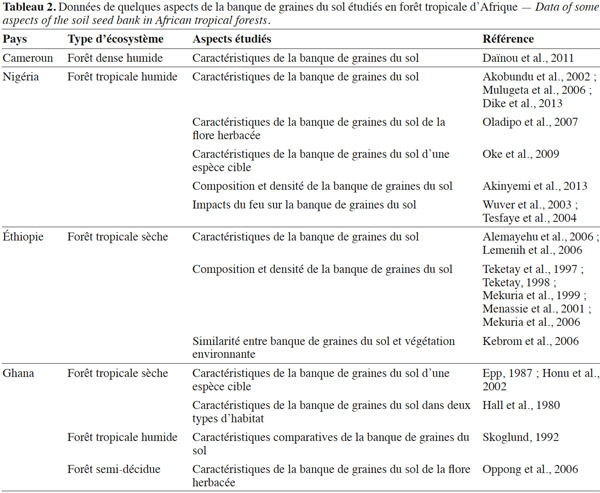
35La présente synthèse bibliographique a dressé un bilan des connaissances actuelles sur la banque de graines du sol des forêts tropicales africaines. Il s’agit d’une démarche comparative avec d’autres régions tropicales, en particulier d’Amérique et d’Asie, où sont menées la plupart des études. Notre revue de littérature montre que la banque de graines du sol joue un rôle important dans la conservation, la régénération et la restauration des écosystèmes et habitats naturels. Par contre, le nombre d’informations disponibles concernant les forêts tropicales africaines demeurent relativement faibles (Tableau 2). Il conviendrait d’approfondir les connaissances sur d’autres types de communautés végétales au nombre desquels les forêts denses humides sempervirentes et semi-décidues. Cette synthèse bibliographique a finalement débouché sur des aspects nécessitant davantage d'investigations scientifiques. Parmi les aspects qui devraient être prioritairement abordés figurent :
36– les relations entre la banque de graines du sol et la végétation environnante à une échelle compatible avec le mode de dispersion le plus répandu, à savoir la zoochorie ;
37– les variations saisonnières de la banque de graines du sol, en lien avec la pluie de graines et la phénologie des espèces végétales. Étaler les collecteurs de graines pendant une année ou plus serait une procédure envisageable car les périodes de floraison et fructification diffèrent d’une espèce à l’autre ;
38– la durée de vie des graines dans différents types de sols et les mécanismes permettant de lever leur dormance. Ce volet pourrait renseigner sur la durée de vie des graines dans le sol en vue de déterminer le cycle de dormance et prédire la dynamique de régénération des taxons forestiers.
39Ces paramètres sont autant d’axes recherchés à approfondir pour contribuer à une meilleure appréhension du rôle de la banque de graines du sol dans la dynamique de régénération des forêts tropicales d’Afrique.
40Remerciements
41Les auteurs remercient l’Université Marien Ngouabi (République du Congo), l’Université de Liège (Belgique), le Fonds National de la Recherche Scientifique (FNRS) (subvention FRFC 2.4577.10) et le Réseau des Institutions de Formation Forestière et Environnementale d’Afrique centrale (RIFFEAC) à travers son Projet d’Appui au Programme Élargi de Formation en Gestion des Ressources Naturelles dans le Bassin du Congo (PEFOGRN-BC), pour leurs soutiens technique, scientifique et financier. Leurs remerciements vont aussi à l'endroit du projet DynAfFor, des sociétés forestières Mokabi-Dzanga (Groupe Rougier) et CIB/OLAM pour leur appui aux travaux de terrain. Enfin, que Jean-Yves De Vleeschouwer, Michèle Federspiel, Christian Moupela, Nils Bourland, Barbara Haurez et Armel Loïc Donkpêgan Sègbédji soient remerciés pour leurs divers contributions et conseils.
Bibliographie
Akinyemi D.S. & Oke S.O., 2013. Soil seed bank dynamics and regeneration in three different physiognomies in Shasha forest reserve in southwestern Nigeria. Ife J. Sci., 15, 367-383.
Akobundu I.O. & Ekeleme F., 2002. Weed seed bank characteristics of arable fields under different fallow management systems in the humid tropical zone of southeastern Nigeria. Agrofor. Syst., 54, 161-170.
Alemayehu W. & Teketay D., 2006. Changes in soil seed bank composition and density following deforestation and subsequent cultivation of a tropical dry Afromontane forest in Ethiopia. Trop. Ecol., 47(1), 1-12.
Alexandre D.Y. et al., 1982. Aspect de la régénération naturelle en forêt dense de Côte d'Ivoire. Candollea, 37, 579-588.
Alvarez-Aquino C., Williams-Linera G. & Newton A.C., 2005. Disturbance effects on the seed bank of Mexican cloud forest fragments. Biotropica, 37, 337-342.
Baker H.G., 1989. Some aspects of the natural history of seed banks. In: Leck M.A., Parker V.T. & Simpson R.L., eds. Ecology of soil seed banks. San Diego, CA, USA: Academic Press Inc., 9-21.
Bakker J.P. et al., 2000. How to define targets for ecological restoration? Introduction. Appl. Veg. Sci., 3, 3-6.
Baskin J.M. & Baskin C., 2003. Classification, biogeography and phylogenetic relationships of seed dormancy. In: Smith R.D. et al., eds. Seed conservation. Turning science into practice. Kew, UK: Kew Publishing, 517-544.
Beaune D. et al., 2013. Seed dispersal strategies and the threat of defaunation in a Congo forest. Biodivers. Conserv., 22(1), 225-238.
Bekker R.M. et al., 1998. Seed size, shape and vertical distribution in the soil, indicators of seed longevity. Funct. Ecol., 12, 834-842.
Blaney C.S. & Kotanen P.M., 2001. Effects of fungal pathogens on seeds of native and exotic plants: a test using congeneric pairs. J. Appl. Ecol., 38, 1104-1113.
Carrière S.M. et al., 2002. Seed rain beneath remnant trees in a slash-and-burn agricultural system in southern Cameroon. J. Trop. Ecol., 18, 353-374.
Charles-Dominique P., 2003. Description et dynamique des milieux forestiers. Rev. For. Fr., 55, 195-205.
Cheke A.S., Nanakorn W. & Yankoses C., 1979. Dormancy and dispersal of seeds of secondary forest species under the canopy of a primary tropical rain forest in northern Thailand. Biotropica, 11, 88-95.
Chen H., Cao M. & Tang Y., 2013. Soil seed banks in plantations and tropical seasonal rainforest of Xishuangbanna, South-West China. J. Trop. For. Sci., 25(3), 375-386.
Christoffoleti P.J. & Caetano R.S.X., 1998. Soil seed banks. Sci. Agricola, 55, 74-78.
Clark C.J. & Poulsen J.R., 2001. The role of arboreal seed dispersal groups on the seed rain of a lowland tropical forest. Biotropica, 33(4), 606-620.
Daïnou K. et al., 2011. Soil seed bank characteristics in Cameroonian rainforests and implications for post-logging forest recovery. Ecol. Eng., 37, 1499-1506.
Dalling J.W., Swaine M.D & Garwood N.C., 1995. Effect of soil depth on seedling emergence in tropical soil seed bank investigations. Funct. Ecol., 9, 119-121.
Dalling J.W. & Brown T.A., 2009. Long-term persistence of pioneer species in tropical rain forest soil seed banks. Am. Nat., 173, 531-535.
de Camargos et al., 2013. Influência do fogo no banco de sementes do solo em floresta estacional semidecidual. Cienc. Florestral, 23(1), 18-19.
de Wasseige C. et al., 2009. Les forêts du bassin du Congo. État des forêts 2008. Luxembourg : Office des Publications de l’Union Européenne.
Dike M.C. & Nwosu L.C., 2013. Variations in soil seed banks of abandoned farmlands of various ages in Umukabia Umuagbom, Abia State, Nigeria. Int. J. Biol. Chem. Sci., 7(1), 338-343.
dos Santos et al., 2013. Can spatial variation and inter-annual variation in precipitation explain the seed density and species richness of the germinable soil seed bank in a tropical dry forest in north-eastern Brazil? Flora, 208, 445-452.
Epp G.A., 1987. The seed bank of Eupatorium odoratum along a successional gradient in a tropical rain forest in Ghana. J. Trop. Ecol., 3, 139-149.
Feer et al., 2013. Monkey and dung beetle activities influence soil seed bank structure. Ecol. Res., 28, 93-102.
Garwood N.C., 1989. Tropical soil seed banks: a review. In: Leck M.A., Parker V.T. & Simpson R.L., eds. Ecology of soil seed banks. New York, USA: Academic Press, Inc.
Gashaw M. & Michelsen A., 2001. Soil seed bank dynamics and above-ground cover of a dominant grass, Hyparrhenia confinis, in regular burning savanna types in Gambella, Western Ethiopia. Biol. Skrifter, 54, 389-397.
Hall J.B. & Swaine M.D., 1980. Seed stocks in Ghanaian forest soils. Biotropica, 14, 60-62.
Hammond D.S. & Brown V.K., 1995. Seed size of woody plants in relation to disturbance, dispersal, soil type in wet neotropical forests. Ecology, 76, 2544-2561.
Han A.R. et al., 2012. Comparison of soil seed banks in canopy gap and closed canopy areas between a secondary natural forest and a big leaf mahogany (Swietenia macrophylla King) plantation in the Mt. Makiling Forest Reserve, Philippines. J. Environ. Sci. Manage., 1, 47-59.
Hardesty B.D. & Parker V.T., 2002. Community seed rain patterns and a comparison to adult community structure in a Central African tropical forest. Plant Ecol., 164, 49-64.
Honu Y.A.K. & Dang Q.L., 2002. Spatial distribution and species composition of tree seeds and seedlings under the canopy of the shrub, Chromolaena odorata Linn., in Ghana. For. Ecol. Manage., 164, 185-196.
Hopkins M.S. & Graham A.W., 1987. The viability of seeds of rain forest species after experimental soil burials under tropical wet lowland forest in north-eastern Australia. Aust. J. Ecol., 12, 97-108.
Howe H.F. & Smallwood J., 1982. Ecology of seed dispersal. Annu. Rev. Ecol. Syst., 13, 201-228.
Jensen K., 1998. Species composition of soil seed bank and seed rain of abandoned wet meadows and their relation to aboveground vegetation. Flora, 193, 345-359.
Kebrom T. & Tesfaye G., 2006. The role of soil seed banks in the rehabilitation of degraded hillslopes in Southern Wello, Ethiopia. Biotropica, 32(1), 23-32.
Lawton R.O. & Putz F.E., 1988. Natural disturbance and gap-phase regeneration in a wind-exposed tropical cloud forest. Ecology, 69, 764-777.
Lemenih M. & Teketay D., 2006. Changes in soil seed bank composition and density following deforestation and subsequent cultivation of a tropical dry Afromontane forest in Ethiopia. Trop. Ecol., 47(1), 1-12.
Marks M.K. & Nwachuku A.C., 1986. Seed bank characteristics in a group of tropical weeds. Weed Res., 26, 151-157.
Mekuria A., Teketay D. & Mats O., 1999. Soil seed flora, germination and regeneration pattern of woody species in an Acacia woodland of the Rift Valley in Ethiopia. J. Arid Environ., 43, 411-435.
Mekuria et al., 2006. Soil seed banks in forests of northern Ethiopia: implications for the conservation of woody plants. Flora, 9, 270-284.
Oke S.O. et al., 2009. Soil seed bank dynamics in Tithonia diversifolia dominated fallowland vegetation in Ile-Ife area of Southwestern Nigeria. Int. J. Biol. Chem. Sci., 3(5), 899-911.
Oladipo O.T. & Oke S.O., 2007. Seed bank dynamics, seedling emergence and survival of herbaceous species in successional plots in Ile-Ife, Southwestern Nigeria. Res. J. Bot., 2(2), 76-85.
Oppong F.K., Osei-Bonsu K. & Amoah F.M., 2006. The seed bank of weed species in three ecosystems in a semi-deciduous forest zone in Ghana. Trop. Sci., 43, 80-85.
Pickett S.T.A. & McDonnell M.J., 1989. Seed bank dynamics in temperate deciduous forest. In: Leck M.A., Parker V.L. & Simpson R.L., eds. Ecology of soil seed banks. San Diego, CA, USA: Academic Press, 123-147.
Plue J. & Hermy M., 2012. Consistent seed bank spatial structure across semi-natural habitats determines plot sampling. J. Veg. Sci., 23, 505-516.
Pouvelle S. et al., 2009. The latrine effect: impact of howler monkeys on the distribution of small seeds in a tropical rain-forest soil. J. Trop. Ecol., 25, 239-248.
Putz F.E. & Appanah B., 1987. Buried seeds, newly dispersed seeds, and the dynamics of a lowland forest in Malaysia. Biotropica, 19, 326-339.
Roberts H.A., 1981. Seed banks in soils. Appl. Biol., 6, 1-55.
Rollet B., 1981. La régénération naturelle dans les trouées, un processus général de la dynamique des forêts tropicales humides : 1ère partie. Bois For. Trop., 201, 3-34
Schwienbacher E. et al., 2010. Alpine species seed longevity in the soil in relation to seed size and shape-A5-year burial experiment in the Central Alps. Flora, 205, 19-25.
Simpson R.L., Leck M.A. & Parker V.T., 1989. Seed banks: general concepts and methodological issues. In: Leck M.A., Parker V.T. & Simpson R.L., eds. Ecology of soil seed banks. San Diego, CA, USA: Academic Press, 3-8.
Skoglund J., 1992. The role of seed banks in vegetation dynamics and restoration of dry tropical systems. J. Veg. Sci., 3, 357-360.
Soriano D., Huante P., Gamboa-DeBuen A. & Orosco-Segovia A., 2014. Effects of burial and storage on germination and seed reserves of 18 tree species in a tropical deciduous forest in Mexico. Oecologia, 174, 33-44.
Swaine M.D. & Whitmore T.C., 1998. On the definition of ecological species groups in tropical rainforest. Vegetatio, 75, 81-86.
Symington C.F., 1933. The study of secondary growth on rain forest sites in Malaya. Malaya For., 2, 107-117.
Symonides E., 1986. Seed bank in old-field successional ecosystems. Ekologia Polska, 34, 3-29.
Teketay D., 1998. The impact of clearing and conversion of dry Afromontane forests into arable land on the composition and density of soil seed banks. Acta Ecol., 18(5), 557-573.
Teketay D. & Granström A., 1997. Seed viability of Afromontane tree species in forest soils. J. Trop. Ecol., 13, 81-95.
Tesfaye G., Teketay D., Assefa Y. & Fetene M., 2004. The impact of fire on the soil seed bank and regeneration of Harenna forest, Southeastern Ethiopia. Mt Res. Dev., 24, 354-361.
Tesfaye G. et al., 2010. Regeneration of seven indigenous tree species in dry Afromontane forest, Southern Ethiopia. Flora, 205, 135-143.
Uhl C., 1982. Recovery following disturbances of different intensities in the Amazon rain forest of Venezuela. Interciencia, 73, 53-58.
Westoby M. et al., 1996. Comparative ecology of seed size and dispersal. Philos. Trans. R. Soc. London B., 351, 1309-1318.
White F., 1986. La végétation de l’Afrique. Mémoire accompagnant la carte de végétation de l’Afrique. Unesco/AETFAT/UNSO. Paris : Orstom, Unesco.
Wuver A.M., Attuquayefio D.K. & Kwesi-Enu L., 2003. A study of bushfires in a Ghanaian coastal Wetland. II. Impact on floral diversity and soil seed bank. West Afr. J. Appl. Ecol., 4, 13-26.
Young K.R. et al., 1987. Seed dynamics during forest succession in Costa Rica. Vegetatio, 71, 157-173.






