- Home
- Volume 19 (2015)
- numéro 4
- Apport des analyses isotopiques et moléculaires pour la caractérisation des communautés fonctionnelles et des voies métaboliques au cours de la méthanogenèse dans des boues d’épuration
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Apport des analyses isotopiques et moléculaires pour la caractérisation des communautés fonctionnelles et des voies métaboliques au cours de la méthanogenèse dans des boues d’épuration

Editor's Notes
Reçu le 8 janvier 2015, accepté le 29 juin 2015.
Résumé
Description du sujet. Cet article traite des relations entre les communautés des archées méthanogènes et les voies métaboliques lors de l’étape de la méthanogenèse.
Objectifs. L’objectif est d’utiliser une approche isotopique couplée à des analyses moléculaires afin d'identifier les métabolismes et de comprendre la dynamique des populations d’Archaea sous différentes conditions de températures.
Méthodes. Des boues ont été incubées en anaérobiose dans des conditions mésophiles et thermophiles. La production de biogaz et les mesures isotopiques stables de CH4 et CO2 produits ont été analysées.
Résultats. Les valeurs isotopiques du CH4 ont exhibé un changement des voies métaboliques de la méthanogenèse en fonction du temps et des températures d’incubation. Au début des incubations mésophiles et après injection de l'acétate, le CH4 a été principalement produit à partir de H2/CO2 et par le métabolisme acétoclastique. À la fin des incubations mésophiles, un changement progressif vers un métabolisme acétoclastique strict a été observé. Une stabilité remarquable de la communauté des archées a été observée dans les conditions mésophiles par les analyses ARISA et FISH. Au début des incubations thermophiles et après injection de l'acétate, le CH4 a été produit essentiellement à partir de H2/CO2. À la fin des incubations thermophiles, un métabolisme acétoclastique s’est installé. De plus, les analyses ARISA et FISH ont montré des changements au niveau des communautés des archées actives.
Conclusions. Une méthode isotopique couplée à des méthodes moléculaires nous ont permis de mieux comprendre comment se déroule la méthanogenèse et les populations d’archées impliquées en fonction de la température. Nous avons également observé une pré-adaptation des communautés d’archées dans les conditions thermophiles qui pourrait être due au fait que les micro-organismes mésophiles sont progressivement éliminés.
Abstract
Characterization of functional communities and metabolic pathways during methanogenesis in wastewater sludge by isotopic and molecular analysis
Description of the subject. Investigation of the relationships between methanogenic community and metabolic pathway dynamics during methanogenesis.
Objectives. The objective was to use an isotopic approach coupled with molecular analysis to identify metabolisms and to understand the dynamics of Archaea under different temperature conditions.
Method. Sludge was incubated anaerobically under mesophilic and thermophilic conditions. Biogas production was monitored, together with stable isotopic signatures of produced CH4 and CO2.
Results. Isotopic signature values for CH4 indicated a change in methanogenic metabolism with time and temperature. CH4 was predominantly produced from H2/CO2 and acetoclastic metabolism at the beginning of the mesophilic incubations and after acetate injection. A progressive shift towards an acetoclastic metabolism was observed at the end of mesophilic incubations. This period was associated with stability within archaeal communities as monitored by automated ribosomal intergenic spacer analysis (ARISA) and FISH with oligonucleotidic probes targeting specifically the Archaea 16S rRNA gene. At the beginning of the thermophilic incubations and after acetate injection, methane was generated mostly from H2/CO2. At the end of the thermophilic incubations, an acetoclastic metabolism was observed and intergenic spacer analysis (ARISA) and FISH showed important shifts in archaeal communities.
Conclusions. Isotopic methods coupled with molecular analyses enabled us to better understand methanogenesis and the involvement of archaeal populations, which varied according to temperature. We also observed a preadaptation of archaeal communities in thermophilic conditions, which could be due to the fact that mesophilic microorganisms were progressively eliminated during the thermophilic incubation period.
Table of content
1. Introduction
1Le principal défi du processus d’épuration des eaux usées consiste à rejeter dans la nature une eau qui soit la plus pure possible, tout en produisant le minimum de boues. Les boues produites représentent un déchet secondaire qu’il faut ensuite traiter et éliminer. La méthanisation (ou digestion anaérobie) constitue un des procédés les plus efficaces pour la réduction de la quantité de boues générées. Ce processus biologique est capable de transformer la matière organique des boues en méthane et en gaz carbonique sous l’action de communautés microbiennes anaérobies. Elle se déroule en quatre étapes principales caractéristiques de l’action de différents groupes de micro-organismes : l’hydrolyse, l’acitogenèse, l’acétogenèse et la méthanogenèse. Au cours de l’étape de méthanogenèse, l’acétate, l’hydrogène et le bicarbonate sont transformés en méthane (Welander et al., 2005). Les micro-organismes responsables de cette conversion sont les archées méthanogènes qui catalysent soit la réaction de méthanogenèse acétoclastique :
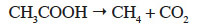
2soit la réaction de méthanogenèse hydrogénotrophe :
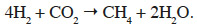
3De nombreuses études ont permis d’identifier la diversité microbienne présente dans les digesteurs anaérobies (Chouari et al., 2005 ; Riviere et al., 2009). Cependant, peu d’informations sont disponibles sur les changements de la structure microbienne, le métabolisme des micro-organismes en fonction de la température et la vitesse à laquelle les micro-organismes répondent à ces changements de température. Or, Ciotola et al. (2013) ont démontré que la température du digesteur influence la fonction de la communauté microbienne et donc la production de biogaz.
4Parmi les approches appliquées pour l’étude du processus de la méthanogenèse dans plusieurs écosystèmes, l’isotopie a été largement utilisée (Glissmann et al., 2004 ; Penning et al., 2006). Le suivi isotopique naturel consiste à déterminer le carbone 13C naturellement présent dans l'environnement et à calculer un facteur de fractionnement apparent α (Qu et al., 2009) :
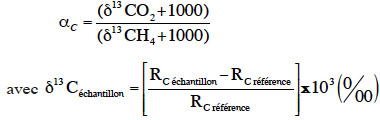
5avec Rc = 13C/12C.
6Les mesures des fractionnements isotopiques constituent une technique intéressante car les différentes voies métaboliques (acétoclaste/hydrogénotrophe) conduisent, du fait de la consommation préférentielle des molécules légères, à différentes valeurs de composition isotopique.
7L’objectif de notre étude est d’utiliser une approche isotopique couplée à des analyses moléculaires afin d'identifier les métabolismes, de les quantifier, de comprendre et d’étudier la dynamique des populations d’Archaea impliquées dans les processus de la méthanogenèse sous différentes conditions de température (mésophile et thermophile).
2. Matériel et méthodes
2.1. Boues de la station d’épuration
8Les boues échantillonnées pour notre étude proviennent de la station de traitement des eaux usées d’Évry (France) et ont été prélevées en sortie du digesteur mésophile. Les boues ont été utilisées comme inoculum sans préparation ni conservation préalables.
2.2. Préparation de microcosmes et injection d’acétate
9Les microcosmes sont réalisés avec des flacons à plasma de 250 ml (Fisher Scientific) en verre borosilicaté. Dans six bouteilles, 100 ml de boues digérées ont été ajoutées. Ces bouteilles sont fermées hermétiquement par un septum en caoutchouc d'une épaisseur de 5,5 mm et par une bague à vis. Pour éliminer l'air des bouteilles incubées en anaérobiose, un vide a été effectué à l'aide d'une pompe à vide (Bioblock vacuubrand) pendant 2 min. Le ciel gazeux est ensuite saturé en azote inerte (N2). Cette opération vide/saturation est répétée trois fois pour chaque bouteille. Trois bouteilles sont placées dans une pièce thermostatée à 35 °C ± 1 °C, tandis que les trois autres bouteilles sont placées dans une étuve à 55 °C ± 1 °C. Cinq prélèvements de 1,5 ml de boues à partir de chaque microcosme ont été effectués tous les trois jours au début de la période d’incubation. Vers la fin d’incubation et plus précisément au cours de la phase de méthanogenèse, les prélèvements sont réalisés chaque semaine. Après une durée de 60 jours d’incubation, les boues se sont stabilisées. À ce moment, une quantité de 250 mg d'acide acétique glacial est injectée.
2.3. Analyse du biogaz
10La composition du méthane (CH4) et du dioxyde de carbone (CO2) produits au cours des incubations des microcosmes est déterminée à l’aide d’un micro-chromatographe en phase gazeuse (Varian CP4900). L’analyse se déroule automatiquement et pour chacune des six bouteilles successivement grâce à un système d’injection multivoies. Chaque analyse est réalisée en triplicat. Des mesures de pression sont réalisées pour chacune des bouteilles afin de contrôler la production de biogaz dans les incubations.
2.4. Analyse de la composition isotopique du biogaz
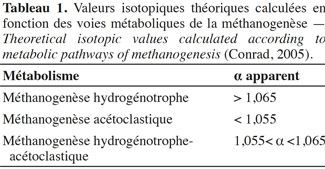
11Un prélèvement de 7 ml de biogaz produit a été réalisé avec une seringue à gaz (SGE, gas tight 10 ml) munie d'un système de fermeture. Ces prélèvements de gaz ont été introduits dans des vacutainers. Les compositions isotopiques du méthane et du dioxyde de carbone sont analysées à l'aide du couplage entre un chromatographe en phase gazeuse (Trace GC Ultra, Thermo Electron Corporation, USA), un four de combustion (Finnigan GC combustion III, Thermo Electron Corporation, USA) et un spectromètre de masse isotopique (Delta plus Isotope Ratio Mass Spectrometer, Thermo Electron Corporation, USA). L'ensemble (GC-C-IRMS) est équipé d'un passeur automatique (Triplus AS, Thermo Electron Corporation, USA). La différence relative des rapports isotopiques delta est exprimée par rapport à un matériel de référence qui est le Pee Dee Belemnite (PDB). Chaque analyse est réalisée trois fois pour s’assurer de la bonne reproductibilité de la mesure. Les valeurs isotopiques théoriques utilisées pour distinguer les différentes voies métaboliques de la méthanogenèse sont indiquées dans le tableau 1.
2.5. Extraction d’ADN, PCR et ARISA (Automated Ribosomal Intergenic Spacer Analysis)
12Pour chaque microcosme, des prélèvements de 1,5 ml ont été centrifugés à 13 400 t·min-1 pendant 10 min, un culot de masse comprise entre 0,05 g et 0,2 g a été obtenu. À partir de ce culot, l’extraction de l’ADN total a été réalisée à l’aide du kit « Mobio Laboratories Inc., Carlsbad, Allemagne » selon les instructions du fabricant. Ensuite, l’ADN a été amplifié en utilisant les amorces spécifiques des Archaea : 1389F (5’-TTGTACACACCGCCC-3’) (Loy et al., 2002) et 71R (5’-TCGGYGCCGAGCCGAGCCATCC-3’) (García-Martínez et al., 2000). Ce couple d’amorces cible l’espace intergénique (ITS) se trouvant entre les gènes 16S et 23S. Le mélange réactionnel de la PCR contient : Tampon de la Taq ADN polymérase à 1X, 0,2 mM de chacun des désoxynucléotides triphosphate (dATP, dTTP, dGTP, dCTP) et 0,25 µM de chacune des amorces dans un volume final de 25 µl. Le programme utilisé est le suivant : 5 min à 95 °C puis 35 cycles à 94 °C pendant 1 min, 55 °C durant 1 min et 72 °C pendant 2 min, puis une étape d’élongation finale à 72 °C pendant 10 min. L’ARISA du produit de PCR est réalisé en utilisant le kit Agilent DNA 7500 (Agilent Technologies Inc). Une série de pics est obtenue (électrogramme) ; le calcul de la taille de chaque pic est réalisé en les comparant à un standard interne. Le logiciel « 2100 EXPERTS » (Agilent Technologies Inc.) est employé pour calculer la surface de chaque pic qui est proportionnelle à la quantité d’ADN dans les fragments de PCR.
2.6. Hybridation in situ de sondes fluorescentes
13Pour chaque échantillon, une fixation au paraformaldéhyde ainsi qu’une fixation à l’éthanol est réalisée. À 1 volume d’échantillon sont ajoutés 3 volumes de paraformaldéhyde à 4 %. L’échantillon est fixé pendant au moins 3 h à 4 °C. Le paraformaldéhyde est ensuite éliminé par centrifugation et deux lavages de l’échantillon au tampon phosphate salin (PBS). Après les lavages, le culot est repris dans 500 µl de PBS. Ensuite, 500 µl d’éthanol absolu froid sont ajoutés. Les échantillons fixés sont gardés à - 20 °C. L’hybridation des échantillons avec les sondes a été réalisée comme décrit par Manz et al. (1992). Pour l’observation au microscope, la lame est montée avec une lamelle après dépôt d’une petite goutte de citifluor sur chaque puits. La lame est observée au microscope à épifluorescence puis en microscopie confocale en utilisant le logiciel ZEN (Carl Zeiss). Grace aux fluorophores (cyanine 3 et fluorescéine isothiocyanate) fixés sur la sonde, les cellules hybridées peuvent être visualisées clairement. La sonde fluorescente utilisée est la sonde générale des Archaea Arc 915 (5’-GTGCTCCCCCGCCAATTCCT-3’) (Padmasiri et al., 2007).
3. Résultats
3.1. Évolution de la production du biogaz
14En condition mésophile, la production active de méthane et de dioxyde de carbone a commencé après une phase de latence de 2 à 3 jours. Ceci est probablement dû à l’adaptation des méthanogènes originaires des boues anaérobies aux nouvelles conditions expérimentales. Entre le 10e et le 60e jour d’incubation, le méthane est produit jusqu’à devenir le gaz majoritaire dans le ciel gazeux. Après 40 jours d’incubation, la production de méthane se stabilise, ce qui correspond à la stabilisation de la production endogène de ce dernier dans les boues. Au 60e jour d’incubation, de l’acétate a été injecté dans les microcosmes ; immédiatement, le redémarrage de la méthanogenèse est remarqué (Figure 1). Il faut également noter une production quasi-instantanée de CO2 par stripping, liée au déplacement de l’équilibre des carbonates suite à l’injection d’acide acétique glacial.
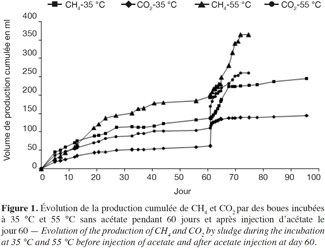
15En condition thermophile, le taux de méthane initialement produit est important, comme l’indiquent les mesures dans le ciel gazeux. À partir du 40e jour d’incubation, la production active de méthane se stabilise. Comme pour les microcosmes mésophiles, l’injection de l’acétate dans les microcosmes thermophiles induit immédiatement un redémarrage de la méthanogenèse (Figure 1).
3.2. Suivi isotopique
16En condition mésophile, avant injection d’acétate, le facteur isotopique α indique des valeurs légèrement inférieures à 1 060, correspondant à un mélange de métabolisme. Après injection d’acétate, les valeurs d’α sont comprises entre 1,061 et 1,055 du 60e jusqu’au 64e jour, ce qui signifie que, durant cette période, le méthane continue à être produit par les deux métabolismes (acétoclaste et hydrogénotrophe). À partir du 64e jour, les valeurs d’α passent en zone acétoclaste (Figure 2).
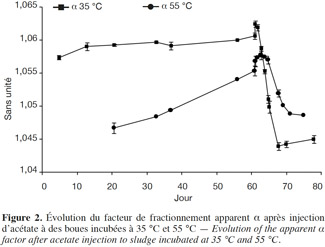
17En condition thermophile, avant injection d’acétate, les valeurs d’α sont inférieures à 1,055, ce qui signifie que dans ces microcosmes, nous assistons à un métabolisme acétoclastique. Après injection d’acétate, du 60e au 68e jour d’incubation, les valeurs d’α sont comprises entre 1,055 et 1,058, ce qui signifie qu’une partie du méthane semble avoir été produite par méthanogenèse hydrogénotrophe ; en effet, durant cette période, les valeurs d’α sont situées juste à la frontière entre la zone acétoclaste et la zone de mélange de métabolismes. À partir du 68e jour, les valeurs d’α sont comprises entre 1,053 et 1,050, donc un métabolisme majoritairement acétoclastique semble s’installer de nouveau (Figure 2).
3.3. Analyse des profils ARISA
18La structure de la communauté des Archaea a été analysée par ARISA. La figure 3 montre les différents profils obtenus en fonction de la température d’incubation. Des tailles de bandes comprises entre 300 et 800 bp sont obtenues pour les profils d’ARISA à 35 °C. Chaque profil est composé de 1 à 9 bandes. Les profils obtenus pendant les incubations mésophiles demeurent stables et pratiquement identiques aux profils d’ARISA des boues ayant servi d’inoculum initial. Par conséquent, la communauté des Archaea ne semble pas avoir subi de changements au cours de ces incubations (Figure 3).

19À 55 °C, les profils d’ARISA sont composés de 1 à 9 bandes avec des tailles de bandes variant de 300 à 700 bp. Les profils des incubations thermophiles sont différents des profils initiaux de boues. D’autre part, nous avons remarqué un changement dans les profils au cours de l'incubation avec la disparition des bandes de 550 pb et 420 pb observées dans tous les profils mésophiles et l’apparition des bandes 400 pb et 300 pb dans tous les profils thermophiles. Ainsi, un changement de diversité de la communauté des Archaea méthanogènes pourrait être établi sous l’effet de la température lors de la méthanisation des boues (Figure 3).
3.4. Analyse FISH (Fluorescence In Situ Hybridization)
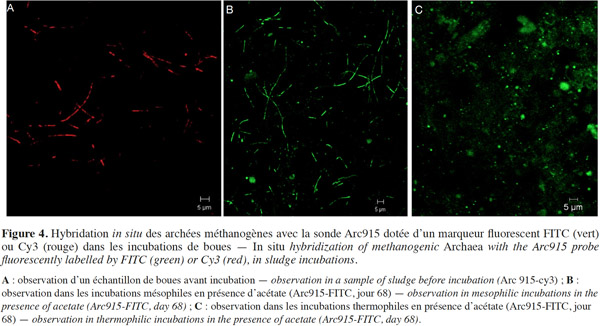
20En utilisant la sonde générale des Archaea (Arc 915) pour hybrider des échantillons préparés à partir des microcosmes mésophiles et thermophiles de boues avec acétate, nous avons remarqué que les formes cellulaires des Archaea sont différentes en fonction de la température d’incubation. En condition mésophile, la forme cellulaire dominante est la forme filamenteuse (Figure 4B) ; ces mêmes formes sont observées dans les échantillons de boues initiales (Figure 4A). En condition thermophile, les formes cellulaires dominantes sont des cocci de 1 à 2 µm de diamètre (Figure 4C).
4. Discussion
21Lors de la digestion anaérobie, la production de méthane est assurée grâce aux produits de fermentation, en particulier l’acétate (méthanogenèse acétoclastique), le dihydrogène (H2) et le dioxyde de carbone (CO2) (méthanogenèse hydrogénotrophe) (Welander et al., 2005). Conrad (1999) a montré que 67 % du méthane produit est assuré par la méthanogenèse acétoclastique, le reste étant produit à partir du CO2 et du H2. La méthanogenèse acétoclastique est assurée par des membres de la famille des Methanosaetaceae et des Methanosarcinaceae (Ferry, 1993b). Ferry a montré que les Methanosarcinaceae utilisent non seulement l’acétate mais aussi l’H2 et le CO2. Plusieurs études ont été réalisées afin d’obtenir des informations sur l’implication des communautés des Archaea méthanogènes dans la digestion anaérobie. La structure et la diversité de ces méthanogènes ont été étudiées en utilisant les séquences du gène de l’ARNr 16S (Huang et al., 2002 ; Karakashev et al., 2005), la FISH (Karakashev et al., 2005 ; Laloui-Carpentier et al., 2006), la DGGE, le RFLP (Ficker et al., 1999) et la SSCP (Leclerc et al., 2004).
22Le couplage de la PCR à l’ARISA en utilisant des amorces spécifiques du domaine Archaea nous a permis d’avoir un aperçu de la structure de la communauté des Archaea dans les incubations mésophiles et thermophiles des boues en présence d’acétate. Ainsi, un examen rapide, sensible et reproductible de la dynamique de la diversité des Archaea a été effectué. Nos résultats ont montré que sous l’effet de la température, un changement de diversité de la communauté des Archaea méthanogènes est perceptible lors de la méthanisation des boues. Ces observations sont en accord avec d’autres travaux (Leven et al., 2007 ; Kundu et al., 2012) qui ont prouvé que la température possède un impact important sur la diversité de la communauté des Archaea. D’autre part, Kundu et al. (2012) ont prouvé que les effets du choc thermique agissent directement sur la sensibilité de la communauté des Archaea aux perturbations et ceci est probablement dû à l’installation d’une phase de transition.
23Les informations fournies par la technique de l’ARISA constituent seulement un ensemble de données qualitatives de la dynamique et de la diversité des méthanogènes. Toutefois, un changement des profils de bandes de la communauté des Archaea a été observé sous l’effet de la température d’incubation. Des bandes observées dans les profils d’ARISA lors des incubations mésophiles ont disparu dans les profils des incubations thermophiles d’ARISA. Par contre, des bandes uniquement présentes dans les profils des incubations thermophiles sont apparues. Ces observations sont en accord avec les travaux de Kundu et al. (2013) qui ont étudié la réponse et la performance de la communauté des Archaea vis-à-vis du changement de la température d’incubation dans des réacteurs anaérobies. Ainsi, les profils d’ARISA de la communauté des Archaea pourraient servir d’indicateurs sur la capacité différentielle de ces groupes à s’adapter aux changements des conditions d’incubation.
24Pour consolider les résultats d’ARISA qui ont montré que la température a un effet sur la diversité des Archaea, la FISH a été utilisée. Ainsi, une estimation approximative visuelle des groupes méthanogènes lors de la dégradation des boues en conditions mésophile et thermophile a été obtenue. Les observations FISH en condition mésophile ont montré que la forme cellulaire dominante est la forme filamenteuse. Par contre, en condition thermophile, les formes cellulaires dominantes sont des cocci de 1 à 2 µm. Ces observations FISH suggèrent que des familles physiologiquement différentes pourraient être présentes et possèdent des environnements de croissance distincts en fonction de la température d’incubation. La forme filamenteuse a déjà été définie comme étant une forme spécifique de la famille des Methanosaetaceae caractérisant les environnements à faible concentration d’acétate (McMahon et al., 2001). De plus, selon Kundu et al. (2013), les Methanosaetaceae sont dominants en conditions mésophiles, contrairement aux Methanosarcinaceae qui le sont plutôt en conditions thermophiles.
25Nous avons utilisé l’approche isotopique pour étudier les différentes voies de méthanogenèse impliquées dans les processus de dégradation anaérobie de boues en conditions mésophile et thermophile. D’après le facteur de fractionnement apparent α, la production de méthane à 35 °C est réalisée par un mélange de métabolismes et ceci continue à être le cas, même après injection d’acétate. Après deux jours, le facteur de fractionnement passe en zone acétoclaste. Cette évolution suggère que la forte concentration d’acétate en condition mésophile a activé les acétoclastes strictes. D’après la valeur du facteur de fractionnement apparent α, la production du méthane, à 55 °C, est initialement due à un métabolisme acétoclastique. Après injection d’acétate, le facteur de fractionnement apparent est placé en zone de mélange de métabolisme. Vers la fin des incubations, la valeur du facteur de fractionnement apparent réaffiche une zone acétoclastique. Donc la présence de l’acétate dans ces incubations a agi immédiatement sur le fonctionnement des voies métaboliques. Cette observation suggère que lorsque la concentration d’acétate augmente dans le milieu, le métabolisme acétoclaste n’est plus la seule voie métabolique active mais une autre voie s’active, cela est probablement dû à l’inhibition des membres de la famille des Methanosaetaceae, des acétoclastes strictes, par la forte concentration d’acétate. Une fois que la concentration d’acétate diminue, les Methanosaetaceae échappent au phénomène d’inhibition par l’acétate. Ces observations sont en accord avec d’autres travaux (Ferry, 1993a ; Batstone et al., 2002) où le phénomène d’inhibition des Methanosaetaceae est observé sous l’action de l’accumulation rapide de l’acétate.
5. Conclusions
26Le système expérimental d’incubation en microcosme mis au point constitue un moyen pertinent pour l’étude des différentes voies métaboliques de la méthanogenèse. L’évolution de la composition isotopique du méthane indique clairement que, dans les conditions mésophiles tout comme en conditions thermophiles, le méthane a été successivement produit par différentes voies métaboliques. Par conséquent, l'effet de la température doit plutôt être interprété comme une préadaptation des communautés initiales à des conditions différentes et non comme une pression de sélection. Les inocula initiaux sont mésophiles (Boues de la station d’épuration d’Évry). Après préadaptation en conditions thermophiles, la différence de diversité observée pourrait être due au fait que les micro-organismes mésophiles sont progressivement éliminés durant la longue période d'incubation thermophile en laboratoire, avec des boues. Toutefois, les mêmes fonctions (hydrolyse, fermentation et méthanognèse) restent assurées par de nouveaux micro-organismes adaptés aux conditions thermophiles. Ainsi, d’autres variables physiques et géochimiques peuvent également modifier la diversité microbienne impliquée dans le processus de la digestion anaérobie. Ces paramètres doivent être pris en considération pour l’application de meilleures performances des digesteurs anaérobies.
Bibliographie
Batstone D.J. et al., 2002. The influence of calcium on granular sludge in a full-scale UASB treating paper mill wastewater. Water Sci. Technol., 45(10), 187-193.
Chouari R. et al., 2005. Novel predominant archaeal and bacterial groups revealed by molecular analysis of an anaerobic sludge digester. Environ. Microbiol., 7(8), 1104-1115.
Ciotola R. et al., 2013. Microbial community response to seasonal temperature variation in a small-scale anaerobic digester. Energies, 6(10), 5182-5199.
Conrad R., 1999. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments. FEMS Microbiol. Ecol., 28(3), 193-202.
Conrad R., 2005. Quantification of methanogenic pathways using stable carbon isotopic signatures: a review and a proposal. Organic Geochem., 36(5), 739-752.
Ferry J.G., 1993a. Fermentation of acetate. In: Ferry J.G., ed. Methanogenesis. Ecology, physiology, biochemistry and genetics. New York, NY, USA: Chapman and Hall, 305-334.
Ferry J.G., 1993b. Fermentation of acetate. New York, NY, USA: Chapman and Hall.
Ficker M., Krastel K., Orlicky S. & Edwards E., 1999. Molecular characterization of a toluene-degrading methanogenic consortium. Appl. Environ. Microbiol., 65(12), 5576-5585.
García-Martínez J. & Rodríguez-Valera F., 2000. Microdiversity of uncultured marine prokaryotes: the SAR11 cluster and the marine Archaea of group I. Mol. Ecol., 9(7), 935-948.
Glissmann K., Chin K.-J., Casper P. & Conrad R., 2004. Methanogenic pathway and archaeal community structure in the sediment of eutrophic lake dagow: effect of temperature. Microbial Ecol., 48, 389-399.
Huang L.N. et al., 2002. Diversity and structure of the archaeal community in the leachate of a full-scale recirculating landfill as examined by direct 16S rRNA gene sequence retrieval. FEMS Microbiol. Lett, 214(2), 235-240.
Karakashev D., Batstone D.J. & Angelidaki I., 2005. Influence of environmental conditions on methanogenic compositions in anaerobic biogas reactors. Appl. Environ. Microbiol., 71(1), 331-338.
Kundu K., Sharma S. & Sreekrishnan T.R., 2012. Effect of operating temperatures on the microbial community profiles in a high cell density hybrid anaerobic bioreactor. Bioresour. Technol., 118, 502-511.
Kundu K., Sharma S. & Sreekrishnan T.R., 2013. Changes in microbial communities in a hybrid anaerobic reactor with organic loading rate and temperature. Bioresour. Technol., 129, 538-547.
Laloui-Carpentier W. et al., 2006. Methanogenic diversity and activity in municipal solid waste landfill leachates. Antonie Van Leeuwenhoek, 89(3-4), 423-434.
Leclerc M., Delgenes J.P. & Godon J.J., 2004. Diversity of the archaeal community in 44 anaerobic digesters as determined by single strand conformation polymorphism analysis and 16S rDNA sequencing. Environ Microbiol., 6(8), 809-819.
Leven L., Eriksson A.R. & Schnurer A., 2007. Effect of process temperature on bacterial and archaeal communities in two methanogenic bioreactors treating organic household waste. FEMS Microbiol. Ecol., 59(3), 683-693.
Loy A. et al., 2002. Oligonucleotide microarray for 16S rRNA gene-based detection of all recognized lineages of sulfate-reducing prokaryotes in the environment. Appl. Environ. Microbiol., 68(10), 5064-5081.
Manz W. et al., 1992. Phylogenetic oligodeoxynucleotide probes for the major subclasses of proteobacteria: problems and solutions. Syst. Appl. Microbiol., 15, 593-600.
McMahon K.D., Stroot P.G., Mackie R.I. & Raskin L., 2001. Anaerobic codigestion of municipal solid waste and biosolids under various mixing conditions. II: Microbial population dynamics. Water Res., 35(7), 1817-1827.
Padmasiri S.I. et al., 2007. Methanogenic population dynamics and performance of an anaerobic membrane bioreactor (AnMBR) treating swine manure under high shear conditions. Water Res., 41(1), 134-144.
Penning H., Claus P., Casper P. & Conrad R., 2006. Carbon isotope fractionation during acetoclastic methanogenesis by methanosaeta concilii in culture and a lake sediment. Appl. Environ. Microbiol., 72(8), 5648-5652.
Qu X. et al., 2009. Combined monitoring of changes in δ13CH4 and archaeal community structure during mesophilic methanization of municipal solidwaste. FEMS Microbiol. Ecol., 68, 236-245.
Riviere D. et al., 2009. Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge. ISME J., 3(6), 700-714.
Welander P.V. & Metcalf W.W., 2005. Loss of the mtr operon in Methanosarcina blocks growth on methanol, but not methanogenesis, and reveals an unknown methanogenic pathway. Proc. Natl. Acad. Sci. U.S.A., 102(30), 10664-10669.






