- Home
- volume 10 (2006)
- numéro 1
- Présence en Tunisie d’isolats de Fusarium sambucinum résistants aux benzimidazoles : développement in vitro et agressivité sur tubercules de pomme de terre
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Présence en Tunisie d’isolats de Fusarium sambucinum résistants aux benzimidazoles : développement in vitro et agressivité sur tubercules de pomme de terre

Editor's Notes
Reçu le 23 février 2005, accepté le 2 juin 2005
Résumé
Le comportement de 55 isolats de Fusarium spp., responsables de la pourriture sèche des tubercules de pomme de terre, est étudié vis-à-vis de certains fongicides benzimidazoles. Les isolats tunisiens de F. solani (12), de F. oxysporum (23) et de F. graminearum (10) se sont montrés sensibles au carbendazime et au bénomyl apportés à 5 mg.l-1 dans le milieu PDA (Potato Dextrose Agar). Leur interaction avec le méthyl-thiophanate est différente ; une inhibition totale de leur croissance mycélienne est obtenue à doses supérieures ou égales à 500 mg.l-1. Tous les isolats tunisiens de F. sambucinum collectés lors des années 2002, 2003 et 2004 se sont avérés résistants aux trois benzimidazoles testés reflétant l’existence d’une résistance croisée. En effet, ces isolats ont toléré la carbendazime (et le bénomyl) à 200 mg.l-1 et le méthyl-thiophanate à 1000 mg.l-1. C’est la première étude en Tunisie qui signale l’émergence de ce type de résistance chez F. sambucinum. Les isolats de F. sambucinum traités à base de carbendazime (à 100 mg.l-1) ont montré, sur les tubercules de variété Spunta, une agressivité comparable à celle des isolats témoins.
Abstract
Presence in Tunisia of Fusarium sambucinum isolates resistant to benzimidazoles: in vitro growth and aggressiveness on potato tubers. The behaviour of 55 isolates of Fusarium spp. causing dry rot of the potato tubers, is studied against some benzimidazoles fungicides. Tunisian isolates of F. solani (12), F. oxysporum (23) and F. graminearum (10) are sensitive in vitro to carbendazime and benomyl at 5 mg.l-1. Their interaction with thiophanate-methyl is different; a complete inhibition of their mycelial growth is observed at doses higher than 500 mg.l-1. Tunisian isolates of F. sambucinum collected during 2002, 2003 and 2004 are resistant to these benzimidazoles showing existence of a cross-resistance. In fact, these isolates tolerated carbendazime (and benomyl) at 200 mg.l-1 and thiophanate-methyl at 1000 mg.l-1. This is the first study in Tunisia indicating emergence of this type of F. sambucinum resistance. Control isolates of F. sambucinum and those treated with carbendazime at 100 mg.l-1 showed a similar aggressiveness on potato tubers of the Spunta cultivar.
Table of content
1. Introduction
1En Tunisie, la pourriture sèche des tubercules de pomme de terre est causée par un complexe d’espèces ou de variétés de Fusarium dont les incidences et les fréquences d’isolement sont variables d’une année à l’autre. Fusarium solani et Fusarium oxysporum sont les plus fréquemment isolés à partir des tubercules issus d’une production locale tunisienne, alors que Fusarium sambucinum (syn. Fusarium sulphureum) et à un moindre degré Fusarium graminearum sont récemment apparus (Daami-Remadi, El Mahjoub, 1996a ; Priou, El Mahjoub, 1999 ; Daami-Remadi, El Mahjoub, 2004).
2Les fongicides de la famille des benzimidazoles (bénomyl, carbendazime, méthyl-thiophanate et thiabendazole) s’utilisent depuis de nombreuses années, sur pomme de terre pour combattre Phoma exigua, Helminthosporium solani, Rhizoctonia solani et divers Fusarium (Leach, Nielsen, 1975 ; Carnegie et al., 1990 ; Bang, 1992 ; Mérida, Loria, 1994 ; Carnegie et al., 1998 ; Errampalli, Johnston, 2001).
3Une étude préliminaire de lutte chimique contre Fusarium spp. sur pomme de terre a montré l’efficacité du thiabendazole, du bénomyl et du méthyl-thiophanate (Daami-Remadi, El Mahjoub, 1997).
4L’émergence de F. sambucinum Fuckel (téléomorphe : Gibberella pulicaris (Fr.) Sacc.) est observée ces dernières années dans certaines zones de production de la pomme de terre en Tunisie (Daami-Remadi, 2001). Cette émergence est plus qu’inquiétante, puisque cet agent pathogène est le plus agressif sur tubercules (Tivoli, Jouan, 1981 ; Jellis, Starling, 1983 ; Leach, 1985 ; Daami-Remadi, El Mahjoub, 1996b). De plus, dans certains pays, il a développé une résistance au thiabendazole (Tivoli et al., 1986 ; Hide et al., 1992 ; Desjardins et al., 1993 ; Kawchuck et al., 1994 ; Hanson et al., 1996 ; Platt, 1997 ; Thomson, Waterer, 1999 ; Peters et al., 2001 ; Gonzalez et al., 2002). Ce type de résistance persiste dans la nature même après plusieurs années de non-emploi de ce fongicide (Kawchuk et al., 1994) et ne s’est pas limité uniquement à F. sambucinum. En effet, des isolats de F. solani et de F. culmorum résistants au thiabendazole ont été signalés respectivement en Allemagne, en Grande-Bretagne et en Ecosse (Hanson et al., 1996). C’est le cas aussi de F. avenaceum (Satyaprasad et al., 1997), de F. oxysporum et de F. equiseti (Hanson, Loria, 1994). De plus, des cas de résistance au thiabendazole ont été signalés dans les pays à partir desquels la Tunisie importe souvent des tubercules semences, dont la France par exemple (Tivoli et al., 1986).
5Comme en Tunisie, la pourriture sèche résulte d’un complexe d’espèces ou de variétés de Fusarium, l’étude de leur comportement vis-à-vis de certaines molécules appartenant à la famille des benzimidazoles s’impose. L’étude de l’agressivité sur tubercules des isolats résistants permet de renseigner sur le risque découlant de leur présence en Tunisie et de revoir la stratégie de lutte contre la pourriture sèche.
2. Matériels et Méthodes
2.1. Matériels biologiques
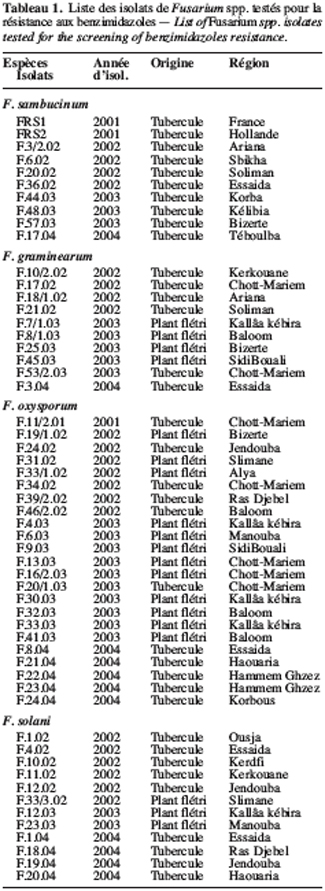
6Agents pathogènes. Les Fusarium spp. testés sont isolés à partir de tubercules montrant des symptômes typiques de pourriture sèche ou bien à partir de plants flétris. Il s’agit d’un complexe parasitaire composé de F. solani, de F. graminearum, de F. sambucinum et de F. oxysporum. La liste de tous les isolats utilisés figure dans le tableau 1. Ces isolats de Fusarium sont cultivés à 25 °C sur un milieu PDA (Potato Dextrose Agar) additionné de sulfate de streptomycine à raison de 300 mg.l-1. Leur conservation à long terme se réalise à -20 °C dans du glycérol à 20 %.
7Les isolats FRS1 et FRS2 proviennent de tubercules de pomme de terre importés atteints de pourriture sèche et préalablement traités par le thiabendazole. Ils sont inclus dans cette étude comme témoins positifs résistants.
8Variété de pomme de terre. Les tubercules utilisés pour le test du pouvoir pathogène des Fusarium spp. appartiennent à la variété Spunta. Ils sont utilisés environ un mois après leur récolte.
9Ces tubercules sont conservés à 6 °C et remis à la température ambiante trois heures avant leur inoculation.
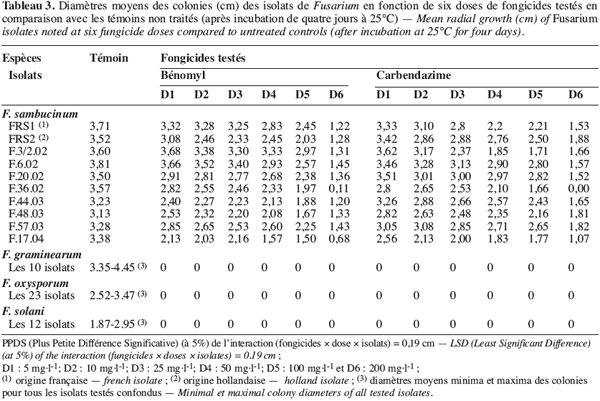
2.2. Fongicides testés
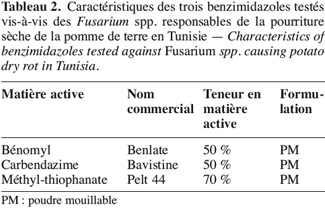
10Trois fongicides de la famille des benzimidazoles, inscrits dans l’index phytosanitaire de la Tunisie (Anonyme, 2003), sont choisis. Leurs principales caractéristiques sont résumées dans le tableau 2.
11Le thiabendazole ne figure pas sur cette liste car il n’est pas homologué en Tunisie.
2.3. Etude de la résistance aux benzimidazoles in vitro
12Les doses testées sur la croissance mycélienne des isolats de Fusarium spp. sont de 5, 10, 25, 50, 100 et 200 mg.l-1 pour le bénomyl et la carbendazime. Pour le méthyl-thiophanate, la gamme des concentrations testées est plus large ; elle varie de 10 à 2500 mg.l-1.
13Ces divers fongicides sont mis en suspension dans de l’éthanol absolu avant leur incorporation (1 % v/v), suivant les doses prévues, dans le milieu PDA en surfusion. Un milieu de culture additionné uniquement de la même quantité d’éthanol absolu sert de témoin négatif non traité (dose 0 mg.l-1).
14Une fois le milieu de culture solidifié, les divers isolats sont repiqués à raison de quatre explants par boite de Petri. Ces explants, colonisés par l’agent pathogène, sont déposés de manière équidistante. Les diamètres des colonies formées sont mesurés après quatre jours d’incubation à 25 °C.
15Les isolats présentant une croissance mycélienne à 5-10 mg.l-1 de bénomyl ou de carbendazime sont considérés résistants et ce, suivant la méthode adoptée par Kawchuck et al. (1994) et Hanson et al. (1996).
16L’analyse de variance pour les deux fongicides (bénomyl et carbendazime) est celle d’un dispositif complètement aléatoire en essai factoriel à trois facteurs qui sont les fongicides, les doses (y compris la dose 0 mg.l-1) et les isolats. La comparaison des moyennes se fait suivant la méthode PPDS au seuil de 5 %.
17Pour le méthyl-thiophanate, l’analyse de variance adoptée est celle d’un dispositif en essai factoriel à deux facteurs qui sont les doses et les différents isolats testés.
2.4. Etude de l’agressivité des isolats résistants sur tubercules
18Les isolats se montrant résistants au carbendazime in vitro ont fait l’objet d’un test d’agressivité sur tubercules.
19Les tubercules (variété Spunta) sont lavés à l’eau courante puis désinfectés par trempage, pendant trois minutes, dans une solution d’hypochlorite de sodium (10 %). Ils sont ensuite rincés trois fois avec une eau distillée stérile.
20L’inoculation est réalisée en occasionnant sur les tubercules des blessures ayant 6 mm de diamètre et de profondeur, en utilisant un emporte-pièces. Un explant de gélose de 6 mm de diamètre, portant l’agent pathogène, est déposé au niveau de chaque blessure. Pour chacun des isolats testés, deux lots de dix tubercules sont utilisés : un premier inoculé par les cultures témoins non traitées et un deuxième inoculé par les cultures traitées avec la carbendazime à la dose de 100 mg.l-1.
21Les isolats qui se sont montrés sensibles dans les tests effectués in vitro ne sont pas inclus dans cet essai.
22L’incubation des tubercules est réalisée à une température comprise entre 25 et 30 °C pendant environ 15 jours. Au terme de cette période, les tubercules sont sectionnés longitudinalement et les dimensions de la pourriture induite sont mesurées (largeur (l) et profondeur (p) maximales). Le paramètre étudié, traduisant l’importance relative des pourritures, est la pénétration moyenne calculée en utilisant la formule proposée par Lapwood et al. (1984) :
23P (mm) = {l/2+(p-6)}/2
24L’analyse de variance est celle d’un dispositif complètement aléatoire en essai factoriel (avec répétition d’expérience) à deux facteurs : les traitements (témoin ou traité) et les différents isolats. La comparaison des moyennes se fait suivant la méthode PPDS au seuil de 5 %.
3. Résultats
25Les comportements de 55 isolats de Fusarium spp. collectés durant trois années successives sont étudiés vis-à-vis de certains fongicides benzimidazoles.
3.1. Effets in vitro de certaines molécules de la famille des benzimidazoles vis-à-vis des Fusarium spp.
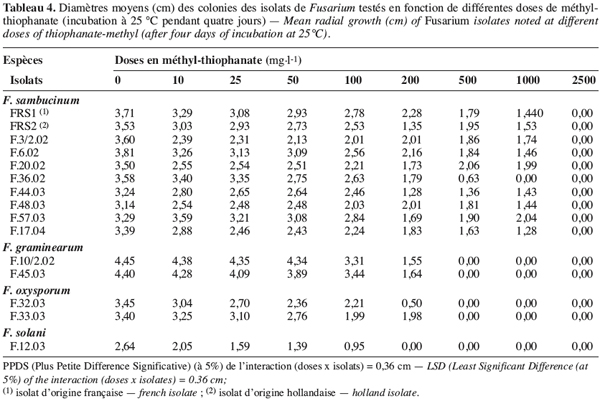
26La croissance mycélienne des isolats de Fusarium spp. est étudiée en fonction de deux fongicides testés à six doses. Le tableau 3 montre les diamètres moyens des colonies de Fusarium développées après quatre jours d’incubation à 25 °C.
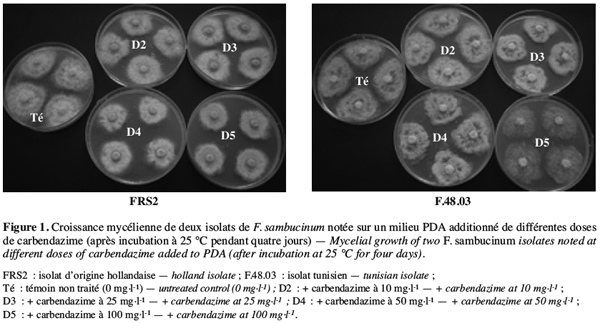
27Une interaction significative (au seuil de 5 %) est observée entre les différents isolats choisis, les fongicides et les doses testés. En effet, il ressort du tableau 3 que tous les isolats de F. graminearum, de F. oxysporum et de F. solani sont complètement inhibés par les deux fongicides testés appliqués même aux doses les plus faibles (5 et 10 mg.l-1). Par contre, tous les isolats de F. sambucinum se sont montrés insensibles au bénomyl et à la carbendazime pour toutes les doses testées. Ils ont donné un résultat comparable à celui de l’isolat FRS2 d’origine étrangère comme présenté dans la figure 1 pour l’isolat F.48.03. Ces isolats tunisiens de F. sambucinum capables de croître à des doses variant de 5 à 200 mg.l-1 sont ainsi classés résistants à ces deux molécules.
28Le méthyl-thiophanate, apporté à des doses allant de 10 à 2500 mg.l-1, a agit différemment sur les isolats de Fusarium testés et une interaction significative est notée entre les deux facteurs étudiés (Tableau 4). En effet, les isolats appartenant à F. graminearum, F. oxysporum et F. solani, se montrant sensibles à toutes les doses testées de la carbendazime et du bénomyl (Tableau 3), ont toléré le méthyl-thiophanate appliqué même à 200 mg.l-1. Ils ne sont complètement inhibés qu’à des doses supérieures à 500 mg.l-1. D’autre part, tous les isolats de F. sambucinum testés ont résisté au méthyl-thiophanate apporté à 1000 mg.l-1, alors qu’ils sont totalement inhibés à la dose de 2500 mg.l-1.
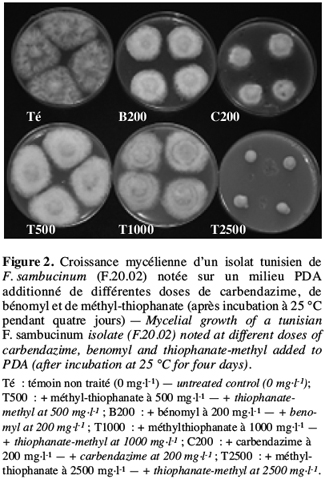
29Il est à signaler que tous les isolats de F. sambucinum testés se sont montrés résistants à la fois à la carbendazime, au bénomyl et au méthyl-thiophanate, ce qui prouve l’existence d’une résistance croisée chez ces isolats comme présenté dans la figure 2 pour l’isolat F.20.02.
30La présente étude montre que la résistance au bénomyl, à la carbendazime et au méthyl-thiophanate, chez les agents responsables de la pourriture sèche, ne concerne à présent que les isolats de F. sambucinum. Leur degré de résistance est comparable à celui des deux témoins positifs résistants (FRS1 et FRS2) d’origine étrangère.
3.2. Agressivité sur tubercules des isolats de F. sambucinum résistants
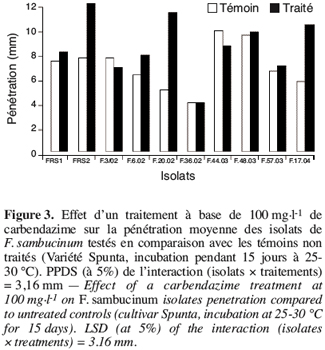
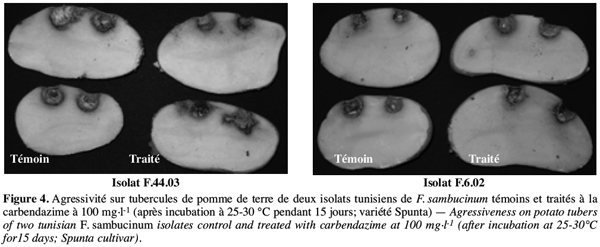
31Le pouvoir pathogène des isolats de F. sambucinum, qui se sont avérés résistants à la carbendazime apportée à la dose de 100 mg.l-1, a été comparé à celui des témoins. La figure 3 montre qu’au bout de 15 jours d’incubation tous les isolats de F. sambucinum testés ont montré une agressivité comparable à celle des témoins non traités (Figure 4). La figure 4 illustre cette observation pour deux des isolats.
4. Discussion
32Les fongicides de la famille des benzimidazoles tels que le bénomyl et le méthyl-thiophanate ont été largement utilisés pour lutter contre les champignons phytopathogènes appartenant aux Ascomycota (Keinath, Zitter, 1998).
33Les champignons phytopathogènes résistants aux fongicides ont émergé depuis les années 1970. Cette perte soudaine d’efficacité a eu lieu suite à l’introduction de fongicides ayant un seul site d’action, tels que les benzimidazoles (McPhee, Nestmann, 1983).
34Dans une étude de lutte chimique contre certains agents de pourriture sèche des tubercules, Daami-Remadi et El Mahjoub (1997) ont signalé l’existence d’une interaction entre certains benzimidazoles testés (thiabendazole, méthyl-thiophanate et bénomyl) et les différents Fusarium spp. utilisés. Le bénomyl s’est montré efficace in vitro contre F. solani, F. graminearum, F. culmorum et F. sambucinum. Plus tard, Chérif et al. (2001) ont démontré la grande efficacité du méthyl-thiophanate (100 g.hl-1) et de la carbendazime (25 mg.l-1) vis-à-vis de la germination, de la croissance mycélienne et de la sporulation d’un isolat local de F. sambucinum.
35La présente étude signale, pour la première fois en Tunisie, l’apparition d’isolats de F. sambucinum résistants aux benzimidazoles. Cette observation est surprenante puisque, jusqu’à présent, aucun fongicide benzimidazole n’est homologué en traitement de post-récolte des tubercules. Ces fongicides sont par contre largement utilisés en Tunisie sur d’autres cultures pour combattre Botrytis cinerea, Oïdium, etc.
36Des isolats de F. sambucinum résistants au thiabendazole ont été découverts pour la première fois en Europe (Tivoli et al., 1986) et depuis, plusieurs études ont été effectuées dans divers pays (Carnegie, Cameron, 1992 ; Hanson et al., 1996 ; Platt, 1997 ; Peters et al., 2001). Des isolats résistants de F. solani et de F. culmorum ont été signalés respectivement en Allemagne et en Grande-Bretagne. La résistance au thiabendazole a été signalée chez des espèces de Fusarium autres que F. sambucinum uniquement Europe.
37La résistance des Fusarium spp. aux benzimidazoles est aussi largement étudiée aux Etats-Unis. En effet, Desjardins et al. (1993) ont noté une modification de la sensibilité au thiabendazole chez des isolats de F. sambucinum. Plus tard, Hanson et Loria (1995) ont signalé que 155 isolats appartenant à F. acuminatum, F. avenaceum, F. crookwellence, F. culmorum, F. equiseti, F. oxysporum, F. sambucinum et F. solani ont réagi différemment vis-à-vis de trois fongicides benzimidazoles utilisés : le bénomyl et le thiabendazole (à 5 mg.l-1) et le méthyl-thiophanate (à 25 mg.l-1).
38Les isolats tunisiens de F. solani (12), de F. oxysporum (23) et de F. graminearum (10) testés se sont montrés sensibles à la carbendazime et au bénomyl apportés à 5 mg.l-1, où une inhibition totale est notée. L’interaction de ces trois espèces de Fusarium avec le méthyl-thiophanate est différente. En effet, une croissance mycélienne, bien que significativement plus faible que celle du témoin, est observée dans le cas des doses variant de 10 à 200 mg.l-1. Une inhibition totale de leur croissance mycélienne est obtenue à des doses supérieures, de l’ordre de 500 mg.l-1.
39Dans la présente étude, le seul cas de résistance aux benzimidazoles est noté chez les isolats de F. sambucinum et ce malgré leur faible fréquence d’isolement comparativement à celle de F. solani et au F. oxysporum (Daami-Remadi, El Mahjoub, 2004). Ces résultats rejoignent en partie ceux obtenus par Kawchuk et al. (1994), Platt (1997) et Peters et al. (2001) qui ont signalé des cas de résistance aux benzimidazoles uniquement chez F. sambucinum, et ce malgré l’isolement de diverses espèces de Fusarium d’un même lot de tubercules. De même, Hanson et al. (1996) ont trouvé que 80 % des espèces de Fusarium associées à la pourriture sèche de la pomme de terre et ayant une résistance au thiabendazole sont des F. sambucinum.
40Les isolats de F. sambucinum objets de cette étude se sont avérés hautement résistants au bénomyl et à la carbendazime (200 mg.l-1), mais également au méthyl-thiophanate (1000 mg.l-1) incorporés dans le milieu de culture. Ces isolats montrent ainsi une résistance croisée vis-à-vis de ces trois benzimidazoles. Les travaux de Hanson et Loria (1996) ont montré que certains isolats de F. sambucinum (64 sur 71) et de F. solani (9 sur 47) ont toléré 10 mg.l-1 de thiabendazole et de bénomyl exprimant ainsi une résistance croisée. Chez d’autres isolats, l’interaction avec ces deux fongicides est différente ; certains peuvent croître sur thiabendazole et non sur bénomyl et vice-versa. Kawchuck et al. (2002) ont expliqué que ce phénomène a généralement lieu chez des fongicides tels que les benzimidazoles ayant des structures proches et un mode d’action similaire. Ils ont conclu qu’une fois ce type de résistance établi, le recours à l’emploi d’un autre fongicide de la même famille des benzimidazoles n’est pas conseillé.
41Les niveaux de résistance aux benzimidazoles semblent correspondre, chez d’autres champignons filamenteux, à des mutations spécifiques au niveau du gène codant pour la beta-tubuline (Koenraadt et al., 1992 ; Koenraadt, Jones, 1993), ce que Kawchuck et al. (2002) ont confirmé pour F. sambucinum.
42Les tests de pathogénicité conduits sur les tubercules (variété Spunta) ont montré que les isolats tunisiens de F. sambucinum résistants à la carbendazime (à 100 mg.l-1) se sont avérés aussi agressifs que les isolats témoins non traités.
43Nos résultats rejoignent de plus ceux obtenus par Hide et al. (1992), Desjardins et al. (1993) et Kawchuck et al. (1994), qui ont trouvé que les isolats de F. sambucinum et de F. oxysporum résistants au thiabendazole ne montrent pas forcément une réduction de leur croissance ou de leur pathogénicité. Ils présentent une vitesse de développement et un pouvoir pathogène comparables à ceux des isolats sensibles.
44L’émergence de ce type de résistance chez F. sambucinum en Tunisie, malgré l’absence de traitements de post-récolte sur tubercules, s’expliquerait par les caractéristiques biologiques du pathogène lui-même et les bases génétiques de ce type de résistance. En effet, Desjardins et al. (1993) ont trouvé que les souches résistantes de F. sambucinum sont végétativement compatibles avec les souches sensibles. Ils ont également montré qu’elles sont compétitives avec ces dernières et de ce fait, elles ont la possibilité de se disséminer et de persister dans les parcelles. Cependant, chez F. solani, les isolats résistants au thiabendazole montrent une croissance réduite en culture, traduisant un coût à la résistance, alors qu’ils demeurent pathogènes sur tubercules de pomme de terre (Hanson et al., 1996).
45Par conséquent, dans le cas de la Tunisie, cet inoculum résistant de F. sambucinum aurait pu être introduit à travers les semences étrangères et s’est maintenu au niveau des sols. La transmission de la résistance aux benzimidazoles aux tubercules fils se fait à travers l’inoculum résistant existant au niveau de la rhizosphère (Nolte, 1993) ou bien au niveau du tubercule-mère (Adam, Lapwood, 1983 ; Leach, 1985). De plus, cette résistance peut persister dans la population du pathogène même après arrêt d’utilisation du fongicide (Kawchuk et al., 1994). McPhee et Nestmann (1983) ont précisé que plusieurs facteurs agissent sur la fréquence et la survie des mutants résistants au champ : la virulence, la fréquence de multiplication et la vitesse de colonisation du milieu.
5. Conclusion
46La présente étude signale, pour la première fois en Tunisie, la présence d’isolats de F. sambucinum résistants aux benzimidazoles. Ces isolats se sont montrés résistants à la fois au bénomyl, à la carbendazime (200 mg.l-1) et au méthyl-thiophanate (1000 mg.l-1) incorporés dans le milieu de culture, ce qui prouve l’existence d’une résistance croisée vis-à-vis de ces trois benzimidazoles.
47Les tests de pathogénicité conduits sur les tubercules (variété Spunta) ont montré que les isolats tunisiens de F. sambucinum résistants à la carbendazime (à 100 mg.l-1) se sont avérés aussi agressifs que les isolats témoins non traités.
48Les isolats de F. solani (12), de F. oxysporum (23) et de F. graminearum (10) testés in vitro se sont montrés sensibles à la carbendazime et au bénomyl (à 5 mg.l-1).
49La résistance aux benzimidazoles observée chez les isolats tunisiens de F. sambucinum, bien qu’elle ne soit pas généralisée chez l’ensemble des agents de pourriture sèche, nécessite un réajustement rapide de la stratégie de lutte. Un contrôle beaucoup plus sévère des lots de semences importés, un bon tri des tubercules avant et après leur conservation, la destruction des tubercules pourris et l’utilisation des semences indemnes contribueront à la réduction de l’incidence de cette maladie.
50Remerciements
51Les auteurs tiennent à remercier Monsieur Tivoli Bernard (I.N.R.A., Rennes) qui a accepté de lire le document initial et d’y apporter des critiques constructives. Youssef A., Jabnoun-Khiareddine H., Hibar K., Ayed F. et Mansour M. sont également vivement remerciés pour leur assistance technique. L’Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, le Centre technique de la pomme de terre de Tunisie, le Centre Technique d’Agriculture biologique et le Groupement Interprofessionnel des Légumes sont aussi remerciés pour leur soutien financier.
Bibliographie
Adams MJ., Lapwood DH. (1983). Transmission of F. solani var. coeruleum and F. sulphureum from seed potatoes to progeny tubers in the field. Ann. Appl. Biol. 103, p. 411–417.
Anonyme (2003). Guide phytosanitaire de la Tunisie (2 éd.). Association Tunisienne de la Protection des Plantes. 206 p.
Bang U. (1992). Influence of seed tuber infestation, chemical seed treatment, and pre-harvest climate on incidence of gangrene and dry rot of potato (Solanum tuberosum L.). Potato Res. 35, p. 3–15.
Carnegie SF., Cameron AM. (1992). Resistance to thiabendazole in isolates of Polyscytalum pustulans (skin spot) and Fusarium solani var. coeruleum (dry rot) in Scotland. Plant Pathol. 41, p. 606–610.
Carnegie SF., Ruthven AD., Lindsay DA., Hall TD. (1990). Effects of fungicides applied to seed potato tubers at harvest or after grading on fungal storage diseases and plant development. Ann. Appl. Biol. 116, p. 61–72.
Carnegie SF., Cameron AM., Lindsay DA., Sharp E., Nevison IM. (1998). The effect of treating seed potato tubers with benzimidazole, imidazole and phenylpyrrole fungicides on the control of rot and skin blemish diseases. Ann. Appl. Biol. 133, p. 343–363.
Chérif M., Omri N., Hajlaoui MR., Mhamdi M., Boubaker A. (2001). Effet de quelques fongicides sur un agent de pourriture sèche des tubercules de pomme de terre Fusarium roseum var. sambucinum et sur les Trichoderma antagonistes. Ann. Inst. Natl de Rech. Agron. Tunisie 74, p. 131–149.
Daami-Remadi M. (2001). Lutte biologique contre les Fusarium spp. agents pathogènes responsables de la pourriture sèche des tubercules de pomme de terre. Mémoire de Diplôme d’Etudes Approfondies en Protection des Plantes et Environnement de l’Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, Tunisie, 72 p.
Daami-Remadi M., El Mahjoub M. (1996a). Fusariose de la pomme de terre en Tunisie (I). Potentiel infectieux et comportement variétal. Ann. Inst. Natl Rech. Agron. Tunisie 69, p. 89–99.
Daami-Remadi M., El Mahjoub M. (1996b). Fusariose de la pomme de terre en Tunisie (III). Comportement des variétés de pomme de terre vis-à-vis des souches locales de Fusarium. Ann. Inst. Natl Rech. Agron. Tunisie 69, p. 113–130.
Daami-Remadi M., El Mahjoub M. (1997). Fusariose de la pomme de terre en Tunisie (IV). Activité de quatre fongicides vis-à-vis des souches locales de Fusarium. Ann. Inst. Natl Rech. Agron. Tunisie 70, p. 3–19.
Daami-Remadi M., El Mahjoub M. (2004). Emergence en Tunisie de Fusarium oxysporum f.sp. tuberosi agent de flétrissure vasculaire des plantes et de pourriture sèche des tubercules de pomme de terre. EPPO Bull. 34 (3), p. 407–411.
Desjardins AE., Christ-Harned EA., McCormick SP., Secor GA. (1993). Population structure and genetic analysis of field resistance to thiabendazole in Gibberella pulicaris from potato tubers. Phytopathology 83, p. 164–170.
Errampalli D., Johnston HW. (2001). Control of tuber-borne black scurf (Rhizoctonia solani) and common scab (Streptomyces scabies) of potatoes with a combination of sodium hypochlorite and thiophanate-methyl preplanting seed tuber treatment. Can. J. Plant. Pathol. 23, p. 68–77.
Gonzalez CF., Provin EM., Zhu L., Ebbole DJ. (2002). Independent and synergistic activity of synthetic peptides against thiabendazole-resistant Fusarium sambucinum. Phytopathology 92, p. 917–924.
Hanson LE., Loria R. (1994). Thiabendazole resistance in Fusarium spp. causing dry rot of potato in the North eastern United States. Phytopathology 84, p. 1078–1079 (abstract).
Hanson LE., Loria R. (1995). Response of Fusarium isolates from potato tubers to benzimidazole fungicides. Phytopathology 85, p. 1126 (abstract).
Hanson LE., Loria R. (1996). Lack of cross resistance to benzimidazole fungicides in Fusarium sambucinum and Fusarium solani isolates from potato tubers. Phytopathology 86, p. 10 (abstract).
Hanson LE., Schwager SJ., Loria R. (1996). Sensitivity to thiabendazole in Fusarium species associated with dry rot of potato. Phytopathology 86, p. 378–384.
Hide GA., Read PJ, Hall SM. (1992). Resistance to thiabendazole in Fusarium species isolated from potato tubers affected by dry rot. Plant Pathol. 41, p. 745–748.
Holley JD., Kawchuk LM. (1996). Distribution of thiabendazole and thiophanate–methyl resistant strains of Helminthosporium solani and Fusarium sambucinum in Alberta potato storages. Can. Plant Dis. Survey 76, p. 21–27.
Jellis GJ., Starling NC. (1983). Resistance to powdery dry rot (Fusarium sulphureum) in potato tubers. Potato Res. 26, p. 295–301.
Kawchuk LM., Holley JD., Lynch DR., Clear RM. (1994). Resistance of thiabendazole and thiophanate-methyl in Canadian isolates of Fusarium sambucinum and Helminthosporium solani. Am. Potato J. 71, p. 185–192.
Kawchuk LM., Hutchison LJ., Verhaeghe CA., Lynch DR., Bains PS., Holley JD. (2002). Isolation of the b-tubulin gene and characterization of thiabendazole resistance in Gibberella pulicaris. Can. J. Plant Pathol. 24, p. 233–238.
Keinath AP., Zitter AZ. (1998). Resistance to benomyl and thiophanate-methyl in Didymelle bryoniae from South Carolina and New York. Plant Dis. 82, p. 479–484.
Koenraadt H., Jones AL. (1993). Resistance to benomyl conferred by mutations in codon 198 or 200 of the beta-tubulin gene of Neurospora crassa and sensitivity to diethofencarb by codon 198. Phytopathology 83, p. 850–854.
Koenraadt H., Somerville SC., Jones AL. (1992). Characterization of mutations in the beta-tubulin gene of benomyl-resistant field strains of Venturia inaequalis and other plant pathogenic fungi. Phytopathology 82, p. 1348–1354.
Lapwood DH., Read PJ., Spokes J. (1984). Methods for assessing the susceptibility of potato tubers of different cultivars to rotting by Erwinia carotovora subsp. atroseptica and carotovora. Plant Pathol. 33, p. 13–20.
Leach SS. (1985). Contamination of soil and transmission of seedborne potato dry rot fungi (Fusarium spp.) to progeny tubers. Am. Potato J. 62, p. 129–136.
Leach SS., Nielsen LW. (1975). Elimination of fusarial contamination on seed potatoes. Am. Potato J. 52, p. 211–218.
McPhee WJ., Nestmann ER. (1983). Predicting potential fungicide resistance in fungal populations by using a continuous culturing technique. Phytopathology 73, p. 1230–1233.
Mérida CL., Loria R. (1994). Comparison of thiabendazole-sensitive and resistant Helminthosporium solani isolates from New York. Plant Dis. 78, p. 187–192.
Nolte P. (1993). Effect of fungicide resistance on Fusarium decay in cut potato seed. Am. Potato J. 70, p. 832–833.
Peters RD., Macdonald IK., MacIsaac KA. (2001). First report of thiabendazole-resistant isolates of Fusarium sambucinum infecting stored potatoes in Nova Scotia. Can. Plant Dis. 85, p. 1030 (disease note).
Platt HW. (1997). Resistance to thiabendazole in Fusarium species and Helminthosporium solani in potato tubers treated commercially in eastern Canada. Phytoprotection 78, p. 1–10.
Priou S., El Mahjoub M. (1999). Bacterial and fungal diseases in the major potato-growing areas of Tunisia. EPPO Bull. 29, p. 167–171.
Satyaprasad K., Bateman GL., Read PJ. (1997). Variation in pathogenicity on potato tubers and sensitivity to thiabendazole of dry rot fungus Fusarium avenaceum. Potato Res. 40, p. 357–365.
Thomson JR., Waterer DR. (1999). Diseases of stored potatoes in Saskatchewan in 1998/1999. Can. Plant Dis. Surv. 79, p. 121–123.
Tivoli B., Jouan B. (1981). Inventaire, fréquence et agressivité des différentes espèces ou variétés de Fusarium responsables de la pourriture sèche des tubercules de pomme de terre. Agronomie 1 (9), p. 787–794.
Tivoli B, Deltour A., Molet D., Bedin P., Jouan B. (1986). Mise en évidence de souches de Fusarium roseum var. sambucinum résistantes au thiabendazole, isolées à partir de tubercules de pomme de terre. Agronomie 6 (2), p. 219–224.
To cite this article
About: Mejda Daami-Remadi
Institut National de la Recherche agronomique de Tunisie. Pôle Régional de Recherche-Développement agricole du centre-Est de Chott-Mariem, 4042 Sousse (Tunisie). E-mail : daami_rm@yahoo.fr
About: Mohamed El Mahjoub
Ecole Supérieure d’Horticulture et d’Elevage de Chott-Mariem, 4042 Sousse (Tunisie).






