- Portada
- Volume 27 (2023)
- Numéro 4
- État des populations des mammifères terrestres dans la Réserve de Biosphère de Luki (République démocratique du Congo)
Vista(s): 0 (0 ULiège)
Descargar(s): 0 (0 ULiège)
État des populations des mammifères terrestres dans la Réserve de Biosphère de Luki (République démocratique du Congo)

Documento adjunto(s)
Version PDF originaleRésumé
Description du sujet. La faune mammalienne de la Réserve de Biosphère de Luki en République démocratique du Congo est soumise à de fortes pressions anthropiques menaçant son intégrité.
Objectifs. Cette étude vise à caractériser la diversité et l’état de conservation de la communauté animale mammalienne de la réserve, non documentés à ce jour.
Méthode. Pour y parvenir, une grille de 40 pièges photographiques a été déployée au cœur de la réserve durant 90 jours sur une surface de 32 km2. En parallèle, un suivi journalier de l’activité de chasse de 50 chasseurs, issus de cinq villages situés en périphérie de la réserve, a été entrepris durant 63 jours.
Résultats. Les relevés des pièges photographiques ont permis de répertorier 14 taxons de mammifères, identifiés au moins au niveau du genre, parmi lesquels le chimpanzé (Pan troglotydes), espèce menacée d’extinction. Quant aux tableaux de chasse, 18 espèces ont été capturées sur la période suivie. Parmi les principaux groupes d’animaux recensés selon les deux approches, les rongeurs viennent en tête avec respectivement 86,4 % des détections par pièges photographiques et 66,9 % des prises par les chasseurs. Les espèces de taille moyenne, comme les céphalophes, sont peu détectées et peu capturées. Comparée à d’autres aires protégées d’Afrique centrale étudiées avec des dispositifs et des taux d’échantillonnages comparables, la réserve de Biosphère de Luki apparait bien pauvre en termes de diversité des espèces de mammifères.
Conclusions. Ces résultats semblent indiquer une forte altération de la communauté mammalienne résidant dans la Réserve de Biosphère de Luki, malgré la présence d’une petite population relictuelle de chimpanzés. L’absence d’espèces de taille moyenne à grande dans les tableaux de chasse et leur très faible détection par pièges photographiques montrent l’urgence d’accroître l’effort de surveillance et questionnent la politique de gestion participative de la réserve mise en place depuis près de 20 années.
Abstract
Status of terrestrial mammal populations in the Luki Biosphere Reserve (Democratic Republic of Congo)
Description of the subject. Mammal wildlife inside the Luki Biosphere Reserve in the Democratic Republic of Congo is under strong anthropic pressure, threatening its integrity.
Objectives. This study aims to characterize the diversity and conservation status of the Reserve's mammalian animal community, which has not been documented to date.
Method. To carry out this analysis, a grid of 40 camera traps was set up for 90 days within the core area of the Reserve, covering an area of 32 km². Simultaneously, daily monitoring of hunting activity was conducted amongst 50 hunters for 63 days, all from five villages located on the periphery of the reserve.
Results. We identified 14 mammalian taxa based on camera trap observations, all of which were identified at least at the genus level, including the endangered chimpanzee (Pan troglotydes). A total of 18 species were hunted during the entire research period. Among the major groups of animals recorded by the two survey approaches, rodents were the most important, representing 86.4 % of camera trap detections and 66.9% of hunted animals, respectively. Medium-sized species, such as duikers, are rarely detected or caught. Compared with other Central African protected areas studied with comparable sampling devices and rates, the Luki Biosphere Reserve appears quite poor, both in terms of richness and diversity.
Conclusions. These results suggest a strong alteration of the mammalian community present in the Luki Biosphere Reserve, despite the presence of a small relict population of chimpanzees. Furthermore, the lack of large and medium-sized species in offtake data and their very low detection rates by camera traps indicates the urgent need to increase monitoring efforts and questions the participatory management policy of the reserve that has been in place for nearly 20 years.
Tabla de contenidos
* Ces auteurs ont contribué à parts égales à cet article.
Reçu le 29 juin 2022, accepté le 7 aout 2023, mis en ligne le 5 septembre 2023
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1Les aires protégées, dont l’objectif principal est de protéger la biodiversité, constituent des zones de refuge pour de nombreuses communautés animales (Cazalis, 2020). C’est notamment le cas des mammifères terrestres qui représentent une composante clé des forêts tropicales (Ahumada et al., 2011). Cependant, dans certaines de ces aires protégées, les effets conjugués de la chasse, de la déforestation et des changements climatiques menacent ces communautés mammaliennes (Ahumada et al., 2013 ; Avila et al., 2019 ; Haurez et al., 2020). La pratique de la chasse pour la consommation ou le commerce est en effet considérée comme l’une des plus grandes menaces pour les mammifères des forêts tropicales humides (Fa et al., 2002 ; Poulsen et al., 2011). Son intensité se révèle particulièrement aiguë en Afrique (Hegerl et al., 2017), où la demande en viande de brousse est élevée (Wilkie et al., 2016). En Afrique centrale, notamment en République démocratique du Congo (RDC), il a été noté un fort appauvrissement faunique dans les aires protégées (Linchant et al., 2017 ; Van Vliet et al., 2023), principalement attribuable aux pratiques de chasse non durables (Van Vliet et al., 2017a). Face à cette pression, les grands et moyens mammifères à croissance et à taux de reproduction lents sont généralement les premiers à s'éteindre localement (Poulsen et al., 2011).
2La Réserve de Biosphère de Luki, dernière relique de la flore méridionale du Mayombe (Lubini, 1997), n'est pas épargnée par ce phénomène. La chasse commerciale et de subsistance y constitue l’une des principales activités menée par les populations riveraines (Nyange, 2014 ; Ngabinzeke & Tongo, 2019). Elle s’exerce jusque dans la zone centrale, pourtant en principe strictement interdite à toute activité humaine (Cizungu et al., 2021).Toutefois, à l’heure actuelle, très peu d’informations existent quant à l’état actuel de la faune et des prélèvements des populations animales au sein de cette réserve. Quelques observations indirectes de la communauté animale ont été rapportées par Enganga (2015) et Mbende et al. (2016), mais elles s’avèrent insuffisantes pour guider la gestion et la prise de décision.
3Pour maintenir le rôle dévolu à cette aire protégée, il est crucial non seulement de connaître la diversité des espèces présentes (Tobler et al., 2008), mais aussi de comprendre l’influence des pratiques de chasse sur ces communautés animales (Hegerl et al., 2017). De ce fait, compte tenu des difficultés liées au dénombrement et au monitoring de la faune forestière en zone tropicale (Ahumada et al., 2013 ; Palei et al., 2016), Van Vliet et al. (2017b) suggèrent de recourir à un ensemble d’outils et approches permettant de renseigner l’état et le niveau des prélèvements des communautés animales. Parmi ces outils, citons le suivi de la chasse villageoise et les pièges photographiques. Les études « chasse » sont utilisées depuis longtemps pour donner une image indirecte de la communauté animale à partir des espèces présentes dans le tableau de chasse (Delvingt et al., 2001 ; Davies et al., 2007). C’est le cas notamment des travaux réalisés en Guinée équatoriale (Fa & Yuste, 2001 ; Albrechtsen et al., 2007), en République centrafricaine (Rieu, 2004 ; Fargeot, 2013), en République du Congo (Mbete et al., 2011 ; Van Vliet et al., 2015) ou encore au Cameroun (Bousquet et al., 2001 ; Hette, 2018). Notons également que certaines études ont privilégié des suivis directs de chasseurs (Froese et al., 2022), alors que d'autres (Semeki et al., 2014) n'ont enregistré que les espèces retournées au village (comme dans la présente étude). Plus récemment, l’inventaire par pièges photographiques a reçu une attention accrue des chercheurs (Hedwig et al., 2018 ; Bruce et al., 2018 ; Alempijevic et al., 2021 ; Fonteyn et al., 2021a ; Gaugris et al., 2021 ; Amin et al., 2022). Cette technique d’inventaire non invasive a permis, entre autres, de mieux comprendre l’écologie de certaines espèces rares, difficilement observables ou peu concernées par la chasse (Bessone et al., 2020 ; Cappelle et al., 2020), ainsi que de caractériser de manière plus fine les communautés animales terrestres (Rovero et al., 2014 ; Bowler et al., 2017 ; Foley et al., 2018) et arboricoles (Bowler et al., 2017 ; Hongo et al., 2020). L’émergence de modèles d’estimation d’abondance spécifique sans nécessité d’identification individuelle (O’Brien, 2011 ; Palei et al., 2016 ; Hongo et al., 2020 ; Cappelle et al., 2021 ; Gilbert et al., 2021) et d’indices reflétant l’activité des espèces (Jenks et al., 2011 ; Debata & Swain, 2018 ; Palmer et al., 2018 ; Cappelle et al., 2020 ; Houngbégnon et al., 2020) a également ouvert de nouvelles perspectives pour mieux comprendre et évaluer l’état des populations animales. Utilisées séparément, ces méthodes peuvent restreindre la compréhension de la communauté animale étudiée car elles se limitent, par exemple, aux taxons chassés dans le cadre du suivi des prélèvements de chasse ou aux espèces terrestres lors des inventaires réalisés à l'aide de pièges photographiques. L’utilisation conjointe de méthodes participatives (suivi des prélèvements de chasse, enquêtes semi-structurées) et de techniques d’inventaire innovantes (drone, pièges photographiques, ou appareils acoustiques) est donc souvent plébiscitée (Moller et al., 2004 ; Alempijevic et al., 2021 ; Pettersson, 2021).
4En combinant un suivi de l’activité de chasse en périphérie de la réserve avec un inventaire par pièges photographiques dans son noyau central, cette étude vise une première évaluation de l’état de conservation de la communauté animale mammalienne présente dans la Réserve de Biosphère Luki en vue d’élaborer des stratégies de gestion adaptative.
2. Matériel et méthodes
2.1. Milieu d’étude
5La Réserve de Biosphère de Luki (RBL) se trouve à l’ouest de la RDC, en bordure méridionale sud du massif forestier du Mayombe, dans la Province du Kongo Central (Lubini, 1997). Elle se situe entre 05°20’ et 05°42’ de latitude Sud et 13°4’ et 13°20’ de longitude Est, avec une superficie d’environ 33 000 ha (Figure 1). Sa création remonte en 1937 et elle a été reconnue comme faisant partie du réseau mondial des réserves de biosphère par l’UNESCO en 1979 (Opelele et al., 2021). Le climat est du type tropical humide Aw5 selon la classification de Köppen. Les précipitations moyennes annuelles varient entre 1 150 mm et 1 500 mm, alors que la température moyenne annuelle oscille entre 25 °C et 30 °C (Lubalega & Mananga, 2018). Sa végétation, typique du Mayombe, fait partie du groupe des forêts semi-décidues humides d’Afrique centrale (Fayolle et al., 2014). Plusieurs villages entourent la réserve et leurs populations y exercent différentes activités de subsistance, dont la chasse villageoise (Nyange, 2014 ; Ngabinzeke & Tongo, 2019).
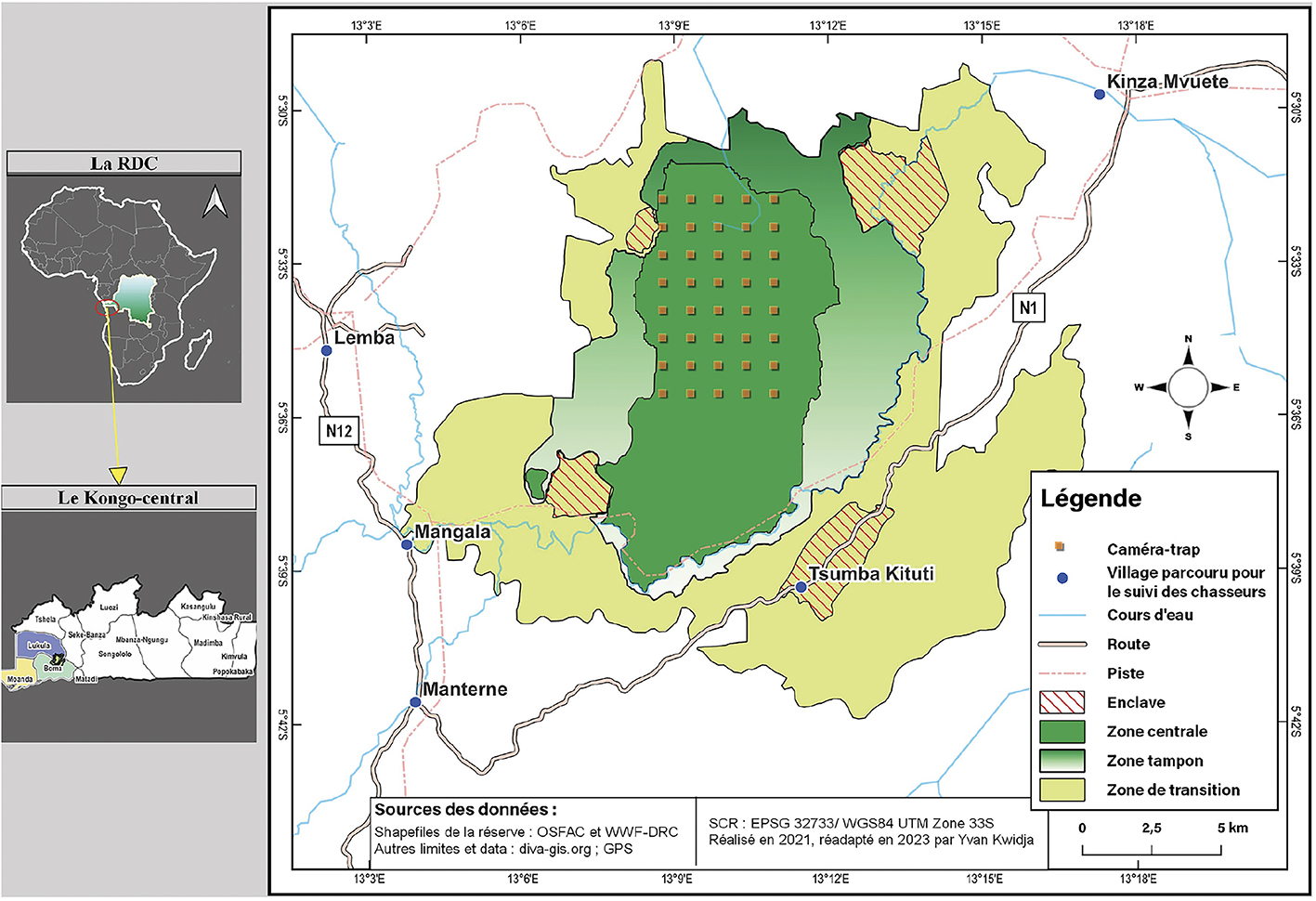
Figure 1. Situation de la Réserve de Biosphère de Luki et zonage interne. Les cinq villages enquêtés pour le suivi des prélèvements de chasse ainsi que la grille d’inventaire composée de 40 pièges photographiques dans la zone centrale sont indiqués — Luki Biosphere Reserve and internal zonation. The five villages integrated in the hunting offtake monitoring and the survey grid of 40 camera traps in the central zone are displayed.
2.2. Collecte des données
6Dans le cadre de cette étude, les données ont été collectées d’une part par un inventaire par pièges photographiques et, d’autre part, par une enquête de suivi des prélèvements de chasse. Ces deux enquêtes réalisées dans la même zone avaient pour finalité l’analyse de la diversité des espèces et de l’état de conservation de la communauté animale.
7En ce qui concerne l’inventaire par pièges photographiques, les données ont été collectées du 24 novembre 2020 au 27 février 2021. La zone d’échantillonnage a été sélectionnée et positionnée a priori selon les relevés d’indices de présences animales rapportés par une précédente étude (Mbende et al., 2016). Ces informations ont permis de produire de manière participative (avec les écogardes de la réserve) et à l’aide du logiciel QGIS, une grille systématique de 40 points d'échantillonnage déployée le long du gradient altitudinal de la zone centrale de la réserve. La grille d’échantillonnage couvre une surface de 32 km² avec une densité d’installation d’un piège photographique par km² (Figure 1), suivant les recommandations d’échantillonnage proposées par le protocole TEAM (Tropical Ecology Assessment and Monitoring, Jansen et al., 2014). Chaque piège photographique (Bolyguard SG 2060X, Boly, Victoriaville, QC, Canada) a été paramétré pour fonctionner en continu et enregistrer des vidéos de 5 secondes sans délai de redéclenchement. L’option LED (light-emitting diode) infrarouge a été activée afin de fournir un éclairage suffisant pendant la nuit ou en condition de moindre visibilité. Les 40 pièges photographiques ont été orientés vers les pistes animales selon les recommandations du protocole TEAM et de précédents travaux (Fonteyn et al., 2021a).
8Par ailleurs, afin de dresser le tableau des populations animales chassées dans la zone d’étude, un suivi des prélèvements de chasse a également été entrepris du 6 juillet au 15 septembre 2021 dans cinq villages autour de la réserve (Lemba, Mangala, Kinzau-Mvuete, Tsumba Kituti et Manterne) (Figure 1). Les enquêtes se sont déroulées en langues locales (Kiyombe, Kikongo et Lingala). L’enquête a concerné 50 chasseurs (10 par village). Pour assurer un suivi rapproché des chasseurs, un enquêteur a été commis dans chaque village étudié. Le consentement des chasseurs a été obtenu préalablement via une démarche CLIP (Perram & Nounah, 2019). Le nombre de sorties de chasse et leur durée ont été enregistrés. Pour chaque sortie, les données collectées concernaient notamment les espèces prélevées, le nombre d’individus par espèce et la biomasse en poids vif de chaque animal capturé. La biomasse a été mesurée à l’aide d’un peson. Les données collectées ont été par la suite enregistrées sur la plateforme Kobotoolbox pour faciliter le dépouillement (www.kobotoolbox.org).
2.3. Traitement et analyse des données
9Les vidéos ont été visualisées à partir du logiciel Timelapse 2.2.4.2 (Greenberg et al., 2019) en vue d’identifier les espèces animales capturées. Cet exercice a été effectué en suivant la nomenclature et le support d’identification proposés par Kingdon (2015), ainsi que la clé de reconnaissance visuelle adaptée aux pièges photographiques proposée par Fonteyn et al. (2021b).
10Les espèces morphologiquement proches et difficilement distinguables ont été groupées en complexe d’espèces :
11– le complexe d'espèces « mangoustes » englobant la mangouste à long nez (Herpestes naso) et la mangouste des marais (Atilax paludinosus) ;
12– les « petits pangolins », incluant le pangolin à longue queue (Phataginus tetradactyla) et le pangolin à ventre blanc (Phataginus tricuspis) ;
13– le complexe des « Galagos nains » (Galagoïdes demidoff, Galagoïdes thomasi) ;
14– les genettes (Genetta spp.) ;
15– le groupe des écureuils de forêt comprenant deux genres (Funisciurus spp. et Protexerus spp.).
16Suivant Francis & Barrett (2008), nous avons classifié en « petit », « moyen » ou « grand » mammifère toute espèce dont le poids est strictement inférieur à 2 kg, compris entre 2 et 15 kg ou strictement supérieur à 15 kg.
17Les détections successives d’une même espèce séparées de plus de 30 min ont été considérées comme indépendantes, un seuil d’indépendance communément utilisé dans ce type d’étude (Tobler et al., 2008 ; Meek et al., 2014). L’application EurêCam (Fonteyn et al., 2021b) a ensuite été utilisée pour calculer un taux de détection espèce par espèce. Le taux de détection représente le ratio entre le nombre total de détections indépendantes d’une espèce et l’effort d’inventaire mesuré en nombre consécutif de jours d’inventaire, appelé caméra.jour (Jenks et al., 2011). Les taux de détection spécifique sont souvent assimilés à des indices d'abondance relative (IAR) (Zurkinden, 2017 ; Palmer et al., 2018). Cependant, cet indice ne tient pas compte du biais potentiel résultant de la détection imparfaite des espèces lors des inventaires par pièges photographiques (Sollmann et al., 2013). En effet, outre l'abondance locale des espèces, une série de facteurs peuvent affecter la détectabilité des espèces, notamment le comportement et la biomasse des espèces, les caractéristiques du sous-bois et la méthodologie (Lijun et al., 2019). Cela introduit une détection imparfaite des espèces qui rend cet indice plus comparable à un prédicteur de l'utilisation des micro-habitats échantillonnés par le piège photographique qu'à un réel proxy de l'abondance des espèces (Broadley et al., 2019 ; Hofmeester et al., 2019).
18Les données de prélèvements de chasse ont permis de dresser la composition des tableaux de chasse dans la zone d’étude et de calculer la fraction entre biomasse chassée d’espèces de petite taille (< 2 kg) et celles de grande taille (> 15 kg), et la composition spécifique. Les analyses ont été réalisées avec le Logiciel R (R Core Team, 2020).
3. Résultats
3.1. Relevés par pièges photographiques
19Effort d’inventaire. Sur les 40 pièges photographiques initialement déployés dans la zone centrale de la RBL, 37 appareils ont pu être récupérés et analysés, les 3 autres ayant été volés. Chaque piège photographique a fonctionné en moyenne 86 jours, totalisant 2 383 détections indépendantes pour un effort total de 3 196 jours d’inventaire cumulés, supérieur au seuil minimal généralement recommandé de 1 000 jours d’inventaire cumulés (O’Brien et al., 2010).
20Cet inventaire peut être considéré comme exhaustif dans la mesure où la courbe de raréfaction des espèces (Figure 2) atteint un plateau. Cela suggère que le dispositif a enregistré la plupart des espèces fréquentant la zone d’étude. De plus, il faut consentir un effort d’inventaire supplémentaire considérable à partir de 1 000 jours d’inventaire pour détecter une nouvelle espèce.
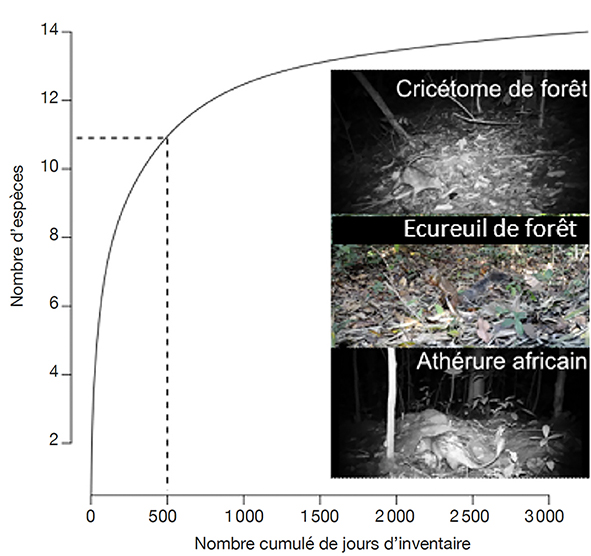
Figure 2. Courbe de raréfaction du nombre d’espèces de mammifères observés en fonction de l’effort d’échantillonnage exprimé en nombre cumulé de jours d’inventaire dans la zone centrale de la Réserve de Biosphère de Luki — Rarefaction curve of the number of mammal species observed as a function of the camera trapping effort in the central zone of the Luki Biosphere Reserve.
21Diversité des espèces et taux de détection spécifique. Au total, 14 taxons ont été identifiés, regroupés en 16 genres et appartenant à 12 familles et 5 ordres (Tableau 1). À l’exception des chimpanzés (Pan troglotydes troglotydes) et de deux espèces de céphalophes (Cephalophus dorsalis & Philatomba monticola), presque aucune autre espèce de moyenne et de grande taille n’a été enregistrée dans le noyau central de la RBL.
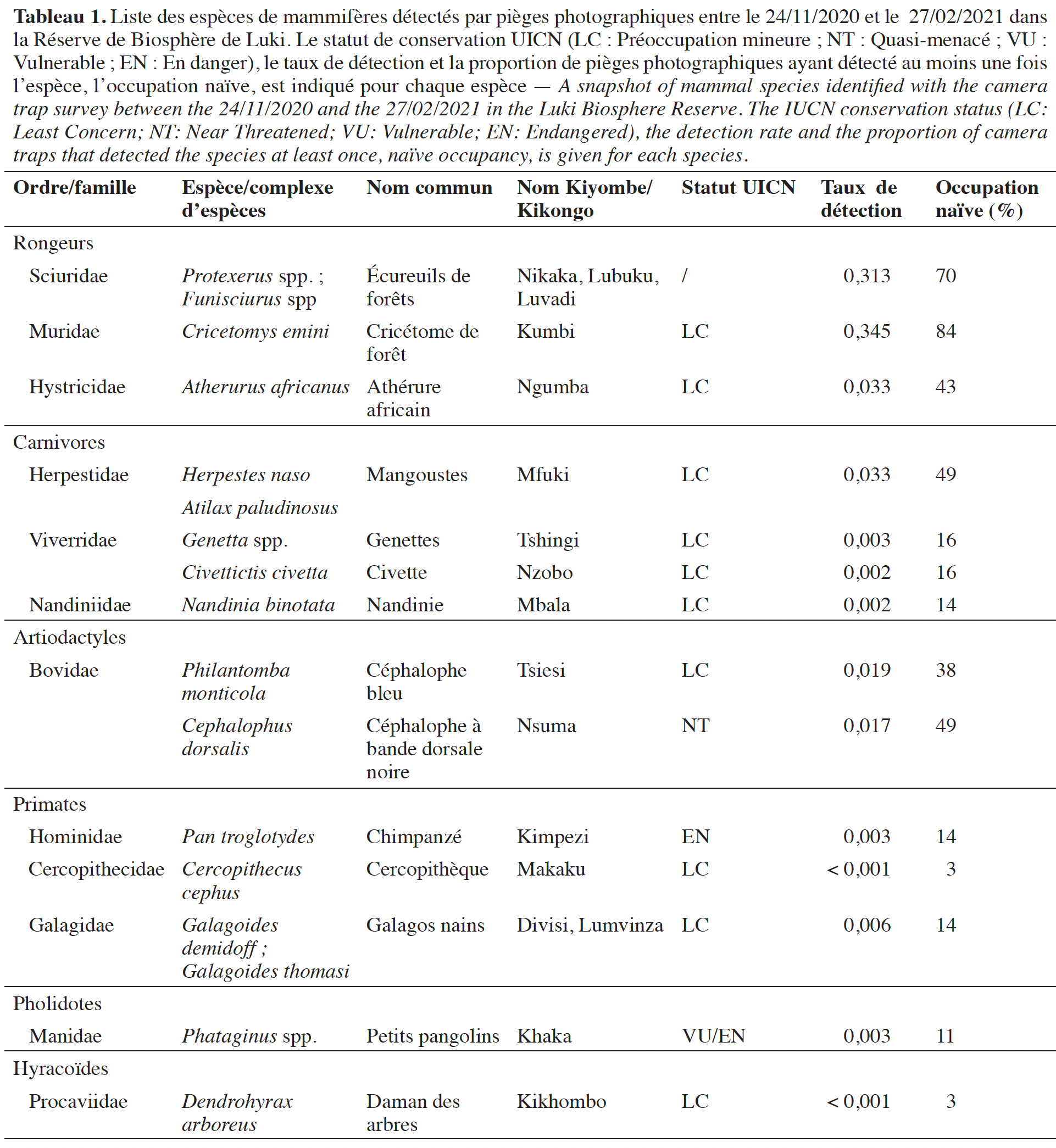
22Les taux de détection par ordre se classent comme suit : Rongeurs (RAI ≈ 0,692 détection indépendante par jour d’inventaire) - Carnivores (RAI ≈ 0,040) - Artiodactyles (RAI ≈ 0,036) - Primates (RAI ≈ 0,009) - Pholidotes (RAI ≈ 0,003). Les rongeurs sont donc les espèces les plus fréquemment détectées dans la zone d’étude. Les espèces de taille moyenne (entre 2-15 kg) encore présentes (comme le céphalophe bleu et le céphalophe à bande dorsale noire) présentent quant à elles de très faibles taux de détection. Par ailleurs, nous avons testé l’effet du pas de temps choisi entre deux évènements photographiques indépendants sur les taux de détection. Quel que soit le pas de temps considéré pour fixer le seuil d’indépendance (30 min, 2 h, 6 h ou 12 h), l’ordre des espèces (des plus fortement détectées au plus faiblement détectées) ne change pas, les rongeurs restant les espèces/groupe d’espèces les plus fortement détectés.
3.2. Espèces chassées et biomasse
23Les cinquante chasseurs suivis ont prélevé 487 individus appartenant à 18 espèces de mammifères pendant les 63 jours d’enquête (Tableau 2). Parmi ces espèces, les rongeurs apparaissent comme l’ordre le plus chassé, avec 326 individus prélevés pour 5 espèces, soit 66,9 % des prélèvements enregistrés. La biomasse totale prélevée est de 2 156,6 kg, les rongeurs représentant 53,2 % du poids total. L’espèce la plus capturée est le grand aulacode (Thryonomys swinderianus). Chez les carnivores, l’espèce la plus chassée en termes d’effectifs et de biomasse est la civette (Civettictis civetta) avec 31 individus prélevés et du côté des artiodactyles, c’est le céphalophe bleu (Philantomba monticola) avec seulement 10 individus prélevés. Les espèces de grandes tailles (˃ 15 kg), les sitatunga et les guibs harnachés (Tragelaphus scriptus et Tragelaphus spekii) sont très faiblement capturés (1,2 % du nombre total d’individus prélevés).
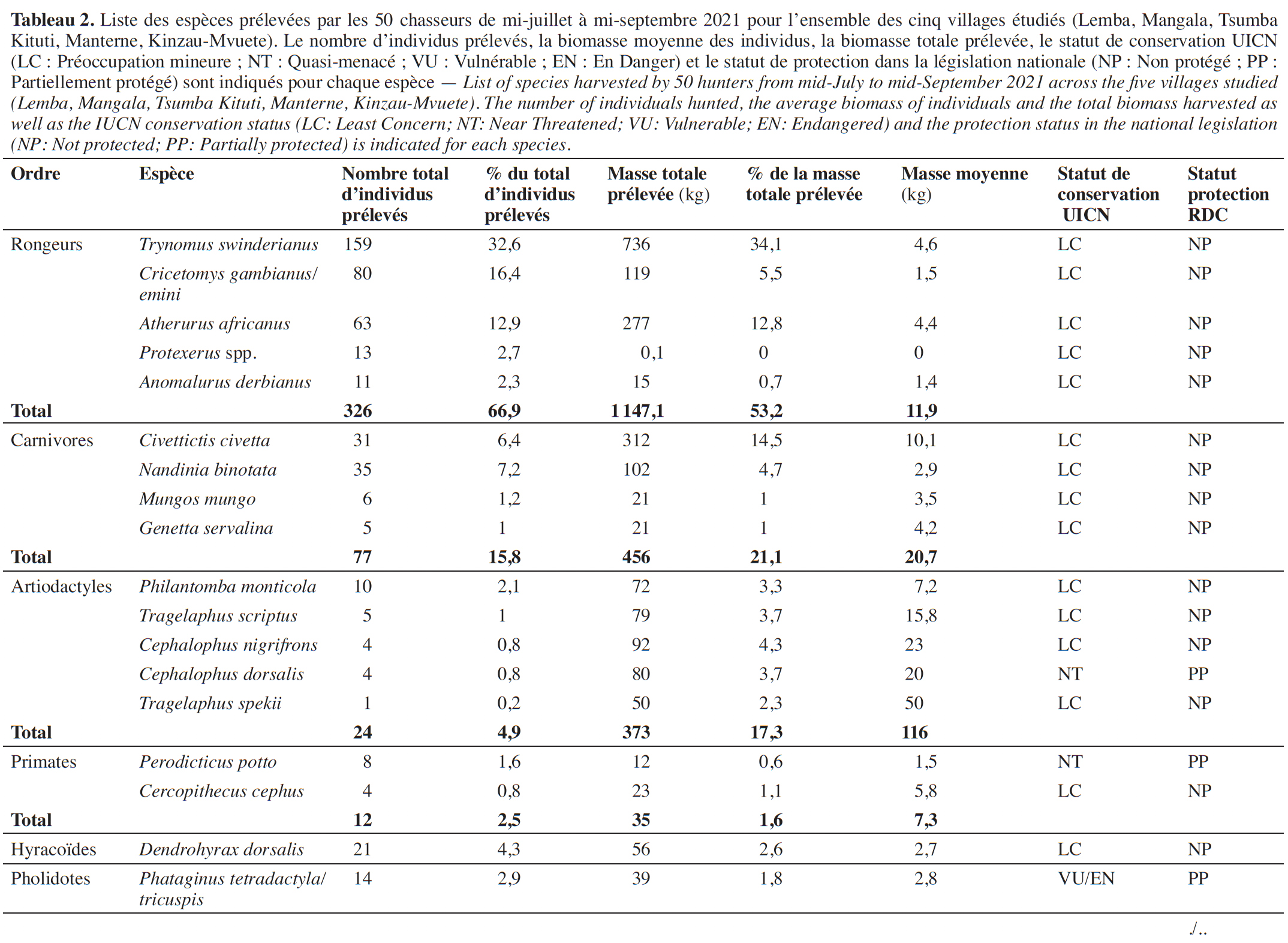
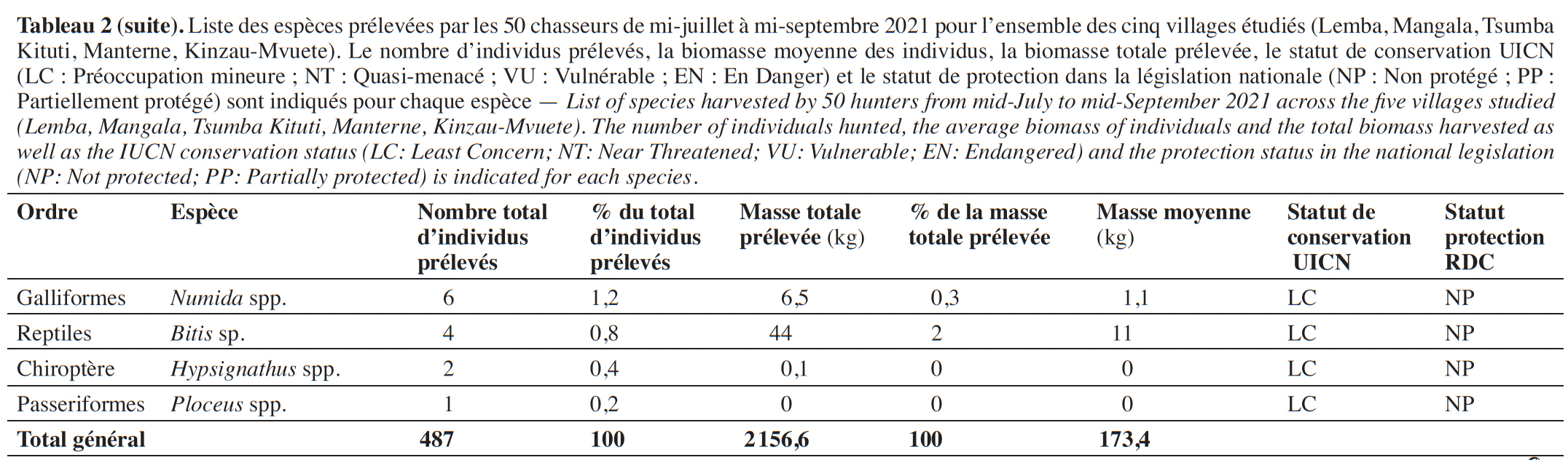
24Enfin, la fraction entre la biomasse chassée d’espèces de petite taille (< 2 kg) et celles de grande taille (> 15 kg) est de 8,96, suggérant un appauvrissement des populations d’espèces de grande taille au sein des terroirs de chasse suivis.
4. Discussion
4.1. État de la communauté animale de la RBL exprimée à travers la diversité des espèces
25Cette étude nous permet d’apprécier pour la première fois l’état de conservation de la communauté mammalienne de la Réserve de Biosphère de Luki dans un contexte de pression de chasse importante. Au moins 14 taxons de mammifères ont été recensés par pièges photographiques et 18 espèces de mammifères ont été identifiées à travers le suivi participatif des chasseurs, dévoilant des similarités en termes de diversité spécifique, mais également des différences notables. Dans le groupe des carnivores, la mangouste rayée (Mungos mungo) a été seulement relevée lors du suivi des chasseurs. De même, dans le groupe des artiodactyles, le tableau de chasse affiche trois espèces supplémentaires (Tragelaphus scriptus, Cephalophus nigrifrons, Tragelaphus spekii) qui n’ont pas été détectées par les pièges photographiques. La comparaison de ces deux listes d’espèces montre toute la complémentarité entre les deux approches adoptées pour établir une liste des mammifères encore présents dans la réserve la plus exhaustive possible.
26Enganga (2015) et Mbende et al. (2016) avaient identifié à partir d’indices indirects la présence de six espèces de mammifères sur le site d’étude : Pan troglotydes verus, Cephalophus dorsalis, Genetta sp., Cephalophus nigrifrons et Potamochoerus larvatus. Cette étude a permis de confirmer la présence de cinq d’entre elles, le potamochère du Cap (Potamochoerus larvatus) n’ayant été détecté par aucune des deux méthodes de suivi, ce qui pourrait indiquer une extinction locale. Dans l’ensemble, les espèces identifiées (Tableaux 1 et 2) par l’une ou l’autre méthode sont des espèces pour la plupart généralistes, peu menacées (Sandrin et al., 2014) et indicatrices de milieux perturbés. Selon leur statut de conservation de l’UICN, elles sont dans la plupart des cas à « préoccupation mineure », à l’exception du chimpanzé (Pan troglotydes troglotydes), des petits pangolins (Phataginus spp.) qui sont en danger (EN) (IUCN, 2021) et du céphalophe à bande dorsale noire (Cephalophus dorsalis) qui est quasi-menacé. L’observation des chimpanzés, espèce en danger et menacée d’extinction, démontre la nécessité de renforcer les mécanismes de gestion de la RBL pour garantir la protection des derniers groupes encore présents dans cette partie densément peuplée du pays (Nyange, 2014) afin d’éviter l’extinction locale définitive de cette dernière population relictuelle.
27La diversité des espèces observée dans la présente étude est similaire à celle obtenue par Sandrin et al. (2014) dans le village de Phalanga-Mbuda situé à 80 km au nord de la RBL. Les auteurs y ont enregistré la plupart des espèces identifiées dans cette étude et, notamment, une grande diversité de petits rongeurs, ce qui signifierait que la Réserve de Luki préserve aujourd’hui les mêmes espèces qu’au sein de terroirs villageois non protégés. Par ailleurs, dans l’étude de Sandrin et al. (2014), les céphalophes rouges ont été plus souvent observés que les céphalophes bleus, à l’inverse de notre étude où, au sein des artiodactyles, les céphalophes bleus sont à la fois les plus observés et les plus prélevés. L’appartenance de ces territoires à un même paysage et une connectivité entre leurs écosystèmes à partir de corridors écologiques (Vautravers, 2008 ; Tamar, 2012) expliquerait en partie leur similarité en termes de diversité faunique. Notons que Sandrin et al. (2014) ont pu identifier une seule espèce de primate (Cercopithecus cephus), contrairement à cette étude qui a révélé la présence de trois espèces (Perodicticus potto, Pan troglotydes verus et Cercopithecus cephus), alors que le protocole d’inventaire n’était pas adapté à la détection des primates arboricoles.
4.2. Défaunation en moyens et grands mammifères
28Le suivi par pièges photographiques révèle une prédominance marquée des petits mammifères (˂ 2 kg) et, notamment, des rongeurs qui constituent l’ordre le plus fortement détecté (86,4 % des détections indépendantes) dans la zone d’étude, corroborant les résultats déjà obtenus à Phalanga-Mbuda par Sandrin et al. (2014). Cette dominance des rongeurs se retrouve également dans les tableaux de chasse où on constate un taux de capture élevé des rongeurs (66,8 %) par rapport aux autres groupes d’animaux. Ces résultats confirment l’importante diminution des moyens et grands mammifères, en grande partie imputable à la chasse, les chasseurs ayant tendance à extraire prioritairement les espèces de grande taille (Poulsen et al., 2011 ; Hegerl et al., 2017). Cette tendance s’exprime aussi dans la part de biomasse totale imputable aux petits mammifères qui dépasse largement l’unité, un seuil charnière proposé par Van Vliet et al. (2017b) comme indicateur d’une forte réduction des espèces de grande taille sur le terroir de chasse.
29En analysant la composition et la distribution des populations des rongeurs en relation avec l’hétérogénéité des habitats dans un écosystème anthropisé de la Réserve Forestière de Masako, Mongo et al. (2012) ont conclu que la diversité et l’abondance des rongeurs sont plus importantes dans des zones de transition entre la forêt secondaire et des terres cultivables non exploitées, et moindres en forêt non dégradée. Cette situation s’observe également dans la RBL où la matrice forestière naturelle (Lubini, 1997), sous l’effet accentué des activités humaines (Cizungu et al., 2021), s’est dégradée au fil des années et s’est transformée en une mosaïque d’habitats d’origine anthropique (Opelele et al., 2021). Ce processus de dégradation combiné à la chasse aurait favorisé l'émergence de guildes particulières de mammifères comme les rongeurs (écureuils, rats, athérure africain,…) dans la réserve. Comparée à d’autres aires protégées d’Afrique centrale étudiées avec des dispositifs et des taux d’échantillonnages comparables (Nyenty Achare et al., 2016 ; Bruce et al., 2018 ; Hedwig et al., 2018), la réserve de Biosphère de Luki apparait bien pauvre, en termes de diversité des espèces, avec des taux de détection des espèces de moyenne et grande taille très faibles. Si rien n’est engagé pour sa protection efficace, cette aire protégée pourra bientôt être considérée comme « La réserve aux souris du Mayombe ». Cet alarmant constat sur l’état de la faune, qui fait suite à ceux relatifs à la dégradation avancée de la végétation (Opelele et al., 2021), questionne indirectement deux décennies de gestion participative de la réserve (Nyange, 2014) qui semble ne pas avoir porté ses fruits en termes de conservation et dont l’évaluation semble également urgente.
5. Conclusions
30La présente étude a fourni des informations actualisées sur l’état des populations mammaliennes présentes dans la Réserve de Biosphère de Luki. Les résultats ont révélé que la communauté de mammifères y est peu diversifiée. La plupart des espèces observées sont des rongeurs qui constituent en toute logique les proies les plus fréquemment chassées. Les artiodactyles sont très peu observés, de même que les carnivores. Les résultats de cette étude indiquent que la RBL est un site fortement anthropisé dans lequel les populations de grands et moyens mammifères semblent avoir connu soit un sévère déclin, soit des extinctions locales. Même si des espèces telles que le chimpanzé, d'un grand intérêt pour la conservation et l’écotourisme, ont été détectées, leur très faible détection renseigne de leur progressive disparition. Par ailleurs, en tant qu’espèce en danger et menacée d’extinction, l’observation du chimpanzé au sein de la RBL démontre la nécessité de renforcer les mécanismes de gestion de la réserve pour garantir la protection des derniers groupes encore présents dans cette partie densément peuplée du pays afin d’éviter une extinction locale de cette dernière population relictuelle. La situation est critique et fort de ces constats, il y a donc urgence d’accroître l’effort de conservation en mettant en place une surveillance efficace de la zone noyau, de limiter la chasse dans la zone agricole périphérique, de développer des activités génératrices de revenus qui répondent aux besoins réels des populations locales et, enfin, de mettre en place un suivi régulier des populations animales afin d’évaluer les effets de ces différentes mesures.
Remerciements
31Cette étude a été réalisée dans le cadre du projet « Renforcement de la résilience au changement climatique des communautés locales de Luki et du Maï-Ndombe en RDC », financé par l’Union européenne et cogéré par WWF-RDC et l’ERAIFT. Les bourses d’études d’Yvan Kwidja Djami et de Mvuezolo Nyimi Meeys ont été financées par la GIZ. Nos remerciements chaleureux s’adressent notamment au Pr. Baudouin Michel, Directeur de l’ERAIFT et au Pr. Jean-Pierre MATE pour toutes les ressources mobilisées pour la bonne réalisation de cette étude. Nous remercions les écogardes de la Réserve de Biosphère de Luki et les populations des villages périphériques pour leur collaboration lors des travaux de terrain. Nous adressons enfin nos sincères remerciements à tous ceux qui ont relu ce document et contribué à son amélioration.
Bibliographie
Ahumada J.A. et al., 2011. Community structure and diversity of tropical forest mammals : data from a global camera trap network. Phil. Trans. R. Soc. B, 366(1578), 2703‑2711, doi.org/10.1098/rstb.2011.0115
Ahumada J.A., Hurtado J. & Lizcano D., 2013. Monitoring the status and trends of tropical forest terrestrial vertebrate communities from camera trap data : a tool for conservation. PloS one, 8(9), e73707, doi.org/10.1371/journal.pone.0073707
Albrechtsen L. et al., 2007. Faunal loss from bushmeat hunting : empirical evidence and policy implications in Bioko Island. Environ. Sci. Policy, 10(7), 654‑667, doi.org/10.1016/j.envsci.2007.04.007
Alempijevic D., Hart J.A., Hart T.B. & Detwiler K.M., 2021. Using local knowledge and camera traps to investigate occurrence and habitat preference of an endangered primate : the endemic dryas monkey in the Democratic Republic of the Congo. Oryx, 56(2), 260-267, doi.org/10.1017/s0030605320000575
Amin R. et al., 2022. Estimating forest antelope population densities using distance sampling with camera traps. Oryx, 56(3), 345-351, doi.org/10.1017/S0030605320001209
Avila E. et al., 2019. Interpreting long-term trends in bushmeat harvest in southeast Cameroon. Acta Oecol., 94, 57‑65, doi.org/10.1016/j.actao.2017.09.007
Bessone M. et al., 2020. Drawn out of the shadows : surveying secretive forest species with camera trap distance sampling. J. Appl. Ecol., 57(5), 963‑974, doi.org/10.1111/1365-2664.13602
Bousquet F., Le Page C., Bakam I. & Takforyan A., 2001. Multiagent simulations of hunting wild meat in a village in eastern Cameroon. Ecol. Modell., 138(1‑3), 331‑346, doi.org/10.1016/s0304-3800(00)00412-9
Bowler M.T. et al., 2017. Estimating mammalian species richness and occupancy in tropical forest canopies with arboreal camera traps. Remote Sens. Ecol. Conserv., 3(3), 146‑157, doi.org/10.1002/rse2.35
Broadley K., Burton A.C., Avgar T. & Boutin S., 2019. Density-dependent space use affects interpretation of camera trap detection rates. Ecol. Evol., 9(24), 14031‑14041, doi.org/10.1002/ece3.5840
Bruce T. et al., 2018. Using camera trap data to characterise terrestrial larger‐bodied mammal communities in different management sectors of the Dja Faunal Reserve, Cameroon. Afr. J. Ecol., 56(4), 759‑776, doi.org/10.1111/aje.12574
Cappelle N., Bitty E.A., Normand E. & Kablan Y.A., 2020. Détermination par caméra piège des périodes d’activité de quelques mammifères terrestres au Parc National de Taï. Int. J. Biol. Chem. Sci., 14(5), 1673‑1688, doi.org/10.4314/ijbcs.v14i5.15
Cappelle N., Howe E.J., Boesch C. & Kühl H.S., 2021. Estimating animal abundance and effort–precision relationship with camera trap distance sampling. Ecosphere, 12(1), e03299, doi.org/10.1002/ecs2.3299
Cazalis V., 2020. Efficacité des aires protégées : la pierre angulaire de la conservation de la biodiversité permet-elle réellement de protéger la nature ? Thèse de doctorat : Université de Montpellier (France).
Cizungu N.C. et al., 2021. Fire risk assessment, spatiotemporal clustering and hotspot analysis in the Luki biosphere reserve region, Western DR Congo. Trees For. People, 100104, doi.org/10.1016/j.tfp.2021.100104
Davies G., Schulte‐Herbrüggen B., Kümpel N.F. & Mendelson S., 2007. Hunting and trapping in Gola Forests, South‐Eastern Sierra Leone : bushmeat from farm, fallow and forest. In: Davies G. & Brown D., eds. Bushmeat and Livelihoods: Wildlife Management and Poverty Reduction, 15‑31, doi.org/10.1002/9780470692592.ch1
Debata S. & Swain K.K., 2018. Estimating mammalian diversity and relative abundance using camera traps in a tropical deciduous forest of Kuldiha Wildlife Sanctuary, eastern India. Mammal Study, 43(1), 45‑53, doi.org/10.3106/ms2017-0078
Delvingt W., Dethier M., Auzel P. & Jeanmart P., 2001. La chasse villageoise Badjoué, gestion coutumière durable ou pillage de la ressource gibier. In : Delvingt W., ed. La forêt des hommes : terroirs villageois en forêt tropicale africaine. Gembloux, Belgique : Les Presses Agronomiques de Gembloux, 65‑92.
Enganga P., 2015. Rapport de la mission de suivi des grands singes et autres grands mammifères dans la partie nord-est de la Réserve de Biosphère de Luki axe de Lusanga. Rapport de mission. Kinshasa : WWF-RDC.
Fa J.E. & Yuste J.G., 2001. Commercial bushmeat hunting in the Monte Mitra forests, Equatorial Guinea : extent and impact. Anim. Biodivers. Conserv., 24(1), 31‑52.
Fa J.E., Peres C.A. & Meeuwig J., 2002. Bushmeat exploitation in tropical forests : an intercontinental comparison. Conserv. Biol., 16(1), 232‑237, doi.org/10.1046/j.1523-1739.2002.00275.x
Fargeot C., 2013. La chasse commerciale en Afrique centrale : une menace pour la biodiversité ou une activité économique durable ? Le cas de la République centrafricaine. Thèse de doctorat : Université Paul Valéry-Montpellier 3 (France).
Fayolle A. et al., 2014. Patterns of tree species composition across tropical African forests. J. Biogeogr., 41(12), 2320‑2331.
Foley C. et al., 2018. An assessment of mammal diversity and abundance in Makame Wildlife Management Area (WMA) by camera trap survey. Arusha, Tanz anie: Wildlife Conservation Society.
Fonteyn D. et al., 2021a. Wildlife trail or systematic ? Camera trap placement has little effect on estimates of mammal diversity in a tropical forest in Gabon. Remote Sens. Ecol. Conserv., 7(2), 321‑336, doi.org/10.1002/rse2.191
Fonteyn D. et al., 2021b. FauneFAC : boite à outils méthodologique pour la mise en place d’inventaires par pièges photographiques. Gembloux, Belgique : ULiège – Gembloux Agro-Bio Tech, PPECF, https://www.gembloux.ulg.ac.be/faunefac/, (22/08/2023).
Francis C.M. & Barrett P., 2008. Guide to the mammals of Southeast Asia. Princeton, NJ, USA: Princeton University Press.
Froese G.Z.L. et al., 2022. Coupling paraecology and hunter GPS self-follows to quantify village bushmeat hunting dynamics across the landscape scale. Afr. J. Ecol., 60(2), 229‑249, doi.org/10.1111/aje.12956
Gaugris J. et al., 2021. A snapshot camera trap assessment of mammals in Congo’s Massif du Chaillu with a noteworthy record of grey‐necked rockfowl Picathartes oreas. Afr. J. Ecol., 59(3), 749-754, doi.org/10.1111/aje.12883
Gilbert N.A., Clare J.D., Stenglein J.L. & Zuckerberg B., 2021. Abundance estimation of unmarked animals based on camera‐trap data. Conserv. Biol., 35(1), 88‑100, doi.org/10.1111/cobi.13517
Greenberg S., Godin T. & Whittington J., 2019. Design patterns for wildlife‐related camera trap image analysis. Ecol. Evol., 9(24), 13706‑13730, doi.org/10.1002/ece3.5767
Haurez B. et al., 2020. Élaboration et mise en oeuvre d’un plan de gestion de la faune. Guide technique à destination des gestionnaires des forêts de production d’Afrique centrale. Gembloux, Belgique : Les Presses agronomiques de Gembloux, https://orbi.uliege.be/handle/2268/253115, (22/08/2023).
Hedwig D. et al., 2018. A camera trap assessment of the forest mammal community within the transitional savannah‐forest mosaic of the Batéké Plateau National Park, Gabon. Afr. J. Ecol., 56(4), 777‑790, doi.org/10.1111/aje.12497
Hegerl C. et al., 2017. Using camera trap data to assess the impact of bushmeat hunting on forest mammals in Tanzania. Oryx, 51(1), 87‑97, doi.org/10.1017/s0030605315000836
Hette S., 2018. Quantification de la viande de brousse prélevée et consommée dans trois villages du sud-est du Cameroun. Thèse de master : ULg-Gembloux Agro-Bio Tech (Belgique), https://matheo.uliege.be/handle/2268.2/5103, (22/08/2023).
Hodgson J.C. et al., 2018. Drones count wildlife more accurately and precisely than humans. Methods Ecol. Evol., 9(5), 1160‑1167, doi.org/10.1111/2041-210x.12974
Hofmeester T.R. et al., 2019. Framing pictures : a conceptual framework to identify and correct for biases in detection probability of camera traps enabling multi-species comparison. Ecol. Evol., 9(4), 2320‑2336, doi.org/10.1002/ece3.4878
Hongo S. et al., 2020. Use of multi-layer camera trapping to inventory mammals in rainforests in southeast Cameroon. Afr. Study Monogr., Suppl.(60), 21‑37.
Howe E.J., Buckland S.T., Després‐Einspenner M.-L. & Kühl H.S., 2017. Distance sampling with camera traps. Methods Ecol. Evol., 8(11), 1558‑1565, doi.org/10.1111/2041-210X.12790
Jansen P.A., Ahumada J., Fegraus E. & O’Brien T., 2014. TEAM: a standardised camera trap survey to monitor terrestrial vertebrate communities in tropical forests. In: Fleming P. et al. Camera trapping: wildlife management and research. Collingwood, Australia: Csiro Publishing, 263‑270.
Jenks K.E. et al., 2011. Using relative abundance indices from camera-trapping to test wildlife conservation hypotheses–an example from Khao Yai National Park, Thailand. Trop. Conserv. Sci., 4(2), 113‑131, doi.org/10.1177/194008291100400203
Kingdon J., 2015. The Kingdon field guide to African mammals. London: Bloomsbury Publishing.
Lijun C., Wenhong X. & Zhishu X., 2019. Limitations of relative abundance indices calculated from camera-trapping data. Biodivers. Sci., 27(3), 243, doi.org/10.17520/biods.2018327
Linchant J., Lejeune P. & Vermeulen C., 2017. Les drones voleront-ils au secours de la faune menacée de la RDC ? Rev. Fr. Photogrammétrie Télédétection, 213, 153‑159, doi.org/10.52638/rfpt.2017.195
Lubalega T.K. & Mananga P.M., 2018. Évaluation de la biodiversité spécifique ligneuse des cultures agricoles sous couvert arboré à Patu, dans le Mayombe, en République démocratique du Congo (RDC). Congo Sci., 6, 1‑8.
Lubini A., 1997. La végétation de la Réserve de Biosphère de Luki au Mayombe (Zaïre). Meise, Belgique : Jardin Botanique National de Belgique.
Mangaza L. et al., 2022. Impacts du changement d’utilisation des terres sur la biomasse et la diversité dans le paysage forestier de la réserve de biosphère de Yangambi en République démocratique du Congo. Bois For. Trop., 353, 61-73, doi.org/10.19182/bft2022.353.a36836
Mbende M. et al., 2016. Inventaires biologiques dans la Réserve de Biosphère de Luki (Rapport de mission No 1). Kinshasa : WWF-RDC.
Mbete R.A. et al., 2011. Profil des vendeurs de viande de chasse et évaluation de la biomasse commercialisée dans les marchés municipaux de Brazzaville, Congo. Trop. Conserv. Sci., 4(2), 203‑217.
Meek P.D. et al., 2014. Recommended guiding principles for reporting on camera trapping research. Biodivers. Conserv., 23(9), 2321‑2343, doi.org/10.1007/s10531-014-0712-8
Moller H., Berkes F., Lyver P.O. & Kislalioglu M., 2004. Combining science and traditional ecological knowledge : monitoring populations for co-management. Ecol. Soc., 9(3), doi.org/10.5751/ES-00675-090302
Mongo L.I.W. et al., 2012. Anthropisation et effets de lisière : impacts sur la diversité des rongeurs dans la Réserve Forestière de Masako (Kisangani, RD Congo). Trop. Conserv. Sci., 5(3), 270‑283, doi.org/10.1177/194008291200500304
Nyange N.M., 2014. Participation des communautés locales et gestion durable des forêts : cas de la Réserve de la biosphère de Luki en République Démocratique du Congo. Québec, Canada : Université Laval.
Nyenty Achare F., Tchamba M. & Etoga G., 2016. Survey of large and medium sized mammals at the Ikwa Bai and its periphery-Nki National Park, South East Cameroon. Master’s thesis: University of Dschang (Cameroon).
O’Brien T.G., 2011. Abundance, density and relative abundance: a conceptual framework. In: O’Connell A.F., Nichols J.D. & Karanth K.U., eds. Camera traps in animal ecology. Springer, 71‑96.
O’Brien T.G., Baillie J.E.M., Krueger L. & Cuke M., 2010. The wildlife picture index: monitoring top trophic levels. Anim. Conserv., 13(4), 335‑343, doi.org/10.1111/j.1469-1795.2010.00357.x
Opelele M. O. et al., 2021. Examining land use/land cover change and its prediction based on a multilayer perceptron markov approach in the Luki biosphere reserve, Democratic Republic of Congo. Sustainability, 13(12), 6898, doi.org/10.3390/su13126898
Palei H.S., Pradhan T., Sahu H.K. & Nayak A.K., 2016. Estimating mammalian abundance using camera traps in the tropical forest of Similipal Tiger Reserve, Odisha, India. Proc. Zool. Soc., 69(2), 181‑188, doi.org/10.1007/s12595-015-0143-x
Palla F., Le Bel S., Chavernac D. & Cornélis D., 2016. New technologies: mobile data collection system implication for wildlife management in Central Africa. Bussières, France: ATBC, http://agritrop.cirad.fr/582107/7/582107.pdf, (22/08/2023).
Palmer M.S. et al., 2018. Evaluating relative abundance indices for terrestrial herbivores from large‐scale camera trap surveys. Afr. J. Ecol., 56(4), 791‑803, doi.org/10.1111/aje.12566
Perram A. & Nounah S., 2019. De la coupe aux lèvres : le CLIP dans la Réserve de faune de Ngoyla au Cameroun. [Rapport d’étude]. Moreton-in-Marsh, UK: Forest Peoples Programme, https://www.forestpeoples.org/fr/node/50394
Pettersson S., 2021. Can hunter’s local ecological knowledge be used in management of multi-ungulate systems? Master’s thesis: Swedish University of Agricultural Sciences, Uppsala (Sweden).
Poulsen J.R., Clark C.J. & Bolker B.M., 2011. Decoupling the effects of logging and hunting on an Afrotropical animal community. Ecol. Appl., 21(5), 1819‑1836, doi.org/10.1890/10-1083.1
R Core Team, 2020. R: A language and environment for statistical computing. Vienna: The R Foundation for Statistical Computing, https://www.R-project.org/, (22/08/2023).
Raghunathan N., Ansay F. & Nsenga L., 2013. Gestion participative des ressources naturelles dans les réserves de Biosphère. L'expérience du WWF dans les réserves de Luki, Yangambi (RDC) et Dimonika (République du Congo). Guide technique. Bruxelles : WWF Belgique.
Rieu L., 2004. Faune sauvage et exploitation forestière en Afrique Centrale : comprendre pour gérer durablement (Afrique centrale). Mémoire DESS : Université Montpellier 2 (France).
Rovero F. et al., 2014. Estimating species richness and modelling habitat preferences of tropical forest mammals from camera trap data. PloS one, 9(7), e103300, doi.org/10.1371/journal.pone.0103300
Sandrin F., Van Vliet N. & Delavaux J.-J., 2014. Réalisation d’un diagnostic faunistique au T0 d’un projet de gestion de la chasse. Cas du terroir de Phalanga, Bas Congo, RDC. Mémoire de master : École Supérieure d’Agro-Développement International (ISTOM), Angers (France).
Semeki N.J., Belani Masamba J., Ntoto M'Vubu R. & Vermeulen C., 2014. Consommation de produits d'origine animale dans la concession forestière 039/11 de la SODEFOR à Oshwe (R.D. Congo). Tropicultura, 32(3), 147-155, https://hdl.handle.net/2268/165265, (22/08/2023).
Semeki N.J. & Meyanga T.Y., 2019. Livelihoods means and local populations strategies of the Luki’s biosphere reserve in Democratic Republic of Congo. Int. J. Nat. Resour. Ecol. Manage., 4(2), 42‑49, doi.org/10.11648/j.ijnrem.20190402.12
Sollmann R., Mohamed A., Samejima H. & Wilting A., 2013. Risky business or simple solution – Relative abundance indices from camera-trapping. Biol. Conserv., 159, 405‑412, doi.org/10.1016/j.biocon.2012.12.025
Tamar R., 2012. Vers un complexe d’aires protégées transfrontalières dans la forêt du Mayombe. Ouagadougou : IUCN-PACO, https://portals.iucn.org/library/node/44737, (22/08/2023).
Tobler M.W. et al., 2008. An evaluation of camera traps for inventorying large‐ and medium‐sized terrestrial rainforest mammals. Anim. Conserv., 11(3), 169‑178, doi.org/10.1111/j.1469-1795.2008.00169.x
Tsakem S.C., Tchamba M.N. & Weladji R.B., 2014. Les gorilles du Parc National de Lobeke (Cameroun) : utilisation de l’habitat et implications pour la conservation. Parcs Réserves, 69(3), 15‑25.
Van Vliet N. et al., 2015. Diagnostic approfondi pour la mise en œuvre de la gestion communautaire de la chasse villageoise : guide pratique et exemples d’application en Afrique centrale (Vol. 183). Bogor, Indonésie : CIFOR.
Van Vliet N., Nguinguiri J.C., Cornelis D. & Le Bel S., 2017a. Communautés locales et utilisation durable de la faune en Afrique centrale. FAO/CIFOR/CIRAD, https://agritrop.cirad.fr/585183/1/ID585183.pdf, (22/08/2023).
Van Vliet N. et al., 2017b. Développement participatif d’un plan de gestion durable de la chasse villageoise : guide pratique et exemples d’application en Afrique centrale (Guide 2). Rome : FAO.
Van Vliet N. et al., 2023. Status of terrestrial mammals in the Yangambi Landscape, Democratic Republic of the Congo. Oryx, 1‑12, doi.org/10.1017/S0030605322001569
Vautravers E., 2008. Rapport de documentation et de consolidation des systèmes de production durable réalisés à la Réserve de Biosphère de Luki en République Démocratique du Congo. Gland, Suisse : WWF.
Verma A., van der Wal R. & Fischer A., 2016. Imagining wildlife: new technologies and animal censuses, maps and museums. Geoforum, 75, 75‑86, doi.org/10.1016/j.geoforum.2016.07.002
Wilkie D.S. et al., 2016. Eating and conserving bushmeat in Africa. Afr. J. Ecol., 54(4), 402‑414, doi.org/10.1111/aje.12392
Zurkinden D., 2017. Étude de l’abondance relative et de la structure d’une communauté de carnivores dans un écosystème de forêt sèche sur une base de données de pièges photographiques. Thèse de bachelor : Haute École du Paysage, d’Ingénierie et d’Architecture de Genève (Suisse).






