- Startpagina tijdschrift
- Volume 27 (2023)
- Numéro 4
- Identification de mycètes cultivables associés aux maladies de la tomate au Burkina Faso
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Identification de mycètes cultivables associés aux maladies de la tomate au Burkina Faso

Documenten bij dit artikel
Version PDF originaleRésumé
Description du sujet. La culture de tomate est confrontée à une forte pression parasitaire limitant son rendement. Parmi les agents pathogènes impliqués, de nombreux champignons sont décrits, mais peu ont été recensés jusqu’ici au Burkina Faso.
Objectifs. Identifier les agents pathogènes fongiques associés à la tomate en culture et/ou transmis par la graine.
Méthode. Les agents fongiques présents sur les échantillons de plantes malades ont été identifiés sur la base de caractéristiques morphologiques et moléculaires après isolement sur milieu de culture. Ceux associés à la semence ont été identifiés après incubation des graines en chambre humide et analyse de plantules après germination des graines.
Résultats. Trente-deux espèces fongiques ont été identifiées sur les échantillons de plantes malades et 11 à partir des semences, avec des prévalences variables. Les principales espèces fongiques observées sur les plantes malades collectées en champs ont été Fusarium oxysporum (Schltdl.) (66,4%), Colletotrichum sp. (27,4 %), Alternaria solani (Sorauer) (26,9 %), Alternaria sp. (27,5 %), Botrytis cinerea (Pers) (24,1 %) et Fusarium equiseti (Sacc.) (19,5 %). La présence de F. oxysporum et Cercospora kikuchii (Tak.) a été mise en évidence sur l’ensemble des 14 lots/variétés de graines analysées. Colletotrichum sp., Fusarium solani (Mart.) Sacc. et B. cinerea ont été détectés sur la plupart des variétés testées. Epicoccum sp. (Sacc.) a été le saprophyte le plus important aussi bien sur les semences (54,5 %) que sur les échantillons de plantes malades en culture (57,0 %).
Conclusions. La prévalence élevée de champignons pathogènes connus de la tomate sur les échantillons collectés en champs et sur les lots de graines invite à approfondir la caractérisation des espèces et souches en présence, développer des mesures de contrôle basées sur les connaissances épidémiologiques des espèces en présence, rechercher des moyens de contrôles biologiques et assurer une meilleure qualité sanitaire des semences utilisées au Burkina Faso pour limiter les pertes encourues en production.
Abstract
Identification of cultivable mycetes associated to tomato diseases in Burkina Faso
Description of the subject. Tomato is affected by various pests and pathogens, reducing its yield. To date, few studies have been conducted on fungal pathogens occurring on this crop in Burkina Faso.
Objectives. The present study aims to identify fungal pathogens associated with tomato, in fields or seed-transmitted.
Method. Fungal pathogens were identified after isolation from infected tissues on culture media or after incubation of seeds in a humid chamber, and by observation of seedlings resulting from seed germination.
Results. Thirty-two fungal species were identified from diseased plants and 11 from seeds, with variable prevalence. The most frequent fungal pathogenic species on diseased plants were Fusarium oxysporum (Schltdl.) (66.4%), Colletotrichum sp. (Schwein.) (27.4%), Alternaria solani (Ellis & Martin) Sorauer (26.9%), Alternaria sp. (Fr.) Keissl. (27.5%), Botrytis cinerea (Pers) (24.1%) and Fusarium equiseti (Corda) Sacc. (19.5%). The seed-borne pathogenic species detected on all varieties were F. oxysporum and Cercospora kikuchii (Tak. Matsumoto & Tomoy). Colletotrichum sp., Fusarium solani (Mart.) Sacc. and B. cinerea were detected in most varieties. Epicoccum sp. was the most important saprophyte both on seeds (54.5%) and on samples of diseased plants in culture (57%).
Conclusions. The high prevalence of known fungal pathogens in tomato samples collected in the field and on seed lots necessitates further characterization of the species and strains present. It also emphasizes the need for the development of control measures based on epidemiological knowledge of the species, and for research into biological control methods. This would ensure better sanitary quality of the seeds used in Burkina Faso in order to mitigate production losses.
Inhoudstafel
Reçu le 3 octobre 2022, accepté le 21 novembre 2023, mis en ligne le 14 décembre 2023
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
1. Introduction
1La tomate (Solanum lycopersicon L.) est l’une des espèces cultivées les plus importantes au monde. Au Burkina Faso, la tomate constitue le deuxième produit maraicher en termes de superficie (10 284 ha) et de production (167 400 t) après l’oignon (MAAH, 2020). Elle occupe la majorité des agriculteurs pendant la période sèche et génère des revenus substantiels pour les acteurs. La valeur totale des ventes nationales de la tomate est estimée en 2018 à plus de 78 milliards de F CFA (118 902 439 €), soit 21 % du chiffre d’affaires du maraichage (MAAH, 2020). Au Burkina Faso, la tomate est produite exclusivement en plein champ sur des sites maraichers d’une superficie de 0,25 à 1’hectare et principalement en saison sèche et en saison sèche humide. Dans ces deux cas, l’irrigation est le seul moyen d’apporter l’eau à la culture. En saison pluvieuse, la tomate est cultivée sur de petites parcelles d’une superficie de moins de 0,25 ha, autour des cases ou au bord de champs occupés par d’autres cultures comme les céréales ou le coton. Le système hors sol n’est pratiqué qu’à des fins expérimentales par les firmes de production des semences ou dans un but pédagogique par les centres de formation.
2Ces dernières années au Burkina Faso, la production de la tomate fait cependant face à plusieurs contraintes dont la pression parasitaire due aux ravageurs, comme les insectes et les nématodes et aux agents pathogènes tels que des bactéries, champignons et virus. Les pertes occasionnées conduisent les producteurs de certains sites maraichers du pays à renoncer à cette culture (IFDC, 2007). À côté des flétrissements bactériens causés par Ralstonia solanacearum dont l’importance est majeure au Burkina Faso (Traoré et al., 2020), des symptômes typiques d’attaques fongiques sont couramment observés sur les plantes de tomate au champ ou/et après la récolte des fruits.
3Ces symptômes sont, entre autres, des flétrissements et pourritures observés au niveau du collet des plantes, des pourritures de tiges et des fruits immatures, des dessèchements des feuilles ou encore des dépôts noirâtres sur les fruits. Face à ces maladies, les documentations techniques visant leur contrôle manquent dans le pays et les producteurs, laissés à eux-mêmes, s’adonnent à une utilisation inappropriée de pesticides chimiques pour limiter les dégâts sur les cultures (Toé, 2010 ; Naré et al., 2015 ; Son et al., 2017 ; Son et al., 2018).
4La mise au point de méthodes de lutte efficaces, durables et peu polluantes contre les maladies nécessite une identification des agents pathogènes incriminés et une bonne connaissance de leur biologie et écologie. C’est dans ce contexte que s’intègre cette étude qui vise à inventorier les agents pathogènes fongiques présents sur la tomate en culture et sur les semences commercialisées au Burkina Faso.
2. Matériel et méthodes
2.1. Échantillonnage de plantes et semences de tomate
5Des plantes de tomates malades ont été collectées dans 45 sites maraichers de 11 des 13 régions du Burkina Faso (Cascades, Hauts-Bassins, Boucle du Mouhoun, Nord, Plateau central, Centre, Centre-Sud, Centre-Ouest, Sud-Ouest, Est et Centre-Est) (Figure 1, Tableau 1). Les plantes flétries, ainsi que les feuilles ou les fruits présentant des affections telles que des taches brunes, des dessèchements et des pourritures du collet et des racines, ont été collectées. Une description des symptômes a été réalisée. Les 228 échantillons collectés ont été conditionnés dans des sacs en plastique puis transportés au laboratoire dans des glacières pour identification et analyses des agents pathogènes.
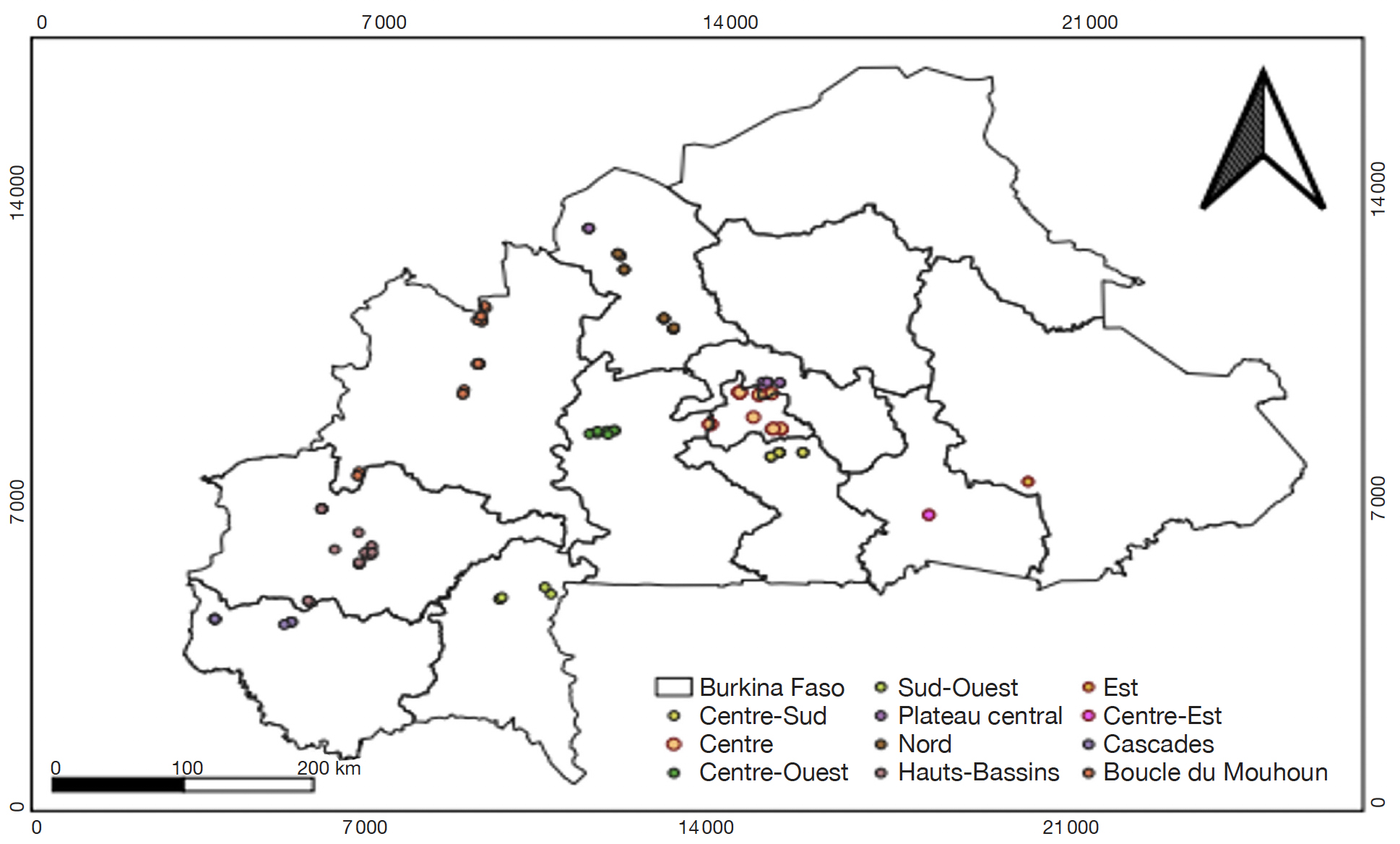
Figure 1. Zones de collecte des échantillons de tomate analysés dans cette étude au Burkina Faso — Origins of tomato samples analyzed in this study in Burkina Faso.
Source : Base Nationale de Données Topographiques (BNDT), 2012.
6Des lots de semences de tomates (Tableau 2) ont également été collectés sur le marché local ou transmis par les firmes de production et de commercialisation.
2.2. Isolement des champignons à partir des organes de plantes malades
7L’isolement des champignons associés aux symptômes visibles a été réalisé par la culture des fragments végétaux en boites de Petri sur milieu Potato dextrose agar (PDA)/Chloramphénicol (0,20 g·l-1). Préalablement, les échantillons de plantes présentant des symptômes ont été lavés à l’eau et découpés en fragments de 2 à 4 cm. Ceux-ci ont été désinfectés superficiellement dans de l’alcool (70 %) pendant 30 sec puis dans de l’eau de Javel (1 %) pendant 1 min et enfin rincés à l’eau distillée stérile trois fois. Après séchage superficiel sous hotte, les fragments ont été déposés sur le milieu de culture et mis en incubation sous lumière proche UV (tubes de lumière noire Phillips TL 40W/80) 12 h alternées avec l’obscurité (12 h) à 25 °C. Après trois jours d’incubation, chaque colonie de champignon a été transférée individuellement dans une nouvelle boite contenant du PDA/Chloramphénicol. Les isolats ainsi obtenus ont été transférés en tube et mis en conservation à 4 °C sous paraffine.
2.3. Évaluation de la qualité sanitaire des semences
8L’analyse sanitaire des semences a été faite selon les normes de l’ISTA (Mathur & Kongsdal, 2003). Pour chaque lot, 200 graines ont été réparties dans huit boites de Petri (25 graines par boite) sur trois rondelles de papier buvard stérile humidifié à l’eau stérile. Après incubation pendant sept jours à 25 °C et 12 h lumière/jour, la fréquence d’infection des graines par des champignons et leur identification morphologique a été réalisée comme décrit ci-dessous. Afin de mettre en évidence les agents infectieux présents au sein des graines, les semences ont été semées dans des vases de végétation contenant du sable stérile. Les plantules ont été récoltées 28 jours après semis pour l’évaluation sanitaire selon la méthode du papier buvard. Cette méthode consiste à disposer les fragments (1 cm environ) prélevés des parties de la plantule (feuilles, tige et racines) (avec ou sans symptômes) et de les disposer dans une boite de Petri contenant trois rondelles du papier buvard humidifiées à l’eau distillée stérile et de les incuber dans les conditions identiques à celles décrites ci-dessus pendant une semaine. Le dispositif expérimental a été complètement randomisé avec 14 lots de semences (traitements) et quatre répétitions par traitement qui sont constituées de 5 plantules, pour un total de 20 plantules par lot.
2.4. Identification morphologique et moléculaire des agents isolés
9La caractérisation morphologique des agents isolés sur milieu de culture ou observés sur semences ou plantules en croissance a été effectuée à l’aide d’une loupe, d’un microscope et des clefs d’identification (Mathur & Kongsdal, 2003 ; Blancard et al., 2009 ; Crous & Groenewald, 2014 ; Jones et al., 2014). Les principaux types morphologiques des agents isolés sur milieux ont été classés.
10Un échantillon de chaque type déjà purifié a été mis en croissance par repiquage d’un apex mycélien sur PDA et incubé à 25 °C ± 1 °C. Après une semaine de croissance, les isolats ont été collectés pour l’extraction de l’ADN selon le protocole de CTAB décrit par Lee & Taylor (1990).
11L’identification moléculaire de ces types morphologiques a ensuite été réalisée par le séquençage d’une région de l’ADN ribosomal, comprenant les espaceurs internes transcrits (ITS) 1 et 2 et le gène 5.8S (White et al., 1990). Cette région a été amplifiée par PCR avec les amorces ITS5 (GGAAGTAAAAGTCGTAACAAGG) et ITS4 (TCCTCCGCTTATTGATATGC) (White et al., 1990) au moyen d’un thermocycleur (iCycler, BioRad, Allemagne). Le mélange réactionnel était composé de 13,125 µl d’eau DEPC, 5 μl de tampon de Taq ADN polymerase (Promega, Madison, USA 10 × 2,5 mM), 2,5 µl de MgCl2 (25 mM, Promega), 0,75 µl de dNTP (2,5 mM), 0,5 µl de chaque amorce ITS5 & ITS4 (20 mM chacun), 0,125 µl de Taq ADN polymérase (5 u·µl-1, Gotaq Promega) et 2,5 µl de l’extrait ADN de chaque souche. L’amplification a été réalisée selon les étapes suivantes : dénaturation initiale à 94 °C pendant 3 min, 35 cycles de dénaturation à 94 °C pendant 30 sec, hybridation à 56 °C pendant 30 sec et extension à 72 °C pendant 1 min, et ensuite une extension finale de 72 °C pendant 7 min.
12Les produits PCR ont été visualisés sur un gel d’agarose (1,2 %) et leur séquençage a été effectué par Microsynth Seqlab GmbH (Allemagne). Les séquences ainsi obtenues ont été alignées avec le logiciel BioEdit et comparées par Blastn à la base de données du NCBI pour rechercher les similitudes avec les séquences d’espèces connues. Les séquences ont été déposées sur NCBI.
2.5. Analyse statistique
13Les données de la prévalence des espèces transmises par la semence selon les lots ont été soumises à une analyse de variance (ANOVA) avec le logiciel SPPS 22.0 et les moyennes ont été comparées selon le test de Duncan au seuil de 5 %.
3. Résultats
3.1. Prévalence des mycètes associés aux pourritures de la tomate
14Les symptômes observés étaient de nature très variée en culture de la tomate sur tous les organes et dans les différents sites (Tableau 3). Au total, 228 échantillons de plantes ont été collectés dans 45 sites maraichers au cours des investigations.
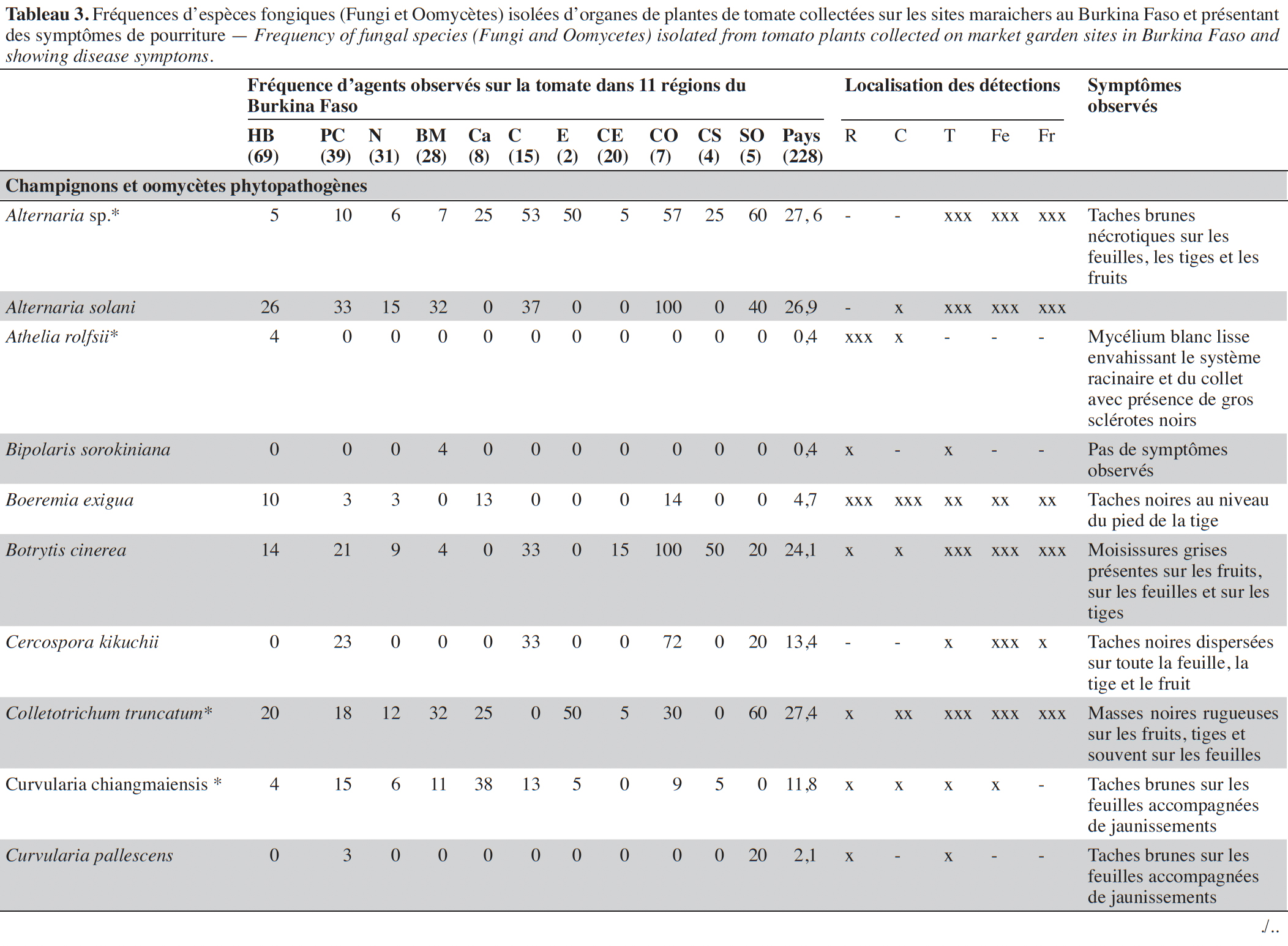
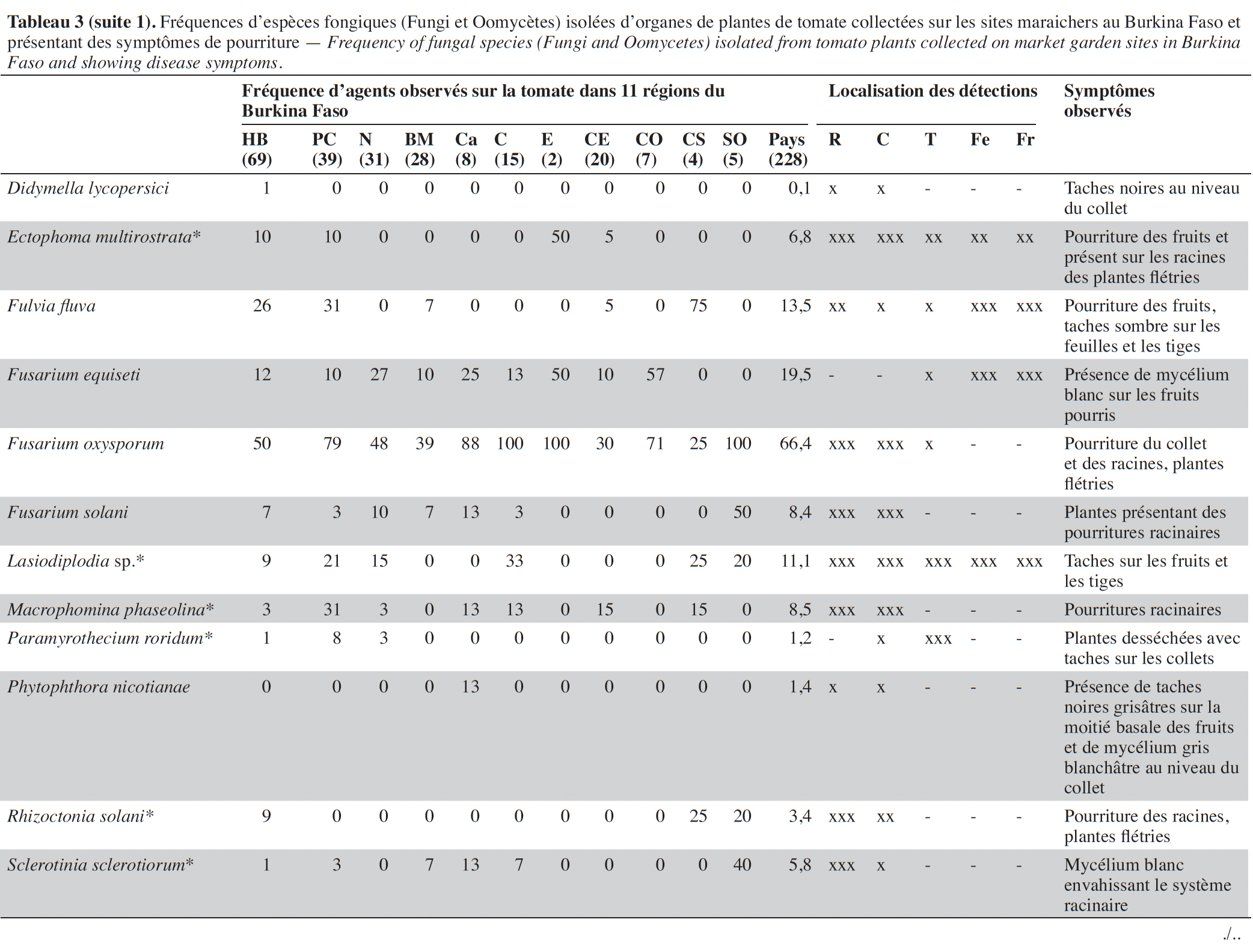
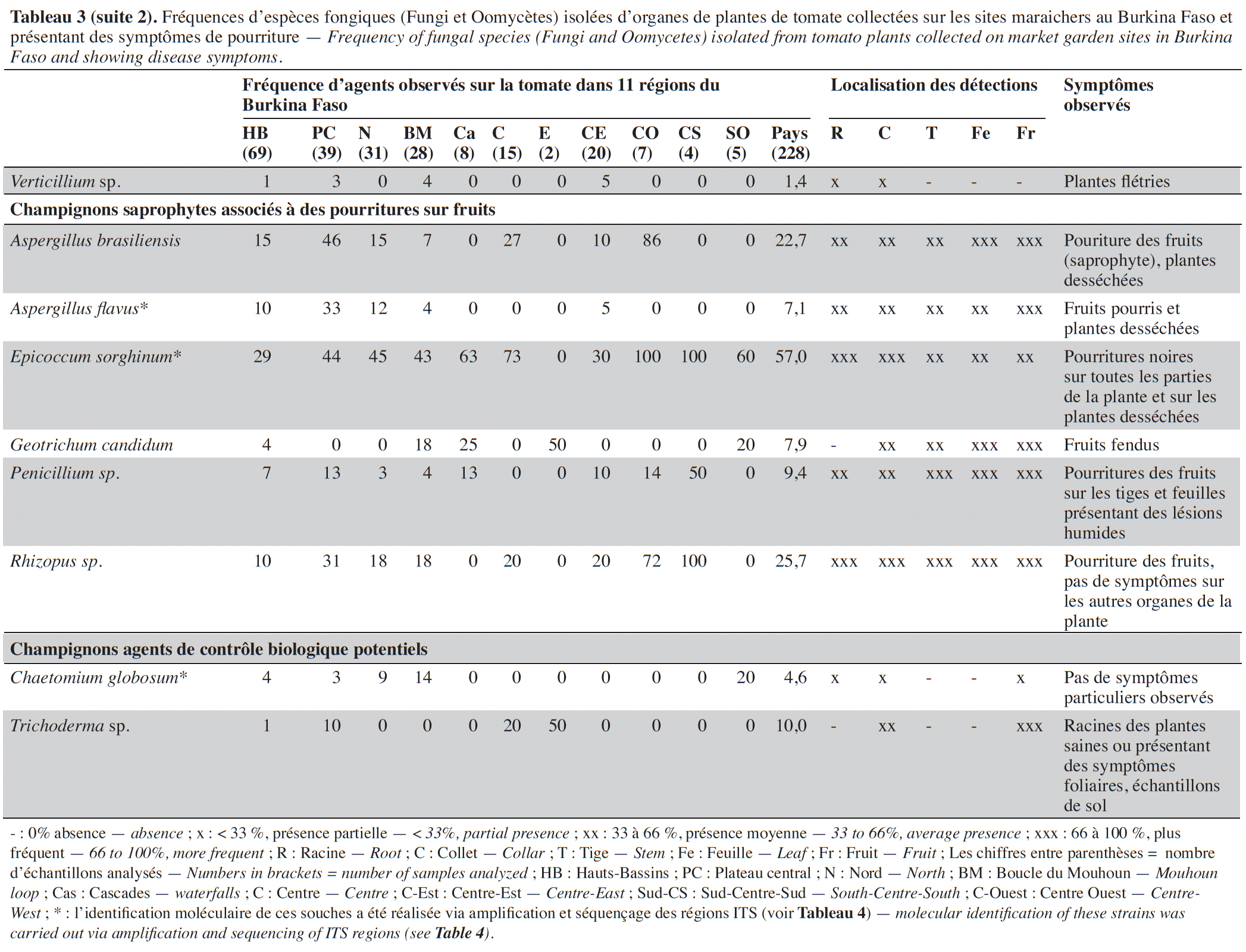
15Les isolements sur milieux de culture réalisés à partir des échantillons collectés ont permis d’inventorier les agents fongiques en présence sur la base des caractéristiques morphologiques, des structures fongiques ou de la caractérisation moléculaire (Tableau 4).
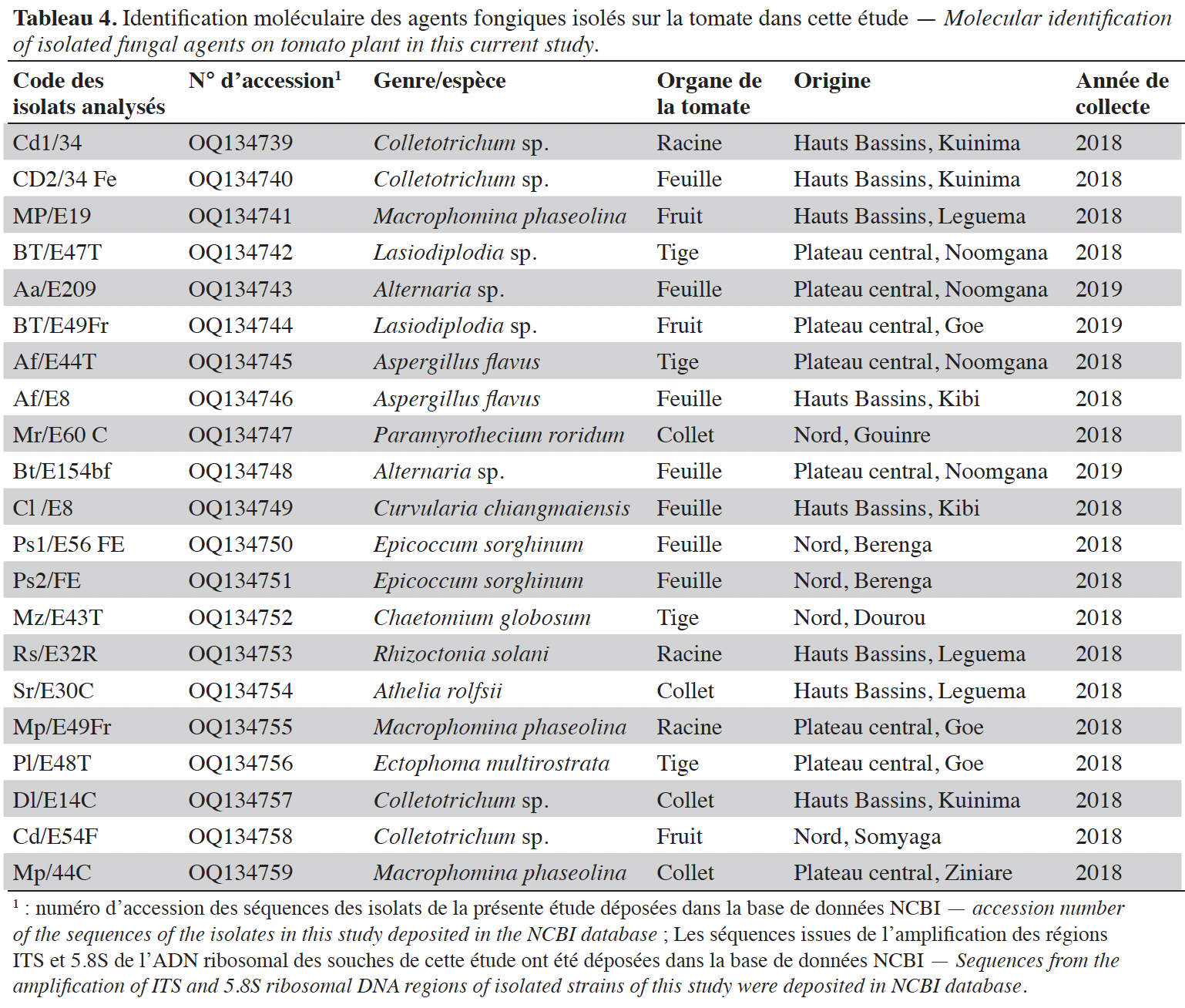
16Au total, 32 espèces fongiques ont été isolées et identifiées. Elles sont répertoriées et classées dans le tableau 3 selon leurs types écologiques, tels que agents phytopathogènes associés à des maladies sur plantes ou des moisissures sur fruits (en pré- et post- récolte) ou espèces déjà décrites dans la littérature comme agents de contrôle biologique.
17Sur les parties aériennes (feuille, fruit et tige), deux espèces du genre Alternaria (Alternaria sp. et A. solani) ont été recensées avec des fréquences variant, selon les régions, de 4 à 60 % et de 0 à 100 %, respectivement. Ces espèces étaient associées à des nécroses brunes circulaires sur les feuilles, tiges et fruits (Tableau 3). Plusieurs espèces de Fusarium, identifiées sur base morphologique, dont F. equiseti, F. oxysporum et F. solani, ont été mises en évidence avec des prévalences élevées (50 à 100 %) dans les régions du Centre, de l’Est, du Centre-Ouest et du Sud-Ouest. L’espèce F. oxysporum a été la plus fréquemment isolée, avec une moyenne globale de 66,4 %. Cette espèce est présente dans toutes les régions. Fusarium equiseti a été principalement isolée à partir de feuilles et de fruits pourris alors que F. oxysporum et F. solani ont été isolées de racines nécrosées ou de collets de plantes présentant des symptômes de flétrissement. Des isolats de Geotrichum candidum, l’espèce responsable de la pourriture aigre, ont été obtenus très fréquemment à partir de tiges, feuilles et fruits fendus accompagnés d’une patte blanche et humide au point de la fente. Quant à Botrytis cinerea, l’agent causal de la pourriture grise, cette espèce polyphage a été isolée d’échantillons de tiges, feuilles et fruits collectés dans huit des 11 régions visitées avec une fréquence de 24,1 %. Colletotrichum sp. a été mis en évidence dans sept régions avec une fréquence moyenne de 27,3 % et majoritairement à partir de masses noires rugueuses et circulaires présentes sur les fruits. Deux espèces du genre Aspergillus, A. flavus et A. brasiliensis, ont été isolées majoritairement de fruits pourris.
18D’autres espèces bien connues comme phytopathogènes ont été isolées, de façon plus sporadique, des parties souterraines des plantes, au niveau des collets ou racines : Rhizoctonia solani associé à des pourritures sèches et des flétrissements, et Athelia rolfsii et Sclerotinia sclerotiorum isolés des plantes présentant des mycelia blancs envahissant le collet ou les racines avec de gros sclérotes brun ou noir. Un isolat de Didymella lycopersici, agent de la maladie du pied noir, a été obtenu sur un seul échantillon de tige présentant des taches noires et collecté dans la région des Hauts-Bassins.
19D’autres espèces connues comme polyphages ont été mises en évidence à des fréquences moyennes à faibles : Macrophomina phaseolina (8,5 %) et Verticillium sp. (1,4 %) ont été isolés à partir de nécroses et pourritures de racines et collets et Phytophthora nicotianae (1,4 %) au départ de taches grises sur un fruit. Plusieurs autres espèces ont aussi été mises en évidence à partir de tous les organes de la plante et particulièrement des fruits présentant des pourritures : Aspergillus flavus (7,1 %), A. brasiliensis (22,7 %), Penicillium sp. (9,4 %), Rhizopus sp. (25,7 %) et Fulvia fulva (13,3 %), Lasiodiplodia sp. (11,1 %), Epicoccum sp. (57,0 %), Ectophoma multirostrata (6,8 %), Boeremia exigua (4,7 %) et Colletotrichum sp. (27,4 %). Des isolats de Trichoderma sp. et Chaetomium globosom ont aussi été isolés à partir de systèmes racinaires des plantes (Tableau 3).
20Au total, 32 espèces fongiques pathogènes ont été identifiées sur les plantes malades de tomate provenant des 11 régions du Burkina Faso. Leur prévalence varie selon les régions. Le nombre d’espèces isolées a été plus élevé sur les échantillons provenant de la région des Hauts-Bassins (24 espèces), du Plateau central (25 espèces), du Nord (18 espèces) et de la Boucle du Mouhoum (20) par rapport aux autres régions prospectées, mais le nombre de sites visités y a été généralement plus important (> 5).
3.2. État sanitaire des semences
21L’évaluation sanitaire des lots de semences, basée sur l’observation de structures fongiques en développement sur les graines en conditions humides, a révélé la présence de deux espèces fongiques (Figure 2). Aspergillus flavus a été observé dans quatre lots, sur les variétés Rio Grande, Roma VF, Tropimech et Rossol à des prévalences variant entre 20 et 45 % et la présence de Fusarium sp. a été observée sur les variétés Symbal, Jaguar, Savana et Rodeo à des fréquences variant entre 5 et 20 %.
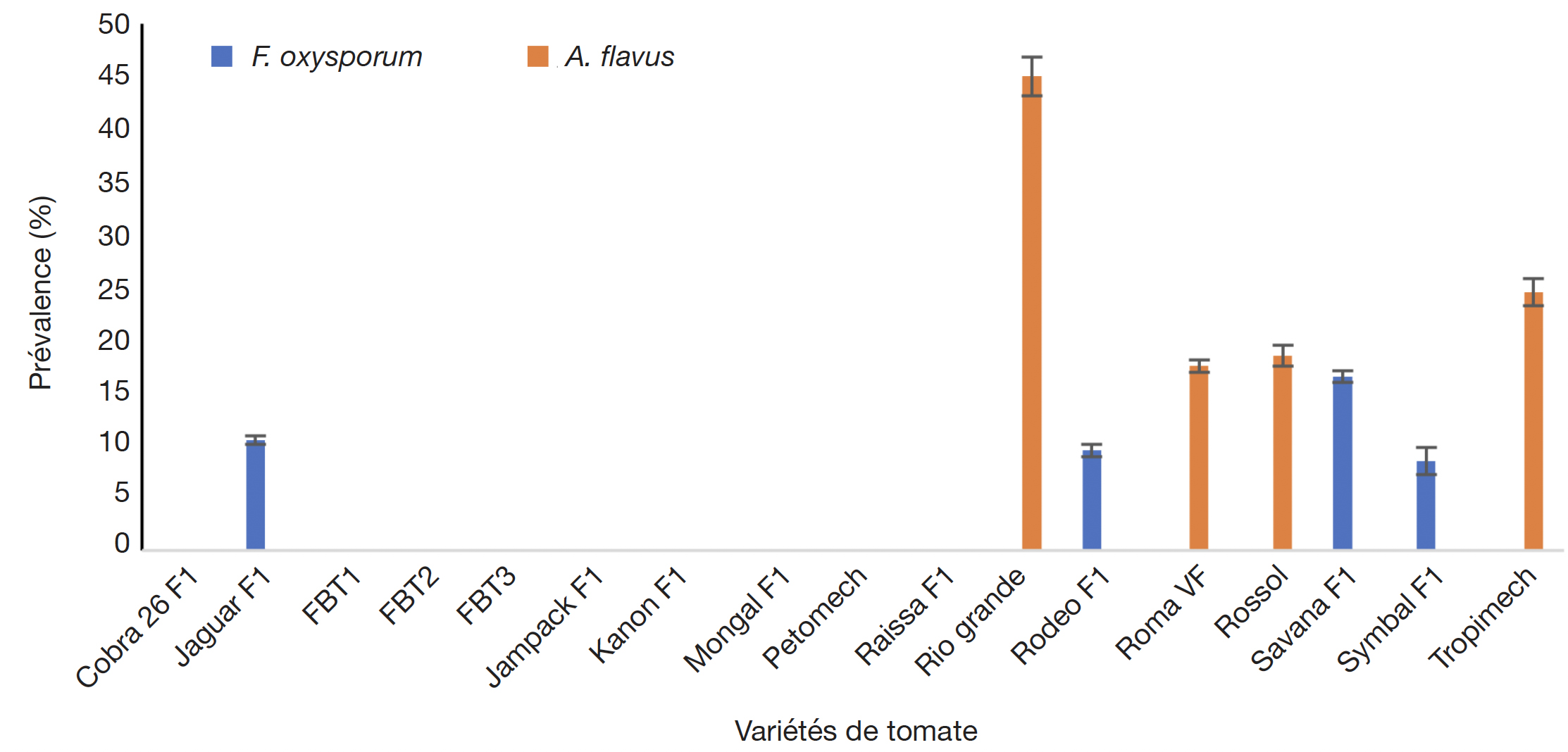
Figure 2. Prévalence de Fusarium sp. et Aspergillus flavus sur les semences des variétés de tomate disponibles au Burkina Faso — Prevalence of Fusarium sp. and Aspergillus flavus on seeds of tomato varieties available in Burkina Faso.
22L’évaluation sanitaire des plantules issues de ces lots de semences mises en croissance sur sable stérile a révélé que les semences sont porteuses de plusieurs espèces fongiques phytopathogènes. Au total, 10 espèces distinctes ont été identifiées. Les taux d’infection et les fréquences des espèces fongiques diffèrent d’une variété à une autre ou d’un lot à l’autre (Tableau 5). Toutes variétés confondues, les prévalences les plus élevées ont été observées pour F. oxysporum (de 65 % à 100 % selon les variétés, en moyenne 87 %), Epicoccum sp. (de 38 % à 95 % selon les variétés, en moyenne 55 %) et Colletotrichum sp. (de 0 % à 88 % à selon les variétés, en moyenne 38 %). Ces trois espèces ont été rencontrées sur quasi toutes les variétés testées. Trois autres espèces, F. solani (0 % à 57 %), C. kikuchii (23 % à 57 %) et B. cinerea (2 % à 28 %) étaient aussi souvent rencontrées. L’analyse statistique révèle qu’il y a une différence hautement significative entre les prévalences des différentes espèces fongiques sur les différentes variétés testées (p < 0,05) à l’exception des espèces B. cinerea (p = 0,12), E. rostratum (p = 0,16) et Alternaria sp. (p = 0,57) nettement moins fréquentes et pour lesquelles aucune différence n’a été mise en évidence.
4. Discussion
23L’objectif de la présente étude vise à faire un état des lieux des espèces fongiques cultivables associées aux symptômes sur la tomate au Burkina Faso afin de mettre en évidence les espèces phytopathogènes prévalentes pour orienter ensuite vers des stratégies de contrôle adaptées.
24L’analyse des échantillons collectés a permis d’identifier 32 espèces fongiques, dont 26 espèces connues pour leur pathogénicité sur la tomate et dont les prévalences varient en fonction des localités.
25La diversité des espèces observées selon les régions peut cependant être liée à la taille de l’échantillonnage qui a été nettement plus élevée dans les régions des Hauts-Bassins (8 sites maraichers) et du Plateau central (6 sites maraichers) (69 et 30 échantillons collectés, respectivement) que dans les régions des Cascades et de l’Est, où seuls quelques échantillons ont été collectés en raison des problèmes d’insécurité dans ces régions et de la crise sanitaire.
26L’identification des espèces fongiques rencontrées sur les échantillons a permis d’associer plusieurs espèces pathogènes à des symptômes caractéristiques de dégâts observés aux champs et décrits ci-dessous en fonction de leur origine et des organes infectés.
4.1. Champignons ou oomycètes d’origine tellurique infectant les racines ou le collet des plantes
27Fusarium oxysporum et Verticillium sp. sont bien connus en tant que principaux champignons responsables de maladies vasculaires chez la tomate et d'autres cultures (Blancard et al., 2009 ; Beranger et al., 2016 ; Joshi, 2018 ; Srinivas et al., 2019).
28Ces champignons ont été identifiés dans nos échantillons de plantes flétries et nos résultats révèlent clairement que F. oxysporum est nettement plus répandu. En effet, ce champignon était presque omniprésent et prédominant sur tous les sites prospectés. Des pertes évaluées à près de 60 à 80 % ont été observées sur certains sites maraichers visités au Burkina Faso, notamment à Noomgana, une commune rurale de la région du Plateau central en 2019 (communication personnelle).
29De plus, sur le site maraicher de Dogona (une commune urbaine de Bobo-Dioulasso dans la région des Hauts-Bassins), la production de tomates a été systématiquement abandonnée par les producteurs après avoir enregistré près de 90 à 100 % de pertes dues à ce pathogène.
30Des niveaux de dégâts d’une même ampleur ont également été rapportés dans d'autres pays africains, tels que la Tunisie et le Bénin (Hajlaoui et al., 2001 ; Sirikou et al., 2001).
31Au sein de l'espèce F. oxysporum, deux sous-espèces sont rapportées sur la tomate, à savoir F. oxysporum f. sp. lycopersici, responsable du flétrissement vasculaire et F. oxysporum f. sp. radici-lycopersici, responsable de la pourriture des racines et du collet. L’identification des espèces du genre Fusarium a été faite dans cette étude sur une base morphologique. Le séquençage des régions ITS chez Fusarium ne permet pas de différencier les espèces ou formes spéciales (O’Donnell et al., 1998).
32Il convient donc de poursuivre la caractérisation par des tests de pathogénicité et le séquençage d’autres gènes plus discriminants tels que le facteur d’élongation1-alpha, etc. pour déterminer la diversité au sein des espèces de ce genre. Dans plusieurs sites (Léguéma, Toussiana, Kuinima, Kibi, Kodeni et Benvar), le flétrissement des plantes de tomate par F. oxysporum était associé à l’infestation des sites par des nématodes (communication personnelle).
33Athelia rolfsii (syn. Sclerotium rolfsii) et Sclerotinia sclerotiorum sont identifiables par la formation d’un mycélium blanc dense et la formation de sclérotes. Ces espèces se différencient par la couleur des sclérotes, brun et noir, respectivement. Rhizoctonia rolfsii et Phytophthora nicotianae ont été isolées de plantes flétries ou de pourritures du collet et des racines.
34L’ensemble de ces agents fongiques ou oomycètes, respectivement, vivent dans le sol et s’attaquent aux parties souterraines de la tomate et d’autres cultures (Leslie & Summerell, 2006 ; Blancard et al., 2009 ; Béranger et al., 2016). Tous ces agents telluriques survivent pendant des périodes plus ou moins prolongées sur les débris végétaux et dans le sol sous forme de structures telles que des chlamydospores, pour F. oxysporum et P. nicotianae ou des sclérotes, pour S. sclerotiorum, A. rolfsii et R. solani, ou encore des microsclérotes, pour Verticillium sp. La culture des plantes non hôtes pendant plusieurs saisons permet de réduire l’inoculum présent dans le sol.
4.2. Champignons isolés des organes aériens
35Sur les parties aériennes des plantes, F. equiseti a été fréquemment isolé sur les fruits altérés et les feuilles de la tomate. Les espèces Alternaria solani et Alternaria sp. ont été retrouvées sur les feuilles, les tiges et les fruits présentant des symptômes de jaunissement avec des taches brunes circulaires.
36Ces symptômes correspondent à ceux décrits par Blancard et al. (2009) et sont communément connus sous le nom de « early blight ». Ces agents de pourriture noire infectent la tomate, réduisent la surface photosynthétique de la plante et entrainent des pertes significatives lors de la récolte (Kemmit, 2013 ; Béranger et al., 2016).
37Colletotrichum sp., l’agent responsable de l’anthracnose de la tomate (Saini et al., 2017), a été principalement retrouvé sur les fruits pourris, présentant des masses noires rugueuses, ainsi que sur les tiges et les feuilles, tout comme Lasiodiplodia sp. (Quimbita-Reyes et al., 2022). Ces champignons peuvent également être transmis par les semences (Champion, 1997). Une autre espèce très répandue, Botrytis cinerea, a fréquemment été observée sur des fruits ou d'autres organes en décomposition, présentant une pourriture grisâtre. Cet agent pathogène est hautement polyphage, mais il peut également agir en tant qu'opportuniste, profitant des blessures lors de la croissance des bourgeons sur les tiges, ainsi que de diverses sources nutritionnelles potentielles, telles que les parties florales, pour pénétrer les tissus végétaux et s'y établir (Champion, 1997 ; Staats et al., 2005 ; Blancard et al., 2009 ; Béranger et al., 2016).
38Par ailleurs, des espèces saprophytes connues pour se développer sur la végétation en décomposition sur des produits en conservation telles que A. niger, A. flavus, Penicillium sp. et Rhizopus sp. ont également été identifiées. Elles ont été observées sur tous les organes de la plante de tomate, mais elles sont plus abondantes sur les fruits avant et après la récolte, et souvent avant leur maturation.
39La présence accrue de ces champignons sur les fruits peut être attribuée à leur teneur élevée en eau, qui les rend juteux à maturité. Cependant, en cas de fort taux d’humidité, ils deviennent dangereux et susceptibles de se comporter en pathogène (Champion, 1997 ; Agrios, 2005). La capacité des Aspergillus spp. et Penicillium sp. (Perrone & Susca, 2017) à produire des mycotoxines (aflatoxines, ochratoxines, patuline, etc.) dans les aliments invite à être vigilants sur la potentielle présence de mycotoxines (Aborisade et al., 2017).
4.3. Champignons associés aux semences
40L’analyse sanitaire réalisée sur base de l’observation directe des semences n’a révélé la présence que de deux genres/espèces : Fusarium sp. et A. flavus. L’étude effectuée sur les organes des plantules issues des semences de plusieurs variétés a cependant révélé une diversité d’espèces avec des prévalences variables. Cette différence peut s’expliquer par le fait que les semences sont généralement enrobées avec des fongicides chimiques de contact qui limitent leur développement fongique sur les graines. Lorsque l’embryon est infecté par une espèce pathogène, celle-ci peut se développer dans une phase ultérieure du développement de la plante. C’est ainsi que la présence de certaines espèces qui n’avaient pas été observées sur les graines a été mise en évidence.
41Les champignons les plus fréquemment rencontrés sur les plantules des différentes variétés ont été F. oxysporum (65 % à 100 %), Epicoccum sp. (38 % à 95 %), F. solani (0 % à 57 %), Colletotrichum sp. (0 % à 88 %), F. fulva (0 à 68 %), C. kikuchii (23 % à 57 %) et B. cinerea (2 % à 28 %).
42Ces taux élevés d’infection sur les plantules pourraient s’expliquer par le fait que les fongicides de contact utilisés en traitement de semences n’empêchent pas le développement d’agents pathogènes présents à l’intérieur des graines. Par ailleurs, les micro-organismes qui infectent les semences sont en partie responsables de maladies d’importance variable observées au champ (Champion, 1997).
43La cladosporiose, l’antrachnose et certaines fusarioses (pourriture du collet et des racines) sont des maladies transmises par les semences et responsables d’importants dégâts sur les cultures telles que la tomate (Champion, 1997 ; Beranger et al., 2016). Epicoccum sp. a été aussi observé sur les semences avec une fréquence de 54,5 % et sur les plantes malades (57 %).
44Suite à cette étude, les résultats ont permis de mettre en évidence les différentes espèces fongiques qui peuvent exister sur la tomate en champ ainsi que sur les semences. Les espèces les plus fréquemment observées sur les échantillons de tomates étaient : F. oxysporum (66,4 %), Colletotrichum sp. (27,4 %), A. solani (26,9 %) et Alternaria sp. (27,5 %), qui sont tous des pathogènes, à l'exception de Epicoccum sp. dont les symptômes n'avaient pas été mentionnés dans les études antérieures sur la tomate. En ce qui concerne les lots de semences des différentes variétés testées, les pathogènes les plus courants étaient F. oxysporum (de 65 % à 100 %), Epicoccum sp. (de 38 % à 95 %), F. solani (de 0 % à 57 %), Colletotrichum sp. (de 0 % à 88 %), F. fulva (de 0 % à 68 %), C. kikuchii (de 23 % à 57 %) et B. cinerea (de 2 % à 28 %).
45Vu la prévalence de F. oxysporum dans l’ensemble des régions visitées au Burkina Faso et la capacité de cette espèce à être transmise par la graine, des travaux ultérieurs, actuellement en cours, sont mis en œuvre pour caractériser les formes spéciales de F. oxysporum en présence. En plus, la recherche des méthodes de protection intégrée basées sur l'usage des agents de contrôle biologique, la pratique de la rotation culturale dans les sites maraichers, l’utilisation de variétés résistantes et aussi la solarisation peuvent limiter les pertes encourues et réduire les taux d’infection des semences avant la mise en place des pépinières (Béranger et al., 2016).
46Dans ce contexte, l’obtention de souches indigènes de Trichoderma ou de C. globosum associées à la tomate au Burkina Faso présente un intérêt particulier. En effet, ces genres ou espèces ne sont pas connus comme pathogènes de la tomate, mais des souches associées à ces taxons ont été rapportées comme mycophages (Shanthiyaa et al., 2013 ; Dabiré et al., 2016 ; Koné et al., 2019). Les souches obtenues dans le cadre de cette étude pourraient donc être testées comme agents de contrôle biologique par rapport aux pathogènes de la tomate.
5. Conclusions
47Cette étude s’est proposée de déterminer le spectre d’agents pathogènes fongiques associés à la culture de la tomate au Burkina Faso. Les résultats ont montré que cette culture est fortement attaquée par une diversité d’espèces fongiques (aériennes et telluriques) dont les plus fréquentes et dommageables ont été les espèces du genre Fusarium, en particulier F. oxysporum, tant sur les échantillons de plantes malades collectées (66,43 %) que sur les semences (87,02 %). Au regard du potentiel de colonisation de ce pathogène, en plus de l’ampleur des flétrissements des plantes de tomate et des fontes de semis observés sur le terrain, des traitements des semences et aussi des cultures en plein champ devraient être préconisés afin de réduire le taux d’inoculum primaire sur les semences et dans le sol.
Remerciements
48Les auteurs adressent leurs remerciements à l’ARES (Bruxelles, Belgique) pour avoir financé le projet PRD/ProDuIRe, dans le cadre duquel la recherche présentée a été effectuée.
Contribution des auteurs
49Assiata Tiendrebeogo est l’investigatrice principale de ce travail. Elle a effectué les travaux de terrain, les tests au laboratoire ainsi que la rédaction de la première version du manuscrit. Amadou Sanou a participé à la collecte des échantillons sur le terrain et à la purification du matériel fongique au laboratoire. Schemaeza Bonzi a participé à l’échantillonnage sur le terrain et à l’identification des micro-organismes au laboratoire. Gaston Tobdem Dabiré, Schemaeza Bonzi, Hyacinthe Sami Kambire et Diakalia Son ont contribué à l’analyse des données et effectué la correction du manuscrit. Irénée Somda et Anne Legrève ont supervisé les différents travaux et révisé le manuscrit.
Bibliographie
Aborisade A., Adetutu A. & Owoade O., 2017. Phytochemical and proximate analysis of some medicinal leaves. Clin. Med. Res., 6(6), 209-214, doi.org/10.11648/j.cmr.20170606.16
Agrios G.N., 2005. Plant pathology. 5th ed. Burlington, MA, USA: Elsevier Academic Press.
Béranger M., Lejeune V. & Sellam M., 2016. Guide pratique de défense des cultures. 6è ed. Paris : ACTA éditions, Les institutions Techniques Agricoles.
Blancard D., Laterrot H., Marchoux G. & Candresse T., 2009. Les maladies de la tomate, identifier, connaître, maîtriser. Paris : Éditions Quae, INRA.
Boland G. & Kuykendal L., 1997. Plant-microbe interactions and biological control. New York, NY, USA: Marcel Dekker.
Champion R., 1997. Identifier les champignons transmis par les semences. Paris : Éditions Quae, INRA.
Crous P.W. & Groenewald J.Z., 2014. Fungal pathogens of food and fibre crops. Utrecht, The Netherlands: CBS-KNAW Fungal biodiversity Centre.
Dabiré T.G., Bonzi S., Somda I. & Legrève A., 2016. Évaluation in vitro de l’activité antagoniste d’isolats de Trichoderma harzianum Pers. contre trois espèces fongiques pathogènes de l’oignon au Burkina Faso. Tropicultura, 34(3), 313-322.
Hajlaoui M.R., Hamza N., Gargouri S. & Guermech A., 2001. Apparition de Fusarium oxysporum f. sp. radicis-lycopersici, agent de la pourriture des racines et du collet de la tomate en Tunisie. EPPO Bull., 31(4), 505-507.
IFDC (International Fertilizer Development Center), 2007. Problématique de l’utilisation des produits phytosanitaires en conservation des denrées alimentaires et en maraîchage urbain et péri-urbain au Burkina Faso : cas de Bobo-Dioulasso, Ouahigouya et Ouagadougou. Ouagadougou : IFDC.
Jones J.B., Zitter T.A., Momol T.M. & Mill S.A., 2014. Compendium of tomato diseases and pests. 2nd ed. Saint Paul, MN, USA: The American Phytopathological Society, 150-168.
Joshi R., 2018. A review of Fusarium oxysporum on its plant interaction and industrial use. J. Med. Plants Stud., 6(3), 112-115.
Kemmitt G., 2013. Early blight of potato and tomato. Plant Health Instructor, doi.org/10.1094/PHD-I-2002-0809-01
Kone Y., Dabiré G.T., Amadou H. & Somda I., 2019. Évaluation in vitro du potentiel antagoniste de Trichoderma harzianum du Burkina Faso contre Magnaporthe grisea, l’agent causal de la pyriculariose du riz, isolées au Mali. Int. J. Biol. Chem. Sci., 13(7), 3053-3065, doi.org/10.4314/ijbcs.v13i7.7
Lee S.B. & Taylor J.W., 1990. Isolation of DNA from fungal mycelia and single spore. In: Innis M.A., Gelfand D.H., Sninsky J.J. & White T.J, eds. PCR protocols. A guide to methods and applications. San Diego, CA, USA: Academic Press.
Leslie J.F. & Summerell B.A., 2006. The Fusarium laboratory manual. 1st ed. Oxford, UK: Blackwell Publishing.
MAAH (Ministère de l’Agriculture et des Aménagements Hydro-agricoles), 2020. Rapport de l’enquête maraichère 2018. Ouagadougou : MAAH.
Mathur S.B. & Kongsdal O., 2003. Common laboratory seed health testing methods for detecting fungi. 1st ed. Bassersdorf, Switzerland: International Seed Testing Association.
Naré R.W.A., Savadogo P.W., Gnankambary Z. & Nacro H.B.S.M.P., 2015. Analyzing risks related to the use of pesticides in vegetable gardens in Burkina Faso. Agric. For. Fisheries, 4(4), 165-172, doi.org/10.11648/j.aff.20150404.13
O’Donnell K., Kistler H.C. & Cigelnik P.R., 1998. Multiple evolutionary origins of the fungus causing Panama disease of banana: concordant evidence from nuclear and mitochondrial gene genealogies. Proc. Natl. Acad. Sci. U.S.A., 95, 2044-2049, doi.org/10.1073/pnas.95.5.2044
Perrone G. & Susca A., 2017. Penicillium species and their associated mycotoxins. In: Moretti A. & Susca A., eds. Mycotoxigenic fungi. Methods in molecular biology. New York, NY, USA Humana Press, doi.org/10.1007/978-1-4939-6707-0_5
Quimbita-Reyes A.M., Cabrera-Asencio I., Serrato-Diaz L.M. & Rivera-Vargas L.I., 2022. First report of Lasiodiplodia sp. causing canker of mango (Mangifera indica) in Puerto Rico. Plant Dis., 1, doi.org/10.1094/PDIS-01-22-0149-PDN
Saini T.J., Gupta S.G. & Anandalakshmi R., 2017. Detection of tomato anthracnose caused by Colletotrichum sp. in India. Australas. Plant Dis. Notes, 12, 48, doi.org/10.1007/s13314-017-0271-4
Shanthiyaa V. et al., 2013. Use of Chaetomium globosum for biocontrol of potato late blight disease. Crop Prot., 52, 33-38, doi.org/10.1016/j.cropro.2013.05.006
Sikirou R. et al., 2001. Diagnostic des problèmes phytosanitaires des cultures maraichères au Sud Bénin : cas de la tomate, du piment, de l’oignon et du gombo. In : Agbo B. et al., eds. Actes de l’Atelier scientifique sur la recherche agricole pour le développement, 11-12 janvier 2001, Niaouli, Bénin. Cotonou, Bénin : INRAB, UNB-FSA ; Eschborn, Allemagne : GTZ, 102-125.
Son D., Somda I., Legrève A. & Schiffers B., 2017 : Pratique phytosanitaire des producteurs de tomates du Burkina Faso et risques pour la santé et l’environnement. Cah. Agric., 26(2), 25005, doi: 10.1051cagri/2017010.
Son D., Somda I., Legrève A. & Schiffers B., 2018. Effect of plant diversification on pest abundance and tomato yields in two cropping systems in Burkina Faso: farmer practices and integrated pest management. Int. J. Biol. Chem. Sci., 12(1), 101-119, doi.org/10.4314/ijbcs.v12i1.8
Srinivas C. et al., 2019. Fusarium oxysporum f. sp. lycopersici causal agent of vascular wilt disease of tomato: biology to diversity - A review. Saudi J. Biol. Sci., 26, 1315-1324.
Staats M., Van Baarlen P. & Van Kan J.A.L., 2005. Molecular phylogeny of the plant-pathogenic genus Botrytis and the evaluation of host specificity. Mol. Biol. Evol., 22, 333.
Toé A.M., coord., 2010. Étude pilote des intoxications dues aux pesticides agricoles au Burkina Faso. Rapport final. Rotterdam, Pays-Bas : Secrétariat de la Convention de Rotterdam.
Traoré O. et al., 2020. Evaluation of the 19 varieties and accessions of tomato against bacterial wilt in Bobo-Dioulasso, Burkina Faso. Int. J. Biol. Chem. Sci., 14(8), 2870-2879, doi.org/10.4314/ijbcs.v14i8.17
White T.J., Bruns T., Lee S. & Taylor J., 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis M.A., Gelfand D.H., Sninsky J.J. & White T.J., eds. PCR protocols: a guide to methods and applications. San Diego, CA, USA: Academic Press.






