- Accueil
- volume 12 (2008)
- numéro 2
- Voie de la lipoxygénase : valorisation d'huiles végétales et biosynthèse de flaveurs
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Voie de la lipoxygénase : valorisation d'huiles végétales et biosynthèse de flaveurs

Notes de la rédaction
Reçu le 29 mai 2006, accepté le 4 décembre 2007
Résumé
Cet article est une synthèse bibliographique sur l'application de la voie enzymatique de la lipoxygénase pour la production de molécules aromatisantes à partir d'huiles de plantes. Cette voie utilise comme matière première une huile végétale riche en acides gras polyinsaturés, qu'elle hydrolyse par une lipase puis oxyde par une lipoxygénase pour rendre possible la production d'aldéhydes par l'hydroperoxyde-lyase puis d'alcools par l'alcool-déshydrogénase. La cascade de réactions utilise des systèmes enzymatiques différents, ainsi qu'une matière première et des produits intermédiaires et finaux aux propriétés distinctes. Plusieurs publications et brevets ont décrit des systèmes de production d'arômes de type hexénal(s), nonénal(s) et nonadiénal(s) ainsi que leurs alcools correspondants. Dans différents travaux optimisés, la maîtrise de la voie de la lipoxygénase nécessite la mise en œuvre de systèmes multi-enzymatiques dans des milieux compartimentés pour la bioconversion.
Abstract
Lipoxygenase pathway: valorization of plant oils and aroma biosynthesis. This article is a review on the lipoxygenase pathway in plants, and its application in aroma compound synthesis from plant oils. Raw material used by this pathway is plant oils rich in poly-unsaturated fatty acids. Then, lipase-catalyzed hydrolysis followed by lipoxygenation, hydroperoxyde-lyase and alcohol-dehydrogenase act successively producing respectively aldehyde and alcohol. Several papers and patents described the production of aroma as hexenal(s), nonenal(s) and nonadienal(s) as well as their corresponding alcohols using enzymes of this pathway from different sources. The reaction sequence uses enzymatic systems of different characteristics, as well as raw material and intermediary and final products having specific properties. In order to improve the efficiency of the application of the lipoxygenase pathway, different studies used multi-enzymatic systems in compartimentalized media for the bioconversion.
Table des matières
1. Introduction
1Certaines productions agricoles, spécialement de céréales et de plantes à huiles, présentent actuellement un fort potentiel pour de nouvelles applications. La question posée au chercheur scientifique est donc : " comment transformer ces ressources agricoles renouvelables pour permettre leur emploi dans des domaines nouveaux et non-classiques, soit pour l'utilisation alimentaire ou non alimentaire ? "
2La biotechnologie peut apporter une réponse à cette question, exploitant des potentialités biologiques et des ressources naturelles pour obtenir des produits à haute valeur ajoutée. La valorisation de ressources agricoles peut se faire au moyen de bioprocédés employant des préparations enzymatiques pour traiter des matériaux indésirables ou améliorer la qualité de produits. Ceci permet d'éliminer des excès agricoles et/ou de déchets, en gardant le caractère naturel des produits. L'approche permet également une substitution progressive des " ressources pétrochimiques " par des " ressources agrochimiques renouvelables ".
3Plusieurs approches enzymatiques de conversion d'huiles naturelles en produits à haute valeur ajoutée ont été rapportées ces dernières décennies. Contrairement aux procédés chimiques, les réactions enzymatiques sont plus rapides et plus sélectives. Elles sont également stéréospécifiques, et peuvent être mises en œuvre sous température et pression modérées (Godfrey et al., 1986 ; Pelmont, 1995). Par ailleurs, l'inconvénient majeur de l'utilisation de ces biocatalyseurs à des fins de production semble être leur instabilité. L'utilisation de la catalyse enzymatique avec des substrats d'origine naturelle (produits d'extraction ou des biotechnologies) permet d'obtenir des produits à label " naturel ", un label particulièrement recherché pour son image auprès du consommateur dans les secteurs alimentaire et cosmétique.
4Des réactions enzymatiques sont capables d'oxyder des acides gras pour produire des hydroperoxydes et d'autres composés oxygénés de manière sélective. L'intérêt pour la voie de la lipoxygénase et ses produits est croissant, pas seulement d'un point de vue physiologique mais aussi d'un point de vue technologique (Frankel, 1980 ; Hatanaka et al., 1987 ; Vick et al., 1988 ; Gardner, 1991 ; Hatanaka, 1993 ; Croft et al., 1993). Cet article de synthèse examine l'avancement des connaissances sur la voie de la lipoxygénase des plantes. Il se focalise spécifiquement sur les bénéfices technologiques que la voie de la lipoxygénase peut offrir pour valoriser des huiles végétales en les convertissant en composés aromatisants d'une importance considérable en industrie.
5Malgré le grand nombre d'études sur la voie de la lipoxygénase et ses produits, la fonction physiologique des lipoxygénases chez les végétaux n'est pas encore bien élucidée (Vick et al., 1988 ; Hatanaka, 1996). Chez les plantes, diverses fonctions ont été attribuées à des produits de la voie de la lipoxygénase. La lipoxygénase a été associée à des processus impliqués dans différents stades de développement (Siedow, 1991 ; Fischer et al., 1999 ; Feussner et al., 2001). L'expression du gène de la lipoxygénase est dépendante de différents facteurs et effecteurs tels que la source, la nature et l'état du tissu (Fischer et al., 1999 ; Kolomiets et al., 2001), l'acide jasmonique, l'acide abscissique, ainsi que de différentes formes de stress comme la blessure des tissus, la déficience en eau et l'attaque par des pathogènes (Porta et al., 2002). La dégradation d'acides gras polyinsaturés donne une gamme de produits et d'intermédiaires, plusieurs d'entre eux contribuent à l'odeur caractéristique du tissu végétal coupé ou endommagé (Hatanaka et al., 1987 ; Siedow, 1991).
6La voie de la lipoxygénase peut être utilisée de manière efficace comme outil technologique dans la conversion de quantités importantes d'huiles végétales en produits et flaveurs à haute valeur ajoutée, si on prend en considération les interactions entre les différentes réactions d'une part, et entre les réactions et leur milieu environnant d'autre part.
2. Enzymes de la voie de la lipoxygénase
7La présence d'un mécanisme chez les plantes qui catalyse l'oxydation des lipides par l'oxygène est connue depuis plus de 70 ans (André et al., 1932). La voie de la lipoxygénase chez les plantes est équivalente à la cascade de l'acide arachidonique chez les animaux (Helmer et al., 1979 ; Buchanan et al., 1985 ; Buchanan et al., 1986 ; Grossi et al., 1989 ; Benincasa et al., 2003). Cette voie est activée suite à une blessure ou à une agression des tissus par des pathogènes ou encore suite à un stress chimique ou mécanique. La voie métabolique de la lipoxygénase est constituée d'une suite de réactions enzymatiques qui catalysent la transformation d'acides gras polyinsaturés en une large variété de composés.
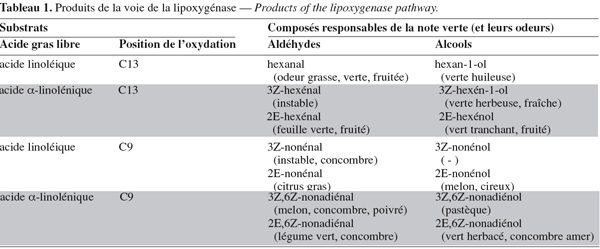
8La première étape de la voie consiste en la libération d'acides gras polyinsaturés à partir de triacylglycérols par une lipase. La lipoxygénase transforme ensuite les acides gras polyinsaturés (acide linoléique et acide linolénique) ayant une structure (Z)1, (Z)4-pentadiénique en 9- ou 13-hydroperoxyde de l'acide gras correspondant (Fauconnier et al., 1997a). Ces hydroperoxydes sont clivés par l'hydroperoxyde-lyase pour donner un aldéhyde et un oxo-acide (Gardner, 1991 ; Gargouri, 2001b). Les aldéhydes peuvent être enfin réduits en alcools avec l'alcool-déshydrogénase. Par ailleurs, les hydroperoxydes sont des composés très réactifs (Vick et al., 1988 ; Drouet et al., 1994) et peuvent être transformés par d'autres enzymes et notamment, l'allène oxyde synthase qui produit le précurseur de l'acide jasmonique. La divinyle éther synthase transforme les hydroperoxydes en divinyle éther d'acides gras (Delcarte et al., 2000).
2.1. Lipase
9Les lipases font partie de la classe des hydrolases d'esters carboxyliques et ont pour classification internationale : glycérol-ester-hydrolase (E.C 3.1.1.3) (Verger, 1985). Les lipases sont largement présentes chez les plantes et chez les animaux ainsi que chez les microorganismes. Ces enzymes appartiennent au groupe des sérines hydrolases et n'exigent la présence d'aucun cofacteur nécessitant la régénération pour leur activité. Contrairement aux estérases qui ont un comportement cinétique de Michaelis, les lipases sont faiblement actives en présence d'une solution monomérique vraie d'esters. Quand on augmente la concentration en substrat, l'activité de la lipase est considérablement accrue avec un substrat insoluble (comme l'émulsion). Les lipases ont été définies comme une catégorie spéciale d'estérases efficaces dans l'hydrolyse de molécules agrégées (Sarda et al., 1958 ; Mohapatra et al., 1997).
10Le pH optimum de l'activité lipasique est généralement autour de 7. Le pH agit non seulement sur l'activité enzymatique mais aussi sur les propriétés de l'interface dans un système multi-phasique ainsi que sur la solubilité des réactifs dans le milieu. Par ailleurs, l'hydrolyse catalysée par une lipase peut être affectée par la présence de différents cations (Ca2+, Al3+, Fe3+, Zn2+, K+) et activée en présence de sels biliaires (Caillat et al., 1970). Certains systèmes biphasiques (organique/aqueux) sont utilisés pour des réactions d'hydrolyse d'huiles ou de graisses catalysées par des lipases. Des études cinétiques en milieux biphasiques ou en micelles inverses démontrent que le comportement d'une lipase n'est pas le même quand elle catalyse l'hydrolyse ou l'estérification. En effet, une activité hydrolytique importante ne correspond pas forcément à une activité de synthèse élevée elle aussi (Van Tol et al., 1995 ; Crooks et al., 1995 ; Wu et al., 1996).
11Plusieurs études ont apprécié l'efficacité de l'immobilisation des lipases (Malcata et al., 1990 ; Malcata et al., 1991 ; Lilja-Hallberg et al., 1995 ; Balcão et al., 1996 ; Wen-Wei et al., 2005). En 1996, Sanchez et al. ont comparé le comportement cinétique de la lipase de Candida cylindracea soluble avec la forme immobilisée sur différents supports. L'enzyme immobilisée catalyse l'hydrolyse et l'estérification avec une meilleure affinité vis-à-vis de son substrat, mais avec une vitesse moins importante qu'avec l'enzyme libre. La réaction d'hydrolyse en milieu biphasique (organique/aqueux) permet la solubilisation de substrats hydrophobes en grandes quantités. Une réaction d'hydrolyse de triacylglycérols catalysée par la lipase de C. cylindracea a été optimisée en milieu biphasique avec un solvant apolaire comme phase organique : isooctane et cyclohexane (Kim et al., 1984). Yang et al. (1995) ont démontré pour deux lipases différentes en réaction d'hydrolyse que le milieu biphasique permet la solubilisation de l'enzyme en grandes concentrations et offre une meilleure productivité par rapport au milieu microaqueux et aux micelles inverses.
12Plus de 1,5 millions de tonnes d'acides gras sont produites annuellement à partir de différentes huiles et graisses. L'hydrolyse chimique conventionnelle est conduite en procédés lourds avec déroulement de réactions secondaires indésirables. La réaction enzymatique permet d'éviter ces inconvénients. Comparée au procédé de Colgate-Emery d'hydrolyse d'huiles et de graisses à la vapeur, une approche enzymatique en présence de lipase donne l'avantage d'avoir un coût énergétique moins important et une efficacité plus importante. Le bioprocédé est spécialement utile dans le cas de préparation d'acides gras hautement insaturés, qui sont facilement susceptibles de polymériser et de se décomposer à haute température (Fu et al., 1995). Le coût du procédé enzymatique peut être sérieusement baissé avec l'immobilisation et la réutilisation de la lipase (Taylor et al., 1991 ; Kuncová et al., 1994) et par le développement de réacteurs continus (Kosugi et al., 1990 ; Yang et al., 1992 ; Kawano et al., 1994). Dans le secteur agro-alimentaire, l'application la plus importante des lipases, d'un point de vue tonnage, est la modification des matières grasses par interestérification ou acidolyse.
2.2. Lipoxygénase
13Les lipoxygénases (EC 1.13.11.12) possèdent un atome de fer non-héminique (Braidot et al., 2003). Chez les plantes, les produits immédiats de la lipoxygénase sont des hydroperoxy-acides gras (HPO) à (Z, E)-diène conjugué. Ces enzymes sont largement distribuées dans les règnes végétal (Galliard et al., 1971 ; Hatanaka et al., 1992 ; Fauconnier et al., 1995) et animal (DeWolf, 1991 ; Ford-Hutchinson et al., 1994), et chez certains micro-organismes (Matsuda et al., 1979). Chez les plantes, les lipoxygénases sont généralement classées selon la position spécifique d'oxygénation de l'acide linoléique : 9-lipoxygénase ou 13-lipoxygénase (Gilabert et al., 2002 ; Yokota et al., 2003). La lipoxygénase a été découverte dans les graines de soja par André et al. en 1932. Les lipoxygénases de ces graines ont été purifiées et nombre de leurs propriétés physicochimiques et enzymatiques sont actuellement bien connues. Plusieurs travaux sur la lipoxygénase ont été effectués par la suite (Yamamoto et al., 1970 ; Nicolas et al., 1981 ; Vliegenthart et al., 1982 ; Kühn et al., 1991 ; Veldink et al., 1991). Pinsky et al. (1971) ont dressé une large liste d'organes de plantes contenant l'activité lipoxygénase. La localisation de la lipoxygénase chez les plantes dépend de l'âge de l'organe et de l'environnement de la plante (Vernooy Gerritsen et al., 1983 ; Clark et al., 1991 ; Kato et al., 1992).
14Kermasha et al. (2002) ont immobilisé la lipoxygénase de soja dans un système micellaire. Ils ont montré que l'enzyme immobilisée est beaucoup plus stable que l'enzyme libre. Elle présente une activité maximale à 70 °C. Leur recherche a également montré qu'à 100 °C, la lipoxygénase garde 50 % de son activité enzymatique alors qu'elle est complètement perdue à 90 °C dans l'enzyme libre. L'une des caractéristiques technologiques de la réaction de lipoxygénation est la conversion d'un substrat hydrophobe en un produit hydrophile. En milieu purement aqueux, les acides gras sont faiblement solubles et ne peuvent pas être solubilisés dans l'eau à forte concentration. Plusieurs paramètres ont été étudiés en milieux non conventionnels pour éviter ce problème. L'activité lipoxygénase a été étudiée sous différentes atmosphères d'oxygène dans le but d'améliorer l'oxydation de l'acide linoléique sans altérer la régiosélectivité (Iacazio et al., 1990 ; Kermasha et al., 2002). Plusieurs travaux ont testé la lipoxygénation en présence d'une phase non-aqueuse dans le milieu, en plus de celle aqueuse avec ou sans surfactant (Calpin et al., 1977 ; Piazza, 1992). Des systèmes biphasiques (tampon borate pH 6,5/hexane) ont été testés par le groupe de Hiruta (Hiruta et al., 1988) avec des réactions d'oxydation catalysées par la lipoxygénase-1 du soja sur l'acide γ-linolénique initialement dissous dans l'hexane. La réaction à 10 °C en présence de surfactant produit de l'acide 9-hydroperoxy-γ-linolénique.
15La recherche dans notre groupe s'intéresse particulièrement à la production d'hydroperoxy-acides en milieux biphasiques (tampon borate/octane). Drouet et al. (1994) ont amélioré le rendement de production du 13S-hydroperoxy-acide linoléique à fortes concentrations d'acide linoléique en utilisant la lipoxygénase-1 du soja dans un système biphasique agité. De plus, le comportement cinétique de l'enzyme dans un tel système a été étudié en milieu biphasique macrohétérogène (Gargouri et al., 1996). Nous avons montré que le transfert de masse est affecté par l'évolution de la réaction puisque le substrat (acide linoléique) et le produit (hydroperoxyde) sont des composés tensio-actifs (Gargouri et al., 1996). Un changement du comportement cinétique a été aussi observé quand la lipoxygénase-1 est utilisée en micelles inverses (Kurganov et al., 1989 ; Perez Gilabert et al., 1992). Rodakiewicz-Nowak et al. (1996) ont observé une diminution significative de l'influence du pH sur l'activité de la lipoxygénase dans de tels milieux. Les hydroperoxydes issus de la lipoxygénation sont des composés très actifs et peuvent être utilisés comme matière première dans la fabrication de produits à haute valeur ajoutée.
2.3. Hydroperoxyde-lyase
16L'hydroperoxyde-lyase est largement distribuée dans le règne végétal. Cette enzyme catalyse le clivage de l'hydroperoxy-acide linoléique ou linolénique au niveau de la liaison située entre le carbone porteur de la fonction hydroperoxyde et la double liaison E adjacente pour donner un aldéhyde et un oxo-acide selon le substrat de départ. Chez les plantes, ces enzymes peuvent être classées en deux groupes :
17– une activité hydroperoxyde-lyase qui catalyse la scission de 9-hydroperoxy-acide gras pour donner un C9-oxo-acide et un C9-aldéhyde. Cette activité est retrouvée dans les poires (Kim et al., 1981 ; Gargouri et al., 1998)
18– une activité catalysant le clivage de 13-hydroperoxy-acide gras pour donner un C12-oxo-acide et un C6-aldéhyde (Hatanaka et al., 1981), a été mise en évidence dans les tomates (Matthew et al., 1978 ; Hatanaka et al., 1992 ; Suurmeiger et al., 2000), les feuilles de tomate (Fauconnier et al., 1997b ; Atwal et al., 2005), les plantules de pastèque (Vick et al., 1976), les feuilles de pastèque (Fukushige et al., 2005), l'hypocotyle et les feuilles de tournesol (Itoh et al., 1999), les graines du soja (Matoba et al., 1985), les feuilles de thé (Hatanaka et al., 1976), les feuilles d'épinard (Blée et al., 1996), l'olive (Salas et al., 1999), les feuilles du tabac (Hong et al., 2004) et les feuilles de menthe (Gargouri et al., 2004b). Dans les cotylédons du concombre, les deux isoenzymes sont retrouvées (Sekiya et al., 1979), elles sont également retrouvées dans les graines de petit pois (Hornostaj et al., 2000) et dans le melon (Tijet et al., 2001).
19Les deux activités correspondent à deux enzymes différentes séparées par Matsui et al. (1989). Noordermeer et al. (1999) ont détecté dans la luzerne, en plus des activités 13- et 9-hydroperoxyde-lyase, une activité 3Z-2E-enal isomérase responsable de l'isomérisation de l'aldéhyde insaturé. Une autre enzyme spécifique des 10-hydroperoxy-acides gras est retrouvée chez les champignons et donne l'alcool 1-octen-3-ol et l'acide 10-oxo-8E-décénoïque comme produits (Assaf et al., 1995).
20La fixation membranaire de l'hydroperoxyde-lyase et sa nature hydrophobe rendent sa récupération complexe. Ajouté à cette propriété, il faut aussi prendre en compte le manque de stabilité de l'enzyme. L'utilisation d'un détergent ainsi que d'agent stabilisant est alors nécessaire pour sa solubilisation et sa stabilisation (Olías et al., 1990 ; Kondo et al., 1995 ; Zhuang et al., 1996 ; Matsui et al., 1996 ; Gargouri et al., 1998). L'activité lyasique est modulée par le stade physiologique de la plante. D'une manière générale, l'activité est importante dans les cellules en division et chute quand celles-ci passent en phase stationnaire (Delcarte et al., 2000). Shibata et al. (1995) ont partiellement purifié l'hydroperoxyde-lyase du poivron vert et ont montré qu'elle présente une masse moléculaire de 170 kDa et qu'elle est constituée de trois sous-unités d'environ 55 kDa chacune. L'enzyme a été également purifiée à partir de l'hypocotyle du tournesol (Blée et al., 1996). Elle présente une masse moléculaire de 200 kDa et existe sous forme d'un tétramère. L'hydroperoxyde-lyase présente un pH optimal proche de la neutralité se situant entre 5,5 et 8, suivant la source à partir de laquelle l'enzyme est extraite et la nature du substrat de départ. Matsui et al. (1996) ont montré que l'hydroperoxyde-lyase du poivron est une protéine héminique ayant des propriétés spectrophotométriques très proches des cytochromes P450. Ceci a été confirmé par les travaux de Noordermeer et al. (2001) sur la luzerne. Itoh et al. (1999) ont également montré que l'activité lyasique du tournesol est significativement inhibée par les inhibiteurs des cytochromes P450.
21L'isozyme 9S-hydroperoxyde-lyase catalyse le clivage de 9S-hydroperoxy-acide en C9-oxo-acide et C9-aldéhyde : 3Z-nonénal à partir du 9S-hydroperoxyacide linoléique et (3Z,6Z)-nonadiénal à partir du 9S-hydroperoxy-acide linolénique. La double liaison 3Z des aldéhydes produits est instable et s'isomérise en 2E-isomère, spontanément ou par action enzymatique de l'énal-isomérase (Hatanaka et al., 1975 ; Galliard et al., 1976). Le clivage du 13S-hydroperoxy-acide donne un C12-oxo-acide et un C6-aldéhyde, comme l'hexanal à partir du 13S-hydroperoxy-acide linoléique et le 3Z-hexénal (isomérise en 2E-hexénal) à partir du 13S-hydroperoxy-acide linolénique (Hatanaka et al., 1977 ; Hatanaka et al., 1981). L'oxo-acide 9Z-dodécénoïque isomérise aussi en 10E-isomère.
22Un des avantages de la biosynthèse, par rapport à l'extraction des composés, est la possibilité d'utiliser des activités enzymatiques issues de différentes sources pour effectuer des réactions successives. Ces enzymes n'ont, dans beaucoup de cas, pas toutes des activités suffisantes dans le même organisme au même stade de développement. L'indisponibilité de l'une des enzymes de la voie et/ou de l'un des composés intermédiaires empêche la synthèse du produit final dans le tissu végétal. L'activité hydroperoxyde-lyase est, par exemple, très faible durant le développement des graines de soja (Sekiya et al., 1986) et durant le stockage, contrairement à la lipoxygénase (Trawatha et al., 1995). La farine de soja est donc généralement utilisée seulement comme source de lipoxygénase qui peut être couplée à une autre source d'hydroperoxyde-lyase. Delcarte et al. (2003) ont réussi à sur-exprimer une hydroperoxyde-lysase recombinante dans Escherichia coli et à produire jusqu'à 23 mg d'enzyme par litre dans un fermenteur de type batch.
23Les produits aldéhydes du clivage enzymatique des hydroperoxy-acides possèdent différentes odeurs dépendantes de leurs structures (Tableau 1). Le changement des proportions de ces aldéhydes et de leurs alcools correspondants donne une " odeur verte " caractéristique à différentes espèces végétales dépendant de leur environnement et de la saison (Sekiya et al., 1983 ; Hatanaka et al., 1995 ; Hatanaka, 1996).
2.4. Alcool-déshydrogénase
24L'alcool-déshydrogénase (EC 1.1.1.1) est la dernière enzyme impliquée dans la production d'alcools aromatisants par la voie de la lipoxygénase. Elle catalyse, en présence d'un cofacteur, la conversion d'aldéhydes en alcools ou inversement. L'activité alcool-déshydrogénase est présente chez les plantes, les animaux et les microorganismes. La spécificité de l'alcool-déshydrogénase vis-à-vis du coenzyme et du substrat est variable et dépend de son origine (Boleda et al., 1993). Le sens de la catalyse (hydrogénation ou oxydation) dépend de la disponibilité du cofacteur et de la présence d'inhibiteurs ou d'activateurs. L'activité alcool-déshydrogénase extraite à partir de plantes demeure faible et instable. Des activités alcool-déshydrogénases connues chez certains animaux et microorganismes peuvent être utilisées dans la production de C6- et C9- alcools en application de la voie de la lipoxygénase.
25La grande diversité pour l'alcool-déshydrogénase chez les microorganismes a été observée au niveau de la structure et de la spécificité (Geerlof et al., 1992). L'alcool-déshydrogénase de levure de boulangerie est la plus étudiée. L'alcool-déshydrogénase de levure est une enzyme NAD-dépendante et présente la capacité d'oxyder une grande variété de substrats, mais son activité diminue avec l'augmentation de la taille des alcools (Green et al., 1993).
26L'implication du NAD/NADH dans la réaction de l'alcool-déshydrogénase constitue une limitation pour l'application de la réaction de conversion, vu la nécessité de régénérer le cofacteur après chaque utilisation. Legoy et al. (1985) ont étudié la production d'aldéhydes de longues chaînes par l'ADH de foie de cheval en présence de NAD où ils ont proposé trois méthodes pour sa régénération : système chimique en présence de 1-méthoxy phénazyne méthosulfate, système bi-enzymatique avec la lactate déshydrogénase et méthode de substrats couplés avec l'acétaldéhyde comme second substrat. Ces méthodes peuvent être appliquées dans plusieurs procédés enzymatiques qui nécessitent l'intervention d'un coenzyme dissociable. Un système de régénération du cofacteur a été testé par Yang et al. (1995) qui ont couplé l'alcool-déshydrogénase de levure avec une lipase dans des micelles inverses dans le but de produire des aldéhydes à partir d'esters. Par ailleurs, l'alcool-déshydrogénase de levure peut être utilisé en industrie pour la production de C9- et C6-alcools comme le Z3-hexénol à partir des aldéhydes correspondants dans un procédé enzymatique (Brunerie, 1989 ; Gargouri et al., 2004 ; Ben Akacha et al., 2005).
3. Molécules aromatisantes produites par la voie de la lipoxygénase
27La voie de la lipoxygénase constitue une voie en plein essor du moment où les consommateurs affirment leur préférence pour les aromatisants naturels et freinent la progression de l'utilisation des arômes synthétiques dans les produits alimentaires et, dans une certaine mesure, les produits de parfumerie. La production des composés aromatisants par cette voie biotechnologique offre des perspectives nouvelles aux industries des arômes et des parfums, ainsi qu'aux industries alimentaires. Plusieurs produits et intermédiaires de cette voie sont d'une importance considérable en technologies alimentaire et pharmaceutique. Cette voie de biosynthèse est présente dans différents tissus chez les plantes comme dans les feuilles et les fruits, et fait intervenir différentes réactions enzymatiques. L'étude de la biosynthèse des produits finaux nécessite la compréhension et le contrôle de toutes les réactions enzymatiques impliquées.
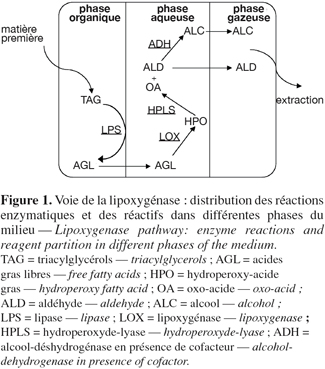
28Un des avantages les plus intéressants des milieux non-conventionnels par rapport aux systèmes aqueux pour la biocatalyse est la possibilité d'utiliser des réactifs (substrats et produits) ayant des propriétés physico-chimiques différentes, même à fortes concentrations. Avant le choix du milieu de bioconversion, une meilleure connaissance des substrats, des intermédiaires et des produits finaux est utile (Figure 1).
3.1. Matière première
29Avec la modernisation des outils de l'agriculture, plusieurs cultures, comme les plantes à huile riches en acides gras polyinsaturés, sont en train de saturer le marché classique. Ces huiles (huiles de tournesol, lin, colza, soja, etc.) peuvent être utilisées comme substrat initial pour la voie de la lipoxygénase. Comme plusieurs lipides complètement estérifiés, les triacylglycérols sont insolubles dans l'eau. Ils peuvent, en revanche, être solubilisés en grandes concentrations dans des solvants organiques. La réaction hydrolytique catalysée par des lipases prend place généralement au niveau de l'interface entre les phases organique et aqueuse. L'hydrolyse des triacylglycérols produit des diacylglycérols, monoacylglycérols et glycérols avec libération d'acides gras à chaque étape. Ce changement de composition durant la lipolyse est accompagné de changements temporels de la distribution des constituants entre les phases (Verger, 1984).
30Le type de triacylglycérol est un facteur très important qui affecte l'activité et la productivité de la réaction avec la lipase. Fu et al. (1995) ont démontré que plus l'huile renferme des acides gras insaturés, plus rapide est l'hydrolyse de triacylglycérols. Les huiles de soja et d'olive (fortement insaturées) sont hydrolysées plus rapidement par rapport aux autres huiles. Vu la facilité de leur hydrolyse, les huiles fortement insaturées permettent d'utiliser des concentrations en enzyme et des temps de réaction réduits pour une hydrolyse complète. La séparation des différents acylglycérols et des acides gras libérés peut être réalisée par RP-HPLC (Gargouri et al., 1997a).
3.2. Acides gras libres
31Les acides gras libres sont les produits de l'hydrolyse des triacylglycérols. Ils sont faiblement solubles dans l'eau et cette caractéristique dépend de la nature de chaîne carbonée et des conditions environnementales (pH, température). Dans un milieu organique/aqueux, les acides gras sont transférés lentement de la phase organique à la phase aqueuse. A température ordinaire, les acides gras insaturés sont liquides (huiles) et les acides gras saturés sont solides (graisses), à l'exception des acides à chaînes carbonées courtes.
32Les acides gras polyinsaturés avec un pentadiényl-1Z,4Z sont les seuls substrats de la lipoxygénase en présence d'oxygène moléculaire. L'acide linoléique, l'acide α-linolénique et l'acide γ-linolénique, substrats naturels des lipoxygénases végétales, sont les acides gras en C-18 prépondérants dans le règne des plantes. L'acide linoléique est reconnu comme le substrat préféré de la lipoxygénase-1 du soja, grâce à son faible taux d'auto-oxydation, son rendement de conversion important et l'absence d'effet irréversible apparent sur l'activité enzymatique (Egmond et al., 1976). Dans un environnement spécial, la lipoxygénase-1 peut réagir avec des esters méthyliques d'acides gras (Kühn et al., 1991), des acylglycérols ou des phosphoglycérides (Piazza et al., 1995 ; Piazza et al., 1996). L'hydrolyse d'huile peut être mesurée par titrage d'acides gras libérés à partir d'une émulsion dans l'eau utilisant un pH-stat (Gargouri et al., 1997a ; Ghamgui et al., 2004).
3.3. Hydroperoxy-acides gras
33Le produit de la lipoxygénation est un monohydroperoxyde optiquement actif contenant des doubles liaisons conjuguées E-Z (Funk et al., 1976 ; Axelrod et al., 1981 ; Takagi et al., 1987). Ce produit intermédiaire est hydrophile et reste dans le compartiment polaire dans un milieu hétérogène (Figure 1). La lipoxygénase d'origine végétale agit essentiellement sur les acides gras ayant 18 atomes de carbone. En présence de l'acide linoléique, la lipoxygénase fixe l'oxygène sur le carbone 13 ou 9 de l'acide gras pour donner respectivement le 13- et le 9-hydroperoxy-acide linoléique. Les 13S et 9S-hydroperoxy-acide linoléniques sont produits quand le substrat est l'acide linolénique. La spécificité de la lipoxygénase varie suivant la source végétale. Le 13-hydroperoxy-acide gras représente le produit majeur de la lipoxygénase des graines du soja (Galliard et al., 1971 ; Matoba et al., 1985), c'est aussi le cas pour le melon (Vick et al., 1976) et le concombre (Sekiya et al., 1979). Chez la tomate, la lipoxygénase produit majoritairement le 9-hydroperoxy-acide gras (Hatanaka et al., 1992), la même spécificité est retrouvée dans la pomme de terre (Sekiya et al., 1977 ; Gargouri et al., 2002 ; Fauconnier et al., 2002 ; Gargouri et al., 2003). Chez Aspergillus niger, la lipoxygénase produit d'une manière significative le 10-hydroperoxy-acide gras. Ce dernier représente 15 à 21 % du total des isomères produits à partir de l'acide linoléique et de l'acide linolénique (Hall et al., 2004). Dans les conditions optimales, la lipoxygénase-1 de soja produit de 80 % (Egmond et al., 1972) à 100 % (Christopher et al., 1971) de 13S-hydroperoxy-acide linoléique à partir d'acide linoléique. Cette spécificité n'est pas aussi prononcée dans d'autres espèces comme le blé (Jolivet et al., 1988). La présence de la fonction carboxylique permet au substrat acide gras d'avoir deux positions possibles dans le site actif de la lipoxygénase, donnant le 9- dans un cas et le 13-isomère dans l'autre (Walstra et al., 1987). Suivant Gardner (1989), l'acide gras n'est pas ionisé à pH neutre et sa conversion donne les deux isomères suivant les deux positions possibles sur le site actif. A pH suffisamment alcalin, la forme anionique du substrat peut avoir son extrémité méthyle seulement en bas du site actif et produit donc uniquement l'isomère 13S. Ceci confirme l'importance du choix du pH pour de tels systèmes de conversion.
34Dans un travail précédent (Gargouri et al., 1996), nous avons démontré que l'hydroperoxy-acide et l'acide linoléique, ayant des propriétés tensio-actives, favorisent le transfert de masse à travers l'interface liquide-liquide dans un milieu biphasique. Ceci peut sérieusement affecter l'évolution des concentrations de réactifs dans le bioréacteur et doit être considéré dans les opérations de modélisation (Gargouri et al., 1996 ; Gargouri et al., 1997c). L'auto-oxydation d'acides gras en hydroperoxy-acides est possible mais elle est 106 à 108 fois plus lente que l'oxydation enzymatique en présence de concentrations modérées en oxygène. La réaction spontanée n'est ni stéréosélective ni régiosélective. Elle nécessite la présence de formes activées d'oxygène (O2•- ; H2O2 ; OH• ; 1O2) ou de radicaux libres oxygénés (ROO• ; RO•) (Schewe et al., 1991).
35Les hydroperoxy-acides sont détectés à 234 nm, vu la présence de doubles liaisons conjuguées. La régiosélectivité peut être déterminée après la séparation des isomères d'hydroperoxy-acides avec de la silice sur HPLC (Gargouri et al., 1997b). Les produits hydroperoxy-acides de la lipoxygénation sont des composés très réactifs. Les radicaux hydroperoxydes des lipides sont capables d'endommager la structure et l'organisation membranaires, tout comme les molécules d'ADN, protéines et acides aminés (Gardner, 1979). Plusieurs enzymes végétales métabolisent les hydroperoxy-acides, produits de la lipoxygénation, comme la lipoxygénase elle-même, hydroperoxyde-isomérase, hydroperoxyde-déshydrase, hydroperoxyde-cyclase, époxygénase hydroperoxyde-dépendante et hydroperoxyde-lyase (Vick et al., 1988 ; Gardner, 1991).
3.4. Aldéhydes et alcools
36Chez les végétaux supérieurs, les produits finaux issus de la voie de la lipoxygénase, comme les aldéhydes et les alcools, se caractérisent par des propriétés aromatiques spécifiques. Ces composés volatils caractérisant plusieurs tissus végétaux, spécialement les feuilles vertes, sont responsables de l'odeur fraîche de l'herbe coupée dite " note verte ". Chaque composé présente une odeur spécifique délicatement différente des autres (Tableau 1). La variation des concentrations de ces composés conduit à une odeur verte caractéristique émise par le tissu vert, dépendant de son environnement.
37En réponse à différents stimuli, les feuilles émettent une odeur verte caractéristique à des concentrations variées. Ces différences dans la composition sont utilisées par la plante pour communiquer avec ou se défendre d'autres espèces. Les aldéhydes en C6 présentent une activité antifongique et peuvent être impliqués dans le mécanisme de défense de la plante (Croft et al., 1993). Ils peuvent également inhiber la germination de diverses espèces de graines (Gardner et al., 1990) et jouer le rôle de molécule-signal dans le citron (Gomi et al., 2003). Matsui et al. (2006) ont montré que les C9-aldéhydes présentent une activité anti-fongique contre les pathogènes Botrytis cinerea et Fusarium oxisporum. Bisignano et al. (2001) ont montré que les aldéhydes en C6 et C9 contenant une α,β-insaturation présentent une activité antimicrobienne vis-à-vis des microorganismes Gram + et Gram -.
38Les participants majeurs à la note verte fraîche sont " l'aldéhyde de feuille ", 2E-héxénal et " l'alcool de feuille ", 3Z-héxénol. Les deux composés sont largement utilisés dans les parfums et en technologie alimentaire. La production mondiale est de plus de 50 tonnes d'aldéhyde de feuille par an et plus de 250 tonnes d'alcool de feuille par an, obtenus essentiellement par des procédés chimiques. Dans certains aliments ou parfums, un ou plusieurs composés de la note verte sont utilisés pour donner un caractère vert ainsi qu'une impression de fraîcheur. L'utilisation séparée de l'un ou de plusieurs de ces arômes est très recherchée. Ceci ne peut être atteint que par la voie biotechnologique qui permet la production sélective du produit volatil désiré. La voie de la lipoxygénase constitue une application intéressante permettant d'augmenter la pureté des molécules aromatisantes recherchées. Ainsi, le type du produit final dépend de la sélectivité de l'enzyme utilisée, de la composition de la matière première et des conditions de réaction et d'extraction. L'utilisation des enzymes de la lipoxygénase est promue par la demande croissante de tout type de produit naturel. L'industrie des flaveurs est concernée par cette évolution puisque les arômes naturels sont perçus comme étant meilleurs que les synthétiques, spécialement dans les pays développés.
39La quantification directe des produits volatils dans le milieu de la réaction est possible par les techniques d'espace de tête dynamique ou statique couplées à la chromatographie en phase gazeuse (Frankel, 1980 ; Lee et al., 1995 ; Gargouri et al., 1998). Les composés volatils sont récupérés du milieu de bioréaction en utilisant la pervaporation organophilique, l'extraction par le CO2 supercritique ou essentiellement le procédé classique de distillation à la vapeur.
4. Application de la voie de la lipoxygénase dans la production biotechnologique de molécules aux propriétés aromatiques
40Plusieurs publications et brevets rapportent des études sur des réacteurs et procédés pour la préparation d'arômes verts ou de produits intermédiaires de la voie de la lipoxygénase. Cette partie s'intéresse à l'optimisation de méthodes de préparation d'odeurs vertes fraîches à partir de matière grasse végétale. L'optimisation concerne toutes les réactions enzymatiques impliquées dans la voie de la lipoxygénase. La diversité au niveau des caractéristiques des composés est l'élément majeur à prendre en compte dans l'application de ce genre de systèmes enzymatiques (Figure 1).
4.1. Production d'hydroperoxy-acides gras à partir de triacylglycérols
41L'acide gras polyinsaturé, produit de l'hydrolyse lipasique, est le substrat de la lipoxygénase. Ces deux réactions peuvent être mises en œuvre successivement dans le même réacteur dans un environnement favorable au déroulement de chacune d'elles. Nous avons étudié, dans un milieu compartimenté (cellule de Lewis modifiée) (Gargouri et al., 1997b), le comportement d'un système bi-enzymatique : hydrolyse lipasique de trilinoléine suivie d'une lipoxygénation d'acides gras libérés. Notre approche consiste en une comparaison du comportement cinétique des enzymes couplées dans le réacteur avec une étude séquentielle de phénomènes séparés : hydrolyse, transfert de masse et lipoxygénation. Le système a été modélisé en utilisant un programme d'intégration numérique.
42Les lipases sont capables de catalyser un bon nombre de réactions d'hydrolyse et de synthèse en présence de différents substrats. Le type de substrat est le facteur clé affectant l'activité et la productivité pour une réaction catalysée par une lipase. Ces enzymes ont montré une grande stabilité en milieux partiellement ou totalement composés de solvant organique. Plusieurs systèmes biphasiques organique / aqueux sont utilisés pour l'hydrolyse lipidique (Kim et al., 1984 ; Yang et al., 1995 ; Fu et al., 1995 ; H-Kittikun et al., 2000). Dans la voie de la lipoxygénase, le substrat de la première réaction est un triacylglycérol d'acides gras polyinsaturés, insoluble dans l'eau et qui peut être solubilisé en grandes concentrations dans un solvant hydrophobe. La réaction d'hydrolyse catalysée par la lipase prend place au niveau de l'interface organique / eau ou notamment huile / eau. L'acide gras libre produit est faiblement soluble dans l'eau. La phase aqueuse sert donc comme réservoir à biocatalyseur. La lipoxygénation a lieu dans la solution aqueuse. L'hydroperoxyde produit est hydrophile et demeure donc dans la phase aqueuse (Figure 1).
43Dans le système de couplage lipase / lipoxygénase, le taux de conversion est contrôlé essentiellement par la première réaction enzymatique et par le transfert de masse. Quand la concentration initiale du substrat est petite, la courbe cinétique a une allure sigmoïde, ce qui est dû aux propriétés tensio-actives de l'acide gras et de l'hydroperoxyde (Gargouri et al., 1996). La connaissance du lieu de la réaction et de ses interactions avec le transfert de masse dans le milieu biocatalytique est d'une importance clé pour le design du procédé. L'habilité de la lipoxygénase à catalyser l'oxygénation d'acides gras polyinsaturés en milieu hétérogène a été étudiée dans certains travaux (Calpin et al., 1977 ; Piazza, 1992). L'influence de plusieurs paramètres a été testée sur le degré d'oxygénation dans les systèmes biphasiques organique / aqueux (Drouet et al., 1994 ; Rodakiewicz-Nowak et al., 1996).
44Dans des travaux précédents (Gargouri et al., 1997a ; Gargouri et al., 1997b), nous avons étudié la productivité d'un système bi-enzymatique : lipase-lipoxygénase en milieu biphasique (octane / tampon borate). L'hydrolyse et la lipoxygénation ont été couplées dans le même réacteur pour améliorer le rendement de production des hydroperoxydes à partir de triacylglycérols.
45Les rendements de réaction dépendent de la nature du substrat. Il a été optimisé dans le système bi-enzymatique en utilisant des substrats purs (triacylglycérols) ainsi que des huiles végétales brutes riches en acides gras polyinsaturés (huile de tournesol ou huile de lin). L'utilisation de réactifs bruts s'approche de la réalité industrielle. En utilisant l'huile de tournesol (acide linoléique présent à plus de 60 %), le système bi-enzymatique produit exclusivement l'hydroperoxy-acide linoléique avec des rendements importants. Des lipases en poudre ou immobilisées ont été couplées avec la lipoxygénase-1 du soja pure ou en extrait aqueux à 10 % (m/v). L'interface liquide / liquide contrôle le transfert à la phase aqueuse des intermédiaires et des produits qui apparaissent durant l'hydrolyse (diacylglycérols, monoacylglycérols, acides gras saturés) ; la lipoxygénase agit donc exclusivement sur les acides gras polyinsaturés. La qualité du produit n'a pas été altérée dans le système bi-enzymatique. L'inhibition exercée sur l'enzyme par les intermédiaires est réduite dans ce système. La présence d'une phase organique dans le milieu permet une grande solubilité des acylglycérols et une partition bien contrôlée des réactifs dans le réacteur. Les hydroperoxydes obtenus (récupérés à 96-99 % dans la phase aqueuse) sont des molécules très réactives (Capella, 1989). En plus de leur rôle dans la voie de la lipoxygénase, ces composés sont précurseurs pour la synthèse d'hydroxy-acides comme l'acide (+)-coriolique (Martini et al., 1994 ; Gargouri et al., 1997b) et régulateurs de la biosynthèse de prostaglandines (Helmer et al., 1979 ; Buchanan et al., 1985 ; Buchanan et al., 1986). L'approche décrite ici peut être transférée à une échelle plus large pour la production d'hydroperoxy-acides gras à partir de grandes concentrations de triacylglycérols avec une extraction facile.
46Fauconnier et al. (1996) ont décrit la transformation de l'acide linolénique contenu dans l'huile de lin en 13-hydroperoxy-acide linolénique en présence de la lipoxygénase de soja dans un réacteur de 10 l. Le rendement de conversion varie de 60 à 94 % selon la concentration du substrat de départ.
4.2. Production d'aldéhydes et d'alcools à partir de composés intermédiaires
47Les composés en C6 les plus simples sont préparés en industrie par voie chimique. Dans le cas où la molécule renferme plus d'une insaturation, les industriels commencent à s'intéresser à l'extraction des produits à partir des plantes qui les produisent. Cependant, cette technique très coûteuse ne fournit que de petites quantités de produits et ne répond pas à la demande du marché. C'était la raison qui a le plus motivé les efforts de recherche pour trouver des voies naturelles alternatives susceptibles de satisfaire la demande croissante en ces composés. Ceci a contribué au développement de procédures biotechnologiques comme pour la biosynthèse de la note verte via la voie de la lipoxygénase pour produire ces composés volatils désirés à partir de précurseurs lipidiques.
48Chacun des composés en C6 et en C9, aldéhydes et alcools obtenus à la fin de cette voie, a son odeur fraîche délicatement spécifique, qui peut être utilisée dans différentes applications. La synthèse efficace de composés volatils spécifiques nécessite :
49– l'utilisation d'un substrat pur, soit le 13- ou le 9-hydroperoxy-acide gras, ceci a été expliqué dans le sous-titre précédent,
50– des activités spécifiques 13S- ou 9S-lyases qui donnent respectivement des C6- ou C9-aldéhydes,
51– une extraction efficace qui évite les transformations secondaires affectant le produit,
52– un couplage de deux ou plusieurs réactions dans le même réacteur en présence d'hydroperoxyde-lyase, alcool-déshydrogénase et/ou d'autres enzymes.
53Des solutions d'hydroperoxydes ont été utilisées comme substrats pour l'hydroperoxyde-lyase provenant de différentes plantes. L'activité enzymatique dépend de la source et aussi de la nature du substrat. En utilisant des activités 13S-lyase spécifiques, les rendements obtenus par le clivage d'hydroperoxy-acide linoléique sont plus importants que ceux avec l'hydroperoxy-acide linolénique (Whitehead, 1995 ; Hatanaka, 1996). La réaction se déroule avec une grande vitesse et est généralement complète en moins d'une heure. Quand le produit volatil de clivage contient une insaturation 3Z, l'aldéhyde instable s'isomérise en son 2E-isomère plus stable (Tableau 1). Németh et al. (2004) ont produit 1,6 mM du 2E-hexénal et 5,9 mM du 3Z-hexénal à partir d'huile de lin hydrolysée et oxydée et en présence de l'hydroperoxyde-lyase extraite du poivron vert. Ces mêmes auteurs ont montré que durant la distillation, le rapport molaire des isomères 2 E-hexénal : 3Z-hexénal change de 0,27 à 7,86 suite au traitement par la chaleur.
54Schade et al. (2003) ont utilisé des enzymes immobilisées extraites à partir de différents tissus de plantes, tels que les feuilles de tomate et de fraisier, pour produire de l'hexanal. Les tissus renfermant des biocatalyseurs ont été immobilisés dans une matrice d'alginate dans un réacteur à lit fixe. L'utilisation des conditions optimales a permis de produire 80,2 µg d'hexanal par g de matière fraîche de feuilles de tomate et 22,4 µg par g de matière fraîche de feuilles de fraisier. Cette production est 112 fois plus importante que la quantité endogène produite par la même quantité du tissu végétal utilisé.
55Dans un travail précédent, nous avons étudié la synthèse spécifique d'hexanal et d'hexénals respectivement à partir d'acides 13S-hydroperoxy-linoléique et 13S-hydroperoxy-linolénique (Gargouri et al., 2004b). D'abord, l'étude de l'influence de la température sur le clivage en présence d'extrait aqueux de menthe a montré que la production optimale d'hexanal se fait à 15 °C. Le pH optimum est à 7, ce qui peut être un avantage intéressant sur le plan industriel lors d'une éventuelle application de la bioconversion étudiée dans l'eau sans régulation de pH. Des quantités considérables d'hexanal (jusqu'à 2,58 μmoles) ont été produites par la scission de l'acide 13S-hydroperoxy-linoléique spécialement en présence d'extrait de Mentha viridis. La production d'aldéhyde est accrue en augmentant la concentration en substrat jusqu'à 10 mM. Le taux de conversion atteint 52,5 % puis diminue en fonction de la concentration initiale en substrat. La production d'hexénal a été moins importante que celle de l'hexanal. Dans le système étudié, la réaction et la purge des composés volatiles sont effectuées successivement dans le même flacon sans délai d'attente ni aucun contact avec l'atmosphère. Une isomérisation très limitée du 3Z- en 2E-hexénal a donc été observée. Lors de la production d'aldéhyde en présence d'extrait de menthe fraîchement cueillie, les taux de conversion ont été améliorés (Gargouri et al., 2004b). Les produits obtenus ont été identifiés par GC-MS.
56Plusieurs travaux ont essayé de convertir in situ les aldéhydes en leurs alcools correspondants en utilisant l'alcool-déshydrogénase. La levure de boulangerie (Saccharomyces cerevisiae) a été utilisée par Gargouri et al. (2004a) comme source de cette activité pour produire de l'hexénol à partir de l'hexénal. Nous avons couplé l'alcool-déshydrogénase de levure et l'hydroperoxyde-lyase extraite à partir des feuilles de menthe dans le but de produire de l'hexénol en une seule étape à partir des hydroperoxy-acides gras. Ceci a montré que le couplage des deux enzymes augmente la vitesse de conversion des hydroperoxy-acides gras. Dans le but de mieux comprendre la cinétique dans le même système bi-enzymatique, nous avons utilisé un modèle mathématique (Ben Akacha et al., 2005). Le modèle a permis de suivre l'évolution théorique de l'aldéhyde et de l'alcool en fonction du temps et de la comparer à leur évolution expérimentale.
57Le 3Z-hexénal et le 3Z-hexénol sont largement employés dans les compositions aromatiques pour leur donner une note verte et fraîche. Leurs isomères 2E-hexénal et 2E-hexénol sont beaucoup plus stables, donnant cependant des odeurs différentes des premiers. Dans un système de production d'alcool à partir d'hydroperoxy-acide gras, quand l'alcool-déshydrogénase est ajouté au milieu réactionnel après déroulement de la première réaction de scission, le produit de clivage (3Z-aldéhyde) subit une isomérisation en 2E-isomère avant le début de la deuxième réaction. Ceci résulte en une production prédominante du 2E-alcool par réduction de l'aldéhyde correspondant. Par ailleurs, l'activité alcool-déshydrogénase peut être mélangée simultanément avec l'hydroperoxyde-lyase pour convertir principalement le 3Z-aldéhyde en 3Z-alcool, évitant l'isomérisation de la double liaison (Gargouri et al., 2004a). D'après Brunerie (1989), une excellente sélectivité de production de 3Z-hexénal par rapport au 2E-hexénal est marquée pour des températures se situant entre 0 et 20 °C.
58Le 3Z-hexène-1-ol appelé " alcool de feuille " peut être produit par la voie de la lipoxygénase à partir d'acide linolénique. Sa qualité unique et le volume de sa consommation donnent à ce composé une importance spéciale dans le domaine des arômes chimiques. Malgré sa large distribution dans la nature, les préparations commerciales disponibles en général sont produites chimiquement. La voie de biosynthèse est une alternative très importante pour obtenir ce composé.
59Matoba et al. (1989) ont rapporté que le n-hexanol est produit enzymatiquement à partir du n-hexanal dans des extraits de graines de soja, à pH alcalin et température importante (proche de 60 °C). Ceci suggère que l'incubation d'un homogénat de graines de soja dans ces conditions provoque la diminution de concentration d'hexanal en faveur d'hexanol durant la préparation de lait de soja ou de protéines de soja. Les auteurs ont prouvé que cette réduction est due à l'activité de l'alcool-déshydrogénase. Par ailleurs, cette enzyme peut être utilisée dans d'autres conditions en présence de NAD+ comme cofacteur pour la production d'aldéhydes à longue chaîne comme le n-hexanal à partir du n-hexanol en utilisant différentes méthodes de régénération du cofacteur (Legoy et al., 1985 ; Lortie et al., 1989).
60Il a été démontré que les arômes verts peuvent être produits à échelle industrielle en mélangeant des acides gras polyinsaturés avec du matériel végétal riche en activités enzymatiques de la voie de la lipoxygénase. Plusieurs brevets ont décrit la production d'aldéhydes et d'alcools à longues chaînes à partir d'huiles végétales utilisant la voie de la lipoxygénase. La synthèse peut être effectuée à partir d'acide linolénique ou d'un précurseur introduit sous forme d'hydrolysat. Les fanes de radis broyées, source de l'hydroperoxyde-lyase, constituent le système enzymatique utilisé par Brunerie (1989) pour produire des aldéhydes à partir d'hydroperoxy-acides. Dans un brevet américain (Kanisawa et al., 1988), une méthode de préparation d'arômes verts a été inventée en utilisant des graines de soja broyées avec ou sans activité additionnelle de lipase. La conversion a eu lieu dans un milieu fortement agité sous air stérile ou oxygène. Des exemples représentatifs de substrat ont été utilisés comme les huiles de soja, lin, olive, cacao, colza, maïs, tsubaki, blé, sésame, noix, son de riz, ricin, grain de raisin, palme et noix de coco, en plus d'autres matières grasses animales. La bioconversion a lieu entre 25 et 50 °C durant 0,5 à 10 h jusqu'à formation des composés aromatisants. Ces composés ont les propriétés de composés naturels.
61Dans un autre brevet de la " General Foods Corporation " (Goers et al., 1989), un procédé de production d'essence de " green leaf " a été développé contenant dans le mélange : les 3Z-hexénol, 2E-hexénal et 3Z-hexénal. Des feuilles de fraisier ont été utilisées comme source de catalyseur biochimique. La matière première a été l'acide linolénique ou de l'huile de lin hydrolysée chimiquement (riche à environ 50 % en acide linolénique). Dans le bioréacteur, les acides gras polyinsaturés sont oxygénés en présence de la lipoxygénase et les 13-hydroperoxydes sont alors clivés par l'hydroperoxyde-lyase. Finalement, l'alcool-déshydrogénase est capable de réduire les aldéhydes aux alcools correspondants. En plus des composés cités, la conversion de l'huile de lin produit de l'hexanal et de l'hexanol en faible pourcentage, dû à la présence d'une faible teneur en acide linoléique dans l'huile. Après production, l'homogénat doit être traité rapidement dans les 8 heures qui suivent pour éviter la dégradation des flaveurs et/ou la production de mauvaises odeurs. L'homogénat est donc évaporé sous vide avant sa condensation. Le mélange est ensuite passé sur un adsorbant alimentaire : résine hydrophobe non-ionique, pour isoler les composés volatils. Après élution par la vapeur ou par un solvant (éthanol ou isopropanol de 50 à 95 % dans l'eau), le mélange aromatique est produit de préférence sous forme de mélange avec l'alcool utilisé pour l'élution.
62Dans des fruits de concombre (Galliard et al., 1976) et de poire (Kim et al., 1981), une hydroperoxyde-lyase a été détectée. Elle clive l'hydroperoxy-acide linoléique en acide oxo-nonanoïque et 3Z-nonénal. Ce C9-aldéhyde a une odeur de concombre intense et a une importance croissante dans les industries cosmétique et alimentaire. L'aldéhyde isomérise spontanément en 2E-isomère et peut être réduit en nonénol. Dans un précédent travail (Gargouri et al., 1998), nous avons étudié une procédure originale de synthèse de nonénal à partir de 9S-hydroperoxy-acide linoléique par clivage enzymatique suivi d'analyse précise de l'espace de tête. La production de C9-alcools utilisant l'hydroperoxyde-lyase de feuilles de violette et l'alcool-déshydrogénase de levure de boulangerie a fait l'objet d'un brevet (Hausler et al., 2000). Ces derniers ont trouvé que l'addition d'un mélange de précurseurs d'acides gras polyinsaturés en fonction de la réaction présente un effet favorable sur la réaction enzymatique. Ce processus a permis d'avoir 600 mg du 2E-6Z nonadiénal par kilo de matériel végétal et plus que 10 mg du 2E-6Z nonadiénol par kilo de matériel végétal. Kerler et al. (2005) ont décrit la production de composés volatils par action de l'hydroperoxyde-lyase et en utilisant comme précurseurs l'huile de lin et l'huile du tournesol. L'oxydation de l'huile de lin a permis de produire majoritairement le 2E-hexénal (20150 ppm), son isomère moins stable ; 3Z-hexénal est obtenu à l'ordre de 10380 ppm. Ils ont également produit les C9-aldehydes et alcools. Le composé C9 majoritaire étant le 2,6 nonadiénal (8900 ppm). Lorsque l'huile de tournesol a été utilisée comme substrat, il n'y a production que de 125 ppm de 3Z-hexénal et de 5250 ppm d'hexanal. D'après Brash et al. (2006), le melon renfermant les deux activités enzymatiques spécifiques des 9 et des 13 hydroperoxy-acides gras, le 9 hydroperoxy-acide gras étant le substrat préférentiel de l'enzyme. L'activité enzymatique est meilleure à des pH proches de 7. Elle perd 25 % et 15 % de son activité maximale respectivement aux pH 5 et 9. Les composés volatils issus de la réaction de cette enzyme ont été analysés par GC-MS. Les 3Z-nonénal et 2E-nonénal sont les composés majeurs avec un ratio de 10:1.
63Brunerie et Koziet ont optimisé dans un brevet de 1997 la production des C6-alcools à partir des acides gras polyinsaturés provenant de l'hydrolysat de l'huile de lin. L'hydroperoxyde-lyase est extraite à partir de feuilles de plantes et l'activité alcool-déshydrogénase provient de la levure de boulangerie. Ces auteurs ont étudié l'effet des différents facteurs sur le rendement de production des C6-alcools. Ils ont démontré qu'en présence de 1 mM d'acide salicylique, la concentration de 3Z-hexénol produit est de l'ordre de 425 ppm. Elle augmente de 24 % par rapport au témoin. L'acide salicylique constitue un inhibiteur de la voie métabolique secondaire entraînant la formation des dérivés de l'acide jasmonique. En utilisant l'homogénat de goyave comme source de l'activité hydroperoxyde-lyase et la levure de boulangerie comme source de l'alcool-déshydrogénase, Muller et al. (1995) ont à leur tour produit de l'hexénal (5g.kg-1), avec un rendement global de 36 %, 4,2 g de 3Z-hexénol.kg-1, 1,5 g du 2E-hexénal.kg-1 et 0,6 g du 2E-hexénol.kg-1 du milieu réactionnel. Holtz et al. (2001) ont utilisé l'hydroperoxyde-lyase extraite à partir de différentes plantes pour produire des composés aromatiques. Une quantité de 990 µg de 3Z-hexénol par g de matière végétale fraîche est produite suite à l'utilisation d'Amarantus retroflexus comme source d'activité lyasique. En utilisant les feuilles de pastèque, la production du 3Z-hexénol était de l'ordre de 843 µg par g de matière fraîche. L'utilisation de l'acide linolénique comme substrat et la levure de boulangerie comme source de l'alcool-déshydrogénase a permis d'obtenir 71 % de 3Z-hexénol, 29 % de 3Z-hexénal et l'absence de 2E-hexénal.
64Les composés volatils décrits dans cette section peuvent être utilisés comme matière de base dans des mélanges dans l'industrie alimentaire et celle du parfum.
5. Avantages et inconvénients des procédés et méthodes proposés
65Dans la structure cellulaire, les réactions enzymatiques ont lieu dans des compartiments et des microenvironnements différents (Ginsburg et al., 1970). Dans le même sens, l'étude de réactions successives d'une voie métabolique dans un bioréacteur multiphasique présente une alternative utile pour l'industrie approchant les systèmes trouvés dans la nature. Wilson et al. (1968) et Brown et al. (1968) ont été les premiers à discuter des systèmes enzymatiques séquentiels fixés sur des supports insolubles. Dans un travail antérieur, nous avons étudié la productivité d'une réaction bienzymatique : hydrolyse lipasique de triacylglycérols et lipoxygénation d'acides gras polyinsaturés dans un système biphasique (Gargouri et al., 1997a ; 1997b ; 1997c). Ce couplage a non seulement permis de réduire le nombre d'étapes de conversion mais a aussi augmenté le rendement total de production des hydroperoxy-acides à partir de triacylglycérols. L'inhibition d'enzymes par excès des composés intermédiaires est ainsi réduite. Ce système permet non seulement de réduire le nombre d'étapes, mais permet aussi d'augmenter le rendement total comparé aux deux réactions séparées. Dans le système de couplage, il y a un avantage catalytique de la proximité des enzymes et de leurs substrats. La présence de la deuxième enzyme accélère et augmente la consommation du premier substrat (triacylglycérol), puisque la lipoxygénase réagit avec l'acide gras polyinsaturé qui lui est produit par la première réaction. Les études cinétiques de tels réacteurs multi-enzymatiques peuvent nous aider à mieux comprendre l'interaction du transfert de masse et du métabolisme en milieux compartimentés (Gargouri et al., 1997c). Ces connaissances peuvent faciliter l'extension de tels systèmes à une échelle préparative. Comme la voie de la lipoxygénase est composée de quelques réactions enzymatiques faisant intervenir des substrats et des produits de propriétés physico-chimiques différentes, son étude efficace ainsi que son utilité en technologie demande le couplage des différentes étapes en systèmes hétérogènes.
66Pour atteindre une efficacité optimale au niveau des procédés de production de composés volatils par la voie de la lipoxygénase, la tendance est à l'utilisation d'extraits végétaux comme sources de lipoxygénase et/ou hydropéroxyde-lyase. La meilleure source d'alcool-déshydrogénase reste la levure. La matière première fournissant les acides gras est généralement un hydrolysat d'huile de graine. Pour améliorer les rendements de production d'arôme par cette voie, différentes conditions physico-chimiques ont été proposées. Certains proposent l'addition d'agents ou d'enzymes comme Brunerie et Koziet (1997) qui ont réussi à augmenter le rendement de production de 3Z-hexénol de 342 à 417 ppm par addition de la chlorophylle B lors de l'extraction. L'ajout de la catalase a aussi entraîné une augmentation de 20 % de la concentration de 3Z-hexénol qui passe de 342 a 412 ppm. La catalase forme de l'oxygène et de l'eau à partir de peroxyde d'hydrogène, ce dernier étant un sous-produit de l'activité enzymatique impliqué dans l'oxydation de l'acide gras et dans l'inhibition de l'activité enzymatique.
6. Conclusion
67L'utilisation de la voie de la lipoxygénase pour la conversion de lipides en produits à haute valeur ajoutée a permis aux chercheurs et aux industriels de contribuer à la valorisation d'huiles végétales, abondantes dans la nature. Grâce à cette voie, des molécules aromatisantes sont produites suite à une bioconversion de matières grasses présentes dans les sous-produits et les produits sous-exploités de l'industrie, et en présence d'activités enzymatiques essentiellement extraites à partir de matière première végétale.
68Des procédés à différentes échelles efficaces, économiques et respectueux de l'environnement ont été développés pour la production de note verte à partir de matière première naturelle renouvelable. Les recherches en génie enzymatique ont contribué à l'amélioration de l'efficacité des procédés par l'étude de l'utilisation de systèmes multi-enzymatiques et de bioréacteurs compartimentés. Plus de recherche est attendue pour développer les performances des enzymes impliquées dans la voie d'oxydation, leur production et/ou extraction, leur stabilité et le procédé de la réaction. L'extraction et le stockage de composés intermédiaires ainsi que les produits finaux doivent être améliorés pour accroître le rendement total. Dans notre groupe, la recherche est en cours pour développer un système continu de biotransformation spécifique d'huiles de graines en molécules aromatisantes.
Bibliographie
André E. & Hou K., 1932. Sur la présence d'une oxydase des lipides ou lipoxydase dans la graine de soja. C. R. Acad. Sci., 194, 645-647.
Assaf S., Hadar Y. & Dozoretz C.G., 1995. Biosynthesis of 13-hydroperoxylinoleate, 10-oxo-8-decenoic acid, and 1-octen-3-ol from linoleic acid by a mycelial-pellet homogenate of Pleurotus pulmonarius. J. Agric. Food Chem., 43, 2173-2178.
Atwal A.S. et al., 2005. Cloning and secretion of tomato hydroperoxyde-lyase in Pichia pastoris. Process Biochem., 40, 95-102.
Axelrod B., Cheesbrough T.M. & Laakso S., 1981. Lipoxygenase from soybeans. Methods Enzymol., 71, 441-451.
Balcão V.M., Paiva A.L. & Malcata X., 1996. Bioreactors with immobilized lipases: state of the art. Enzyme Microb. Technol., 18, 392-416.
Ben Akacha N., Boubaker O. & Gargouri M., 2005. Production of hexenol in two-enzyme system: kinetic study and modelling. Biotechnol. Lett., 27, 1875-1878.
Benincasa C., De Nino A., Lombardo N. & Tagarelli A., 2003. Assay of aroma active components of virgin olive oils from southern Italian regions by SPME-GC/Ion trap mass spectrometry. J. Agric. Food Chem., 51, 733-741.
Bisignano G. et al., 2001. In vitro antibacterial activity of some aliphatic aldehydes from Olea europea L. FEMS Microbiol. Lett., 198, 9-13.
Blée E. & Joyard J., 1996. Envelope membrane from spinach chloroplasts are a site of metabolism of fatty acid hydroperoxides. Plant Physiol., 110, 445-454.
Boleda M.D., Saubi N., Farrés J. & Pares X., 1993. Physiological substrates for rat alcohol dehydrogenase classes: aldehydes of lipid peroxidation, hydroxyfatty acids, and retinoids. Biochem. Biophys., 307, 85-90.
Braidot E. et al., 2003. Immunochemical evidence for the presence of a lipoxygenase 1 in isolated plasma membranes from soybean cotyledons. Plant Sci., 164, 9-16.
Brash A., Tijet N. & Whitehead I.M., 2006. Muskmelon (Cucumis melo) hydroperoxide lyase and uses thereof. US Patent, 7, 037, 693.
Brown H.D., Patel A.B. & Chattopadhyay A., 1968. Lattice entrapment of glycolytic enzymes. J. Chromatogr., 35, 103-105.
Brunerie P., 1989. Procédé de synthèse du cis-3-hexène-1-ol à partir d'acide gras insaturé. Brevet Français, 89, 12 901.
Brunerie P. & Koziet Y., 1997. Process for producing natural cis-3-hexenol from unsaturated fatty acids. US Patent, 5, 620, 879.
Buchanan M.R., Haas T.A., Lagarde M. & Guichardant M., 1985. 13-hydroxyoctadecadienoic acid is the vessel wall chemorepellant factor. J. Biol. Chem., 260(30), 16056-16059.
Buchanan M.R. et al., 1986. Role of lipoxygenase metabolism in platelet function: effect of aspirin and salicylate. Prostaglandins leukotrienes Med., 21, 157-168.
Caillat J.M. & Drapron R., 1970. Influence des sels biliaires et des ions calcium sur l'hydrolyse des triglycérides en émulsion par la lipase de gemmule de blé germé. Bull. Soc. Chim. Biol., 52(1), 59-73.
Calpin J.R. & Allen J.C., 1977. The influence of micelle formation on lipoxygenase kinetics. Biochim. Biophys. Acta, 488, 392-401.
Capella P., 1989. Les produits de l'évolution des hydroperoxydes. Etud. Rech., 4, 313-323.
Christopher J.P. & Axelrod B., 1971. On the different positional specificities of peroxydation of linoleate shown by two isozymes of soybean lipoxygenase. Biochem. Biophys. Res. Commun., 44, 731-736.
Clark P.K. & Snyder H.E., 1991. Hydroperoxide formation in soybean seeds during storage. J. Am. Oil Chem. Soc., 68(5), 346-347.
Croft K.P.C., Jüttner F. & Slusarenko A.J., 1993. Volatile products of the lipoxygenase pathway evolved from Phaseolus vulgaris (L.) leaves inoculated with Pseudomonas syringae pv phaseolicola. Plant Physiol., 101, 13-24.
Crooks G.E. et al., 1995. Comparison of hydrolysis and esterification behavior of Humicola lanuginosa and Rhisomucor miehei lipases in AOT stabilized water in oil microemulsions: II. Effect of temperature on reaction kinetics and general consideration of stability and productivity. Biotechnol. Bioeng., 48, 190-196.
Delcarte J. et al., 2000. L'hydroperoxyde lyase. Biotechnol. Agron. Soc. Environ., 3, 157-167.
Delcarte J. et al., 2003. Optimisation of expression and immobilized metal ion affinity chromatographic purification of recombinant (His)6- tagged cytochrome P450 hydroperoxide lyase in Escherichia coli. J. Chromatogr. B, 786, 229-236.
DeWolf W.E., 1991. Enzymatic studies on purified 5-lipoxygenase. In: Crooke S.T. & Wong A., eds. Lipoxygenases and their products. Orlando, Florida, USA: Academic Press, 105-136.
Drouet P., Thomas D. & Legoy M.D., 1994. Production of 13(S)-hydroperoxy-9(Z),11(E)-octadecadienoic acid using soybean lipoxygenase 1 in a biphasic octane-water system. Tetrahedron Lett., 35(23), 3923-3926.
Egmond M.R., Vliegenthart J.F.G. & Boldingh J., 1972. Stereospecificity of the hydrogen abstraction at carbon n-8 in the oxygenation of linoleic acid by lipoxygenases from corn germ and soya beans. Biochem. Biophys. Res. Commun., 48, 1055-1060.
Egmond M.R., Brunori M. & Fasella P.M., 1976. The steady state kinetics of the oxygenation of linoleic acid catalysed by soybean lipoxygenase. Eur. J. Biochem., 61, 93-100.
Fauconnier M.-L. et al., 1995. Assessment of lipoxygenase activity in seed extracts from 35 plant species. Grasas Aceites, 46(1), 6-10.
Fauconnier M.-L. & Marlier M., 1996. An afficient procedure for the production of fatty acid hydroperoxides from hydrolysed flax seed oil and soybean lipoxygenase. Biotechnol. Tech., 10, 839-844.
Fauconnier M.-L. & Marlier M., 1997a. Revue bibliographique : les lipoxygénases du soja. Biotechnol. Agron. Soc. Environ., 1(2), 125-141.
Fauconnier M.-L., Perez A.G., Sanz C. & Marlier M., 1997b. Purification and characterization of tomato leaf (Lycopersicon Esculentum Mill.) hydroperoxide lyase. J. Agric. Food Chem., 45(11), 4232-4236.
Fauconnier M.-L. et al., 2002. Fatty acid hydroperoxides biotransformation by potato tuber cell-free extracts. J. Plant Physiol., 159, 1055-1060.
Feussner I., Kühen H. & Wasternack C., 2001. Lipoxygenase-dependent degradation of storage lipids. Trends Plant Sci., 6, 268-273.
Fischer A.M. et al., 1999. Protein dynamics, activity and cellular localization of soybean lipoxygenases indicate distinct functional roles for individual isoforms. Plant J., 19, 543-554.
Ford Hutchinson A.W., Gresser M. & Young R.N., 1994. 5-Lipoxygenase. Annu. Rev. Biochem., 63, 383-417.
Frankel E.N., 1980. Lipid oxidation. Prog. Lipid Res., 19, 1-22.
Fu X., Zhu X., Gao K. & Duan J., 1995. Oil and fat hydrolysis with lipase from Aspergillus sp. J. Am. Oil Chem. Soc., 72(5), 527-531.
Fukushige H. & Hildebrand D.F., 2005. Watermelon (Citrullus lanatus) hydroperoxide lyase greatly increases C6 aldehyde formation in transgenic leaves. J. Agric. Food Chem., 53(6), 2046-2051.
Funk M.O., Isaac R. & Porter N.A., 1976. Preparation and purification of lipid hydroperoxides from arachidonic and g-linolenic acids. Lipids, 11(2), 113-117.
Galliard T. & Phillips D.R., 1971. Lipoxygenase from potato tubers. Partial purification and properties of an enzyme that specifically oxygenates the 9-position of linoleic acid. Biochem. J., 124, 431-438.
Galliard T. & Phillips D.R., 1976. The enzymatic cleavage of linoleic acid to C9 carbonyl fragments in extracts of cucumber (Cucumis Sativus) fruit and the possible role of lipoxygenase. Biochim. Biophys. Acta, 431, 278-287.
Gardner H.W., 1979. Lipid hydroperoxide reactivity with proteins and amino acids: a review. J. Agric. Food Chem., 27(2), 220-229.
Gardner H.W., 1989. Soybean lipoxygenase-1 enzymically forms both (9S)and (13S)-hydroperoxides from linoleic acid by a pH dependent mechanism. Biochim. Biophys. Acta, 1001, 274-281.
Gardner H.W., Dornbos D.L. & Desjardins A.E., 1990. Hexanal, trans-2-hexenal, and trans-2-nonenal inhibit soybean, glycine max, seed germination. J. Agric. Food Chem., 38, 1316-1320.
Gardner H.W., 1991. Recent investigations into the lipoxygenase pathway of plants. Biochim. Biophys. Acta, 1084, 221-239.
Gargouri M., 2001a. Biocatalysis in liquid-liquid biphasic media: coupled mass transfer and reaction. In: Volkov A., ed. Liquid interfaces in chemical, biological and pharmaceutical application. Surfactant Series. New York, USA: Marcel Dekker, 553-584.
Gargouri M., 2001b. Valorization of vegetable oils using the lipoxygenase pathway: flavor biosynthesis. In: Pandalai S.G., ed. Recent research development in oil chemistry. Trivandrum, Kerala, India: Transworld Research Network, 13-37.
Gargouri M., Drouet P., Hervagault J.F. & Legoy M.-D., 1996. Investigation of behaviour of an enzyme in a biphasic system: soybean lipoxygenase-1. Biotechnol. Bioeng., 51(5), 573-580.
Gargouri M. & Legoy M.-D., 1997a. Bi-enzymatic reaction for hydroperoxide production in a multiphasic system. Enzyme Microb. Technol., 21(2), 79-84.
Gargouri M. & Legoy M.-D., 1997b. Chemoenzymatic production of (+)-coriolic acid from trilinolein: coupled synthesis and extraction. J. Am. Oil Chem. Soc., 74(6), 641-645.
Gargouri M. & Legoy M.-D., 1997c. The kinetic behaviour of a two-enzyme system in a biphasic medium: coupling hydrolysis and lipoxygenation. Biochim. Biophys. Acta, 1337, 227-232.
Gargouri M. & Legoy M.-D., 1998. Biosynthesis and analysis of 3Z-nonenal. Biotechnol. Lett., 20, 23-26.
Gargouri M. & Legoy M.-D., 2002. A two-enzyme system for the transformation of unsaturated oils to 9(S)-hydroperoxy fatty acids. Biotechnol. Lett., 24, 915-918.
Gargouri M. & Legoy M.-D., 2003. Potato tuber lipoxygenase: some properties and application in two-enzyme system for 9(S)-hydroperoxy fatty acid synthesis. Biol. Tunis., 1(2), 25-28.
Gargouri M., Ben Akacha N. & Legoy M.-D., 2004a. Coupled hydroperoxide lyase and alcohol dehydrogenase for selective synthesis of aldehyde or alcohol. Appl. Biochem. Biotechnol., 119, 171-180.
Gargouri M., Drouet P. & Legoy M.-D., 2004b. Hydroperoxide-lyase in mint leaves volatile C6-aldehyde production from hydroperoxy-fatty acids. J. Biotechnol., 111(1), 59-65.
Geerlof A., Van Tol J.B.A., Jongejan J.A. & Duine J.A., 1992. Microbial alcohol/aldehyde oxidoreductases in enantioselective conversions. In: Servi S., ed. Microbial reagents in organic synthesis. Amsterdam: Kluwer, 411-420.
Ghamgui H., Karra-Chaabouni M. & Gargouri Y., 2004. 1-Butyl oleate synthesis by immobilized lipase from Rhizopus oryzae: a comparative study between n-hexane and solvent-free system. Enzyme Microb. Technol., 35, 355-363.
Gilabert M.P. & Carmona F.G., 2002. Chromatographic analysis of lipoxygenase products. Anal. Chim. Acta, 465, 319-335.
Ginsburg A. & Stadtman E.R., 1970. Multienzyme system. Ann. Rev. Biochem., 39, 429-472.
Godfrey T. & West S., 1986. Industrial enzymology, 2d ed. London: Macmillan Press.
Goers S.K., Ghossi P., Peterson J.T. & Young C.L., 1989. Process for producing a green leaf essence. US Patent, 4, 806, 379.
Gomi K., Yamasaki Y., Yamamato H. & Akimitsu K., 2003. Characterization of a hydroperoxide lyase gene and effect of C6-volatiles on expression of gene of the oxylipin metabolism in Citrus. J. Plant Physiol., 160, 1219-1231.
Green D.W., Sun H.W. & Plapp B.V., 1993. Inversion of the substrate specificity of yeast alcohol dehydrogenase. J. Biol. Chem., 268, 7792-7798.
Grossi I.M. et al., 1989. Bidirectional control of the membrane expression and/or activation of the tumor cell IRGpIIb/IIIa receptor and tumor cell adhesion by lipoxygenase products of arachidonic acid and linoleic acid. Cancer Res., 49, 1029-1037.
H-Kittikun A., Prasertsan P. & Sungpud C., 2000. Continuous production of fatty acids from palm olein by immobilized lipase. J. Am. Oil Chem. Soc., 77, 599-609.
Hall C.E., Husson F. & Kermasha S., 2004. Characterization of an enriched lipoxygenase extract from Aspergillus niger in terms of specificity and nature of flavor precursors production. J. Mol. Catal. B: Enzymatic, 29, 201-209.
Hatanaka A., 1993. The biogeneration of green odour by green leaves. Phytochemistry, 34(5), 1201-1218.
Hatanaka A., 1996. The fresh green odor emitted by plants. Food Rev. Int., 12(3), 303-350.
Hatanaka A., Kajiwara T. & Harada T., 1975. Biosynthetic pathway of cucumber alcohol: trans-2,Cis-6-nonadienol via Cis-3, Cis-6-nonadienal. Phytochemistry, 14, 2589-2592.
Hatanaka A., Kajiwara T. & Sekiya J., 1976. Biosynthesis of trans-2-hexenal in chloroplasts from Thea sinensis. Phytochemistry, 15, 1125-1126.
Hatanaka A., Sekiya J. & Kajiwara T., 1977. Enzyme system catalysing formation of cis-3-hexenal and n-hexanal from linolenic and linoleic acids in Japanese silver (Farfugium iaponicum Kitamura) leaves. Plant Cell Physiol., 18, 107-116.
Hatanaka A. & Kajiwara T., 1981. Occurrence of trans-3-hexenal in Thea sinensis leaves. Z. Naturforsch., 36, 755-756.
Hatanaka A., Kajiwara T. & Sekiya J., 1987. Biosynthetic pathway for C6-aldehydes formation from linolenic acid in green leaves. Chem. Phys. Lipids, 44, 341-361.
Hatanaka A., Kajiwara T., Matsui K. & Kitamura A., 1992. Expression of lipoxygenase and hydroperoxide lyase activities in tomato fruits. Z. Naturforsch., 47, 369-374.
Hatanaka A., Kajiwara T. & Matsui K., 1995. The biogeneration of green odour by green leaves and its physiological function past, present and future. Z. Naturforsch., 50(c), 467-472.
Hausler A., Ehret C. & Binggeli E., 2000. Process for the production of degradation products of fatty acids. US Patent, 6, 150, 145.
Helmer M.E., Cook H.W. & Lands W.E.M., 1979. Prostaglandin biosynthesis can be triggered by lipid peroxides. Arch. Biochem. Biophys., 193(2), 340-345.
Hiruta O. et al., 1988. Production of 9-hydroxy-gamma-linolenic acid by soybean lipoxygenase in a two-phase system. J. Am. Oil Chem. Soc., 65(12), 1911-1914.
Holtz R.B. et al., 2001. Method for providing green note compounds. US Patent, 6, 274, 358.
Hong M., Zilinskas B.A., Knipple D.C. & Chin C., 2004. Cis-3-hexenal production in tobacco is simulated by 16-carbon monounsaturated fatty acids. Phytochemistry, 65, 159-168.
Hornostaj A.R & Robinson D.S., 2000. Purification of hydroperoxide lyase from pea seeds. Food Chem., 71, 241-247.
Iacazio G. et al., 1990. Preparative enzymatic synthesis of linoleic acid (13S)-hydroperoxide using soybean lipoxygenase-1. J. Org. Chem., 55, 1690-1691.
Itoh A. & Vick B.A., 1999. The purification and characterization of fatty acid hydroperoxide lyase in sunflower. Biochim. Biophys., 1436, 531-540.
Jolivet P. & Bergeron E., 1988. Production of hydroperoxides and oxoenes during the oxidation of linoleic and linolenic acids by wheat foliar lipoxygenase. Plant Physiol. Biochem., 26(1), 55-63.
Kanisawa T. & Itoh H., 1988. Method for preparing green aroma compounds. US Patent, 4, 769, 243.
Kato T. et al., 1992. Lipoxygenase activity increment in infected tomato leaves and oxidation product of linolenic acid by its in vitro enzyme reaction. Biosci. Biotechnol. Biochem., 56(3), 373-375.
Kawano Y. et al., 1994. Hydrolysis of olive oil with lipase in a " VibroMixer ". J. Ferment. Bioeng., 78(4), 293-297.
Kerler J. et al., 2005. Method for the enzymatical preparation of flavors rich in C6-C10 aldehydes. US Patent, 6, 864, 072.
Kermasha S., Dioum N., Bisakowski B. & Vega M., 2002. Biocatalysis by immobilized lipoxygenase in a ternary micellar system. J. Mol. Catal. B: Enzymatic, 19(20), 305-317.
Kim I.S. & Grosch W., 1981. Partial purification and properties of a hydroperoxide lyase from fruits of pear. J. Agric. Food Chem., 29, 1220-1225.
Kim K.H., Kwon D.Y. & Rhee J.S., 1984. Effects of organic solvents on lipase for fat splitting. Lipids, 19(12), 975-977.
Kolomiets M.V. et al., 2001. Lipoxygenase is involved in the control of potato tuber development. Plant Cell, 13, 613-626.
Kondo Y., Hashidoko Y. & Mizutani J., 1995. An enzymatic formation of 13-oxo-trideca-9,11-dienoic acid from 13-hydroperoxylinolenic acid by a homolysis hydroperoxide lyase in elicitor treated soybean cotyledons. Biochim. Biophys. Acta, 1255, 9-15.
Kosugi Y., Tanaka H. & Tomizuka N., 1990. Continuous hydrolysis of oil by immobilized lipase in a countercurrent reactor. Biotechnol. Bioeng., 36, 617-622.
Kühn H. et al., 1991. Keto fatty acids not containing doubly allylic methylenes are lipoxygenase substrates. Biochemistry, 30, 10269-10273.
Kuncová G., Maléterova Y. & Lovecka P., 1994. Hydrolysis of rapeseed oil by lipase immobilized on inorganic oxide supports. Biotechnol. Tech., 8(8), 535-540.
Kurganov B.I. et al., 1989. Kinetics of soybean lipoxygenase reaction in hydrated reversed micelles. Biochimie, 71, 573-578.
Lee I., Fatemi S.H., Hammond E.G. & White P.J., 1995. Quantitation of flavor volatiles in oxidized soybean oil by dynamic headspace analysis. J. Am. Oil Chem. Soc., 72(5), 539-546.
Legoy M.-D., Kim H.S. & Thomas D., 1985. Use of alcohol dehydrogenase for flavour aldehyde production. Process Biochem., 20, 145-148.
Lilja-Hallberg M. & Harrod M., 1995. Enzymatic and non enzymatic esterification of long polyunsaturated fatty acids and lysophosphatidylcholine in isooctane. Biocatal. Biotransformation, 12, 55-66.
Lortie R., Villaume I., Legoy M.-D. & Thomas D., 1989. Enzymatic production of long chain aldehydes in a fixed bed reactor using organic solvents and cofactor regeneration. Biotechnol. Bioeng., 33, 229-232.
Malcata F.X. et al., 1990. Immobilized lipase reactors for modification of fats and oils. J. Am. Oil Chem. Soc., 67(12), 890-910.
Malcata F.X. et al., 1991. Kinetics and mechanisms of reactions catalysed by immobilized lipase. Enzyme Microb. Technol., 14(6), 426-446.
Martini D. et al., 1994. Optimization of large scale preparation of 13-(S)-hydroperoxy-9Z,11E-octadecadienoic acid using soybean lipoxygenase. Application to the chemoenzymatic synthesis of (+) coriolic acid. Biocatalysis, 11, 47-63.
Matoba T. et al., 1985. Lipoxygenase-2 isozyme is responsible for generation of n-hexanal in soybean homogenate. J. Agric. Food Chem., 33, 852-855.
Matoba T., Sakuraï A., Taninoki N. et al., 1989. n-Hexanol formation from n-hexanal by enzyme action in soybean extracts. J. Food Sci., 54(6), 1607-1610.
Matsuda Y., Deppu T. & Arima K., 1979. Heterogeneity of Fusarium lipoxygenase. Agric. Biol. Chem., 43(1), 189-190.
Matsui K., Shibata Y., Kajiwara T. & Hatanaka A., 1989. Separation of 13 and 9-hydroperoxide lyase activities in cotyledons of cucumber seedlings. Z. Naturforsch., 44, 883-885.
Matsui K., Kaji Y., Kajiwara T. & Hatanaka A., 1996. Developmental changes of lipoxygenase and fatty acid hydroperoxide lyase activities in cultured cells of Marchantia polymorpha. Phytochemistry, 41(1), 177-182.
Matsui K. et al., 2006. Biosynthesis of fatty acid derived aldehydes is induced upon mechanical wounding and its products show fungicidal activities in cucumber. Phytochemistry, 67, 649-657.
Matthew J.A. & Galliard T., 1978. Enzymatic formation of carbonyls from linoleic acid in leaves of Phaseolus vulgaris. Phytochemistry, 17, 1043-1044.
Mohapatra S.C. & Hsu J.T., 1997. Lipase kinetics in organic-water solvent with amphipathic substrate for chiral reaction. Biotechnol. Bioeng., 55(2), 399-407.
Muller B., Gautier A., Dean C. & Kuhn J.C., 1995. Process for the enzymatic preparation of aliphatic alcohols and aldehydes from linoleic acid, or a natural precursor. US Patent, 5, 464, 761.
Németh A. et al., 2004. Biocatalytic production of 2(E)hexenal from hydrolysed linseed oil. Enzyme Microb. Technol., 34, 667-672.
Nicolas J. & Drapron R., 1981. Les lipoxygénases végétales. Etat actuel de nos connaissances. 1. Aspects Biochimiques. Sci. Aliments, 1(1), 91-168.
Noordermeer M.A., Veldink G.A. & Vliegenthart J.F.G., 1999. Alfalfa contains substantial 9-hydroperoxide lyase activity and a 3Z:2E-enal isomerase. FEBS Letters, 443, 201-204.
Noordermeer M.A., Veldink G.A. & Vliegenthart J.F.G., 2001. Fatty acid hydroperoxide lyase: a plant cytochrome P450 enzyme involved in wound healing and pest resistance. Chembiochem, 2, 494-504.
Olías J.M. et al., 1990. Fatty acid hydroperoxide lyase in germinating soybean seedlings. J. Agric. Food Chem., 36, 624-630.
Pelmont J., 1995. Enzymes, catalyseurs du monde vivant. Grenoble, France : Presse Universitaire de Grenoble.
Perez Gilabert M., Sanchez Ferrer A. & Garcia Carmona F., 1992. Application of active phase plot to the kinetic analysis of lipoxygenase in reverse micelles. Biochem. J., 288, 1011-1015.
Piazza G.J., 1992. Lipoxygenase catalysed hydroperoxide formation in microemulsions containing nonionic surfactant. Biotechnol. Lett., 14(12), 1153-1158.
Piazza G.J. & Nuñez A., 1995. Oxidation of acylglycerols and phosphoglycerides by soybean lipoxygenase. J. Am. Oil Chem. Soc., 72(4), 463-466.
Piazza G.J., Foglia T.A. & Nuñez A., 1996. Soybean lipoxygenase promoted oxidation of free and esterified linoleic acid in the presence of deoxycholate. J. Am. Oil Chem. Soc., 73(8), 1045-1049.
Pinsky A., Grossman S. & Trop M., 1971. Lipoxygenase content and antioxidant activity of some fruits and vegetables. J. Food. Sci., 36, 571-572.
Porta H. & Rocha-Sosa M., 2002. Plant lipoxygenases. Physiological and molecular features. Plant Physiol., 130, 15-21.
Rodakiewicz-Nowak J., Maslakiewicz P. & Haber J., 1996. The effect of linoleic acid on pH inside sodium bis (2-ethylhexyl) sulfosuccinate reverse micelles in isooctane and on the enzymatic activity of soybean lipoxygenase. Eur. J. Biochem., 238, 549-553.
Salas J. & Sanchez J., 1999. Hydroperoxide lyase from olive (Olea europaea) fruits. Plant Sci., 143, 19-26.
Sanchez E.M. et al., 1996. Kinetic and enantioselective behavior of the lipase from Candida cylindracea: a comparative study between the soluble enzyme and the enzyme immobilized on agarose and silica gels. Enzyme Microb. Technol., 18, 468-474.
Sarda L. & Desnuelle P., 1958. Action of pancreatic lipase on emulsified esters. Biochim. Biophys. Acta, 30, 513-521.
Schade F., Thompson J.E. & Legee R., 2003. Use of plant-derived enzyme template foe. The production of the green-note volatile hexanal. Biotechnol. Bioeng., 84(3), 265-273.
Schewe T. & Kühn H., 1991. Do 15-lipoxygenase have a common biological role? Trend Biochem. Sci., 16(10), 369-373.
Sekiya J. et al., 1977. Purification and some properties of potato tuber lipoxygenase and detection of linoleic acid radical in the enzyme reaction. Agric. Biol. Chem., 41(5), 827-832.
Sekiya J., Kajiwara T. & Hatanaka A., 1979. Volatile C6-aldehyde formation via hydroperoxides from C18-unsaturated fatty acids in etiolated alfalfa and cucumber seedlings. Agric. Biol. Chem., 43(5), 969-980.
Sekiya J., Munechika K. & Hatanaka A., 1983. Further characterization of C6-aldehyde forming system in alfalfa cells cultured in vivo. Agric. Biol. Chem., 47(7), 1647-1648.
Sekiya J., Monma T., Kajiwara T. & Hatanaka A., 1986. Changes in activities of lipoxygenase and hydroperoxide lyase during seed development of soybean. Agric. Biol. Chem., 50, 521-522.
Shibata Y., Matsui K., Kajiwara T. & Hatanaka A., 1995. Fatty acid hydroperoxide lyase is a heme protein. Biochem. Biophys. Res. Commun., 207(1), 438-443.
Siedow J.N., 1991. Plant lipoxygenase: structure and function. Annu. Plant Physiol. Plant Mol. Biol., 42, 145-188.
Suurmeiger C.N.S.P. et al., 2000. Purification, stabilization and characterization of tomato fatty acid hydroperoxide lyase. Phytochemistry, 53, 177-185.
Takagi T., Wakasa N. & Miyashita K., 1987. Formation of conjugated diene and triene products in lipoxygenase oxidation of C18, C20, C22 PUFAs. J. Am. Oil Chem. Soc., 64(9), 1320-1323.
Taylor F. & Graig J.C., 1991. Scale up of flat plate reactor for enzymatic hydrolysis of fats and oils. Enzyme Microb. Technol., 13(12), 956-959.
Tijet N., Schneider C., Muller B.L. & Brash A.R., 2001. Biogenesis of volatile aldehydes from fatty hydroperoxides. Molecular cloning of hydroperoxide-lyase (CYP 74 C) with specificity for both 9- and 13-hydroperoxides of linoleic and linolenic acids. Arch. Biochem. Biophys., 386(2), 281-289.
Trawatha S.E., TeKrony D.M. & Hildebrande D.F., 1995. Relationship of soybean seed quality to fatty acid and C6-aldehyde levels during storage. Crop Sci., 35, 1415-1422.
Van Tol J.B.A. et al., 1995. Do organic solvents affect the catalytic properties of lipase? Intrinsic kinetic parameters of lipases in ester hydrolysis and formation in various organic solvents. Biotechnol. Bioeng., 47, 71-81.
Veldink G.A. & Vliegenthart J.F.G., 1991. Substrates and products of lipoxygenase catalysis. In: Atta ur Rahman A., ed. Studies in natural chemistry. Amsterdam, Holland: Elsevier Science Publishers, 559-589.
Verger R., 1984. Pancreatic lipases. In: Borgström B. & Brockman H.L., eds. The lipases. Amsterdam, Holland: Elsevier Medical Press, 83-150.
Verger R., 1985. Les enzymes lipolytiques. In : Mouranche A. & Costes C., eds. Hydrolases et dépolymérases. Enzymes d'intérêt industriel. Paris : Gauthier-Villars, 313-329.
Vernooy Gerritsen M., Bos A.L.M., Veldink G.A. & Vliegenthart J.F.G., 1983. Localization of lipoxygenases 1 and 2 in germinating soybean seeds by an indirect immunofluorescence technique. Plant Physiol., 73, 262-267.
Vick B.A. & Zimmerman D.C., 1976. Lipoxygenase and hydroperoxide lyase in germinating watermelon seedlings. Plant Physiol., 57, 780-788.
Vick B.A. & Zimmerman D.C., 1988. Oxidative systems for modification of fatty acids: the lipoxygenase pathway. In: Stumpf P.K. & Conn E.E., eds. The biochemistry of plants, a comprehensive treatise, 53-90.
Vliegenthart J.F.G. & Veldink G.A., 1982. Lipoxygenases. In: Pryor W.A., ed. Free radicals in biology. New York, USA: Academic Press, 29-64.
Walstra P., Verhagen J., Veldink G.A. & Vliegenthart J.F.G., 1987. 12-Lipoxygenase from bovine polymorphonuclear leucocytes, an enzyme with leukotriene A4-synthase activity. Biochem. Biophys. Res. Commun., 149(1), 258-265.
Wen-Wei X. & Jian-He X., 2005. Preparation of enantiopure (S)-ketoprofen by immobilized Candida rugosa lipase in packed bed reactor. Process Biochem., 40(6), 2161-2166.
Whitehead I.M., Muller B.L. & Dean C., 1995. Industrial use of soybean lipoxygenase for the production of natural green note flavor compounds. Cereal Foods World, 40(4), 193-197.
Wilson R.J.H., Kay G. & Lilly M.D., 1968. The preparation and the properties of pyruvate kinase attached to porous sheets, and the operation of a two enzyme continuous feed reactor. Biochem. J., 109, 137-141.
Wu X.Y., Jeeskeleinen S. & Linko Y.Y., 1996. An investigation of crude lipases for hydrolysis, esterification and transesterification. Enzyme Microb. Technol., 19, 226-231.
Yamamoto A., Yasumoto K. & Mitsuda H., 1970. Isolation of lipoxygenase isozymes and comparison of their properties. Agric. Biol. Chem., 34(8), 1169-1177.
Yang D. & Rhee J.S., 1992. Continuous hydrolysis of olive oil by immobilized lipase in organic solvent. Biotechnol. Bioeng., 40, 748-752.
Yang F. & Russel A.J., 1995. A comparison of lipase catalysed ester hydrolysis in reverse micelles, organic solvents, and biphasic systems. Biotechnol. Bioeng., 47, 60-70.
Yokota K. et al., 2003. Molecular biology and biochemistry of liopoxygenases and related pathways. In: Roussos et al., eds. New horizons in biotechnology. Dordrecht, Holland: Kluwer Academic Publishers, 199-214.
Zhuang H., Hamilton Kemp T.R., Andersen R.A. & Hildebrand D.F., 1996. The impact of alteration of polyunsaturated fatty acid levels on C6-aldehyde formation of Arabidopsis thaliana leaves. Plant Physiol., 111, 805-812.
Pour citer cet article
A propos de : Mohamed Gargouri
Institut National des Sciences Appliquées et de Technologie (INSAT). Equipe de Génie enzymatique. Unité de Biocatalyse et Bioprocédés. Département de Génie biologique et chimique. BP 676. TN-1080 Tunis Cedex (Tunisie). E-mail : mohamed.gargouri@insat.rnu.tn
A propos de : Najla Ben Akacha
Institut National des Sciences Appliquées et de Technologie (INSAT). Equipe de Génie enzymatique. Unité de Biocatalyse et Bioprocédés. Département de Génie biologique et chimique. BP 676. TN-1080 Tunis Cedex (Tunisie).
A propos de : Faten Kotti
Institut National des Sciences Appliquées et de Technologie (INSAT). Equipe de Génie enzymatique. Unité de Biocatalyse et Bioprocédés. Département de Génie biologique et chimique. BP 676. TN-1080 Tunis Cedex (Tunisie).
A propos de : Ines Ben Rejeb
Institut National des Sciences Appliquées et de Technologie (INSAT). Equipe de Génie enzymatique. Unité de Biocatalyse et Bioprocédés. Département de Génie biologique et chimique. BP 676. TN-1080 Tunis Cedex (Tunisie).






