- Accueil
- volume 12 (2008)
- numéro 2
- Méthodes de mesure de l'âge physiologique des tubercules semences de pomme de terre (Solanum tuberosum L.)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Méthodes de mesure de l'âge physiologique des tubercules semences de pomme de terre (Solanum tuberosum L.)

Notes de la rédaction
Reçu le 5 octobre 2007, accepté le 15 janvier 2008
Résumé
L’étude du vieillissement des tubercules de pomme de terre présente des finalités fondamentales et appliquées. En raison des impacts économiques potentiels, de nombreuses tentatives ont été réalisées afin de développer des indicateurs fiables de l’âge physiologique des tubercules semences destinés à la multiplication végétative, que ce soit au niveau biophysique, physiologique ou biochimique. A l’heure actuelle, aucun des indicateurs biophysiques ne rencontre entièrement les objectifs poursuivis, les résultats obtenus étant contradictoires ou peu transposables. Certains indicateurs physiologiques semblent bien adaptés, mais ne sont pas prédictifs. Les études biochimiques, quant à elles, ciblent souvent le processus de développement du tubercule ou sont réalisées sans référentiel physiologique précis. Après définition des concepts utilisés, la présente étude se propose de synthétiser et d’évaluer de façon critique les méthodes de mesure de l’âge physiologique. Une stratégie d’étude intégrée du processus de vieillissement est finalement proposée en tenant compte des données existantes.
Abstract
Assessment methods of physiological age of potato seed tuber (Solanum tuberosum L.). The study of potato tuber ageing possesses both fundamental and applied interests. Because of potential economical impacts, numerous attempts have been made to develop reliable biophysical, physiological or biochemical markers of physiological age of seed tubers intended for vegetative multiplication. At the present time, biophysical markers do not meet this objective, the obtained results being contradictory or not very transposable. Some physiological markers seem well-suited but they are not predictive. The biochemical studies often focus on potato tuber developmental process or are undertaken without accurate physiological reference frame. After defining the main concepts, this study synthesizes and critically evaluates the different methods used to assess physiological age. An integrated research strategy based on existing data is finally proposed to study potato tuber ageing.
Table des matières
1. Introduction
1La pomme de terre (Solanum tuberosum L.) est une plante herbacée tubéreuse originaire d’Amérique latine. Sa production mondiale s’élevait à 330 millions de tonnes en 2004 (FAO, 2007), ce qui en fait la cinquième plante cultivée après la canne à sucre, le maïs, le riz et le blé. Dans la pratique agricole, le cycle de production de la pomme de terre est principalement végétatif, les tubercules produits constituant à la fois un organe de reproduction asexuée (tubercules semences) et la partie alimentaire de la plante. Les performances agronomiques des tubercules semences dépendent fortement de leur âge physiologique. Ce paramètre désigne l’état physiologique du tubercule à un moment donné (Reust, 1986 ; Coleman, 2000) et conditionne certaines composantes essentielles du rendement telles que la capacité de cicatrisation des tubercules, le taux de croissance initial de la culture, le nombre de tiges produites ou la date de tubérisation (Hartmans et al., 1987 ; Lulai et al., 1994 ; Coleman, 2000). L’étude du vieillissement des tubercules de pomme de terre au cours du stockage présente par ailleurs des finalités fondamentales. La pomme de terre est en effet considérée par plusieurs auteurs comme organisme modèle dans les études de vieillissement (Kumar et al., 1996b ; Kumar et al., 1999 ; Coleman, 2000 ; Zabrouskov et al., 2002). Dans ce contexte appliqué et fondamental, de nombreuses études ont été menées afin de caractériser l'âge physiologique des tubercules de pomme de terre. La présente revue de littérature se propose :
2– de définir la terminologie utilisée dans le contexte du vieillissement,
3– de synthétiser les résultats obtenus jusqu'à présent,
4– d’aborder de façon critique les perspectives d'application de ces indicateurs de vieillissement.
2. Définitions
2.1. Note préliminaire
5A l’heure actuelle, parmi les différents concepts menant à la mort végétale, il n’y a pas de consensus général quant aux limites et aux chevauchements de notions telles que vieillissement, mort, sénescence, maturation, détériorations post-récolte, réaction d’hypersensibilité, lésions, chlorose et nécrose (Thomas et al., 2003). Les définitions présentées ci-dessous sont néanmoins celles qui sont le plus souvent rencontrées dans la littérature récente. Elles constituent un préalable essentiel à la discussion des résultats de toute étude portant sur le vieillissement. Certaines des définitions présentées sont volontairement extensives. Dans un souci de cohérence, elles comportent, en plus des notions à caractère biochimique ou physiologique, un volet agronomique assez large. Nous nous limiterons par ailleurs aux concepts définis à l'échelle d'un organe entier et non au niveau cellulaire car ces derniers ne peuvent s'appliquer directement au tubercule de pomme de terre. Cet organe est en effet constitué de nombreux tissus distincts, comportant eux-mêmes de nombreuses lignées cellulaires différentes.
2.2. Vieillissement et âge physiologique
6A l’échelle d’un organe tel que le tubercule de pomme de terre, le vieillissement est principalement dû à des processus dégénératifs stochastiques dirigés par des forces extérieures (par exemple, les conditions environnementales) qui dépassent progressivement le métabolisme domestique (housekeeping) contrôlé génétiquement et son potentiel de protection (Hadfield et al., 1997 ; Beck et al., 2003). Il désigne l’évolution de l’âge physiologique du tubercule de pomme de terre. Le taux de vieillissement est fonction du cultivar, de l’individu et de la température (Reust, 1982 ; Coleman, 2000).
7L’âge physiologique caractérise quant à lui l’état physiologique du tubercule à un moment donné, cet état influençant sa capacité de production de tubercules fils (Reust, 1982 ; Reust, 1986 ; Coleman, 2000). Il dépend d’une part, de son âge chronologique et d’autre part, des conditions subies pendant la croissance, la récolte et la conservation. Un tubercule sera d’autant plus âgé que le temps écoulé à partir de sa date de formation aura été long et la température élevée (Burton, 1966 ; Reust, 1982).
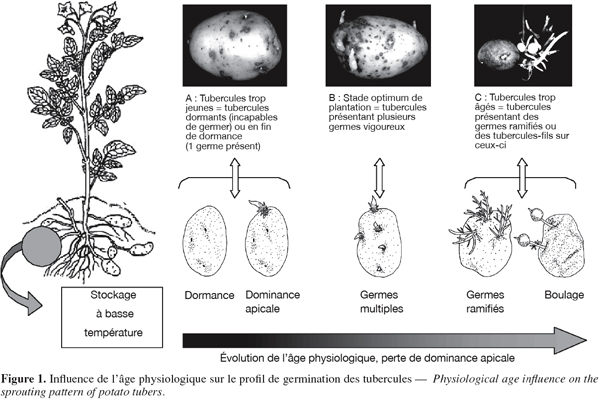
8Les modèles de croissance suivis par les tubercules de pomme de terre dépendent ainsi fortement du processus de vieillissement (Krijthe, 1962 ; Reust, 1982 ; Hartmans et al., 1987 ; Van der Zaag et al., 1987 ; Fauconnier et al., 2002). Quatre stades définis sur base morphologique succèdent à la phase de dormance (Figure 1) :
9– stade monogerme : ce stade est caractérisé par la dominance apicale. De telles « semences » produiront des plantes avec peu de tiges. Un faible nombre de tiges donnera peu de tubercules, mais ceux-ci seront de plus gros calibre (Johnson, 1997) ;
10– stade germes multiples : des tubercules de ce stade présentent des germinations multiples. Tous les yeux du tubercule sont susceptibles de germer. Ces tubercules produiront des plantes avec plusieurs tiges, ce qui augmentera le nombre de tubercules fils (Johnson, 1997) ;
11– stade germes ramifiés : ce stade est caractérisé par une ramification importante des germes. Ces derniers sont chétifs et donneront des plantes peu vigoureuses. Celles-ci produiront un grand nombre de tubercules mais de petit calibre (Johnson, 1997) ;
12– stade de formation de tubercules fils (boulage) : stade ultime débutant par l’initiation de tubercules fils sur les germes et suivi d’une période de grossissement qui dure jusqu’à l’épuisement du tubercule mère (Rousselle et al., 1996). Des tubercules de cet âge physiologique sont inutilisables comme semences (Johnson, 1997).
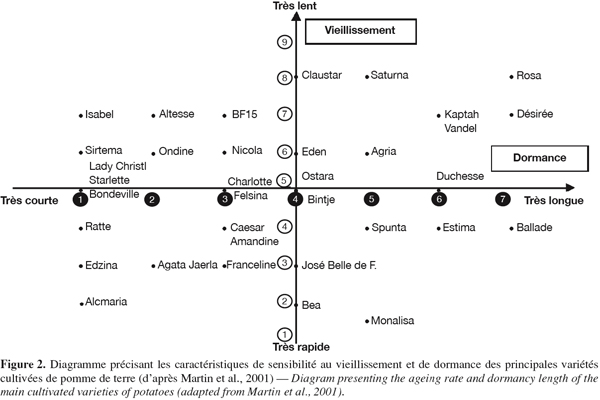
13Une caractérisation des vitesses de vieillissement au niveau variétal a été publiée par Martin et al. (2001), se basant sur la sensibilité à l’égermage. Pour chaque variété, des tubercules sont égermés trois fois en cours de stockage avant plantation et comparés à des tubercules non égermés conservés en chambre frigorifique. Les variétés sont notées de 1 (très sensible à l’égermage, vieillissement très rapide) à 9 (très peu sensible à l’égermage, vieillissement très lent) (Figure 2).
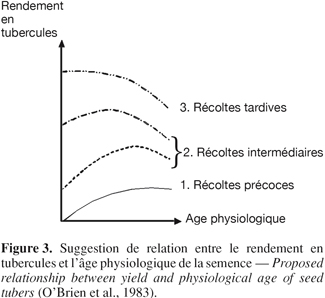
14Pratiquement parlant (Figure 3), l’âge physiologique optimal des tubercules semences dépend de la durée du cycle de production prévu (Reust, 1982). Dans des conditions agronomiques classiques (plantation en avril-mai, récolte en septembre-octobre), l'âge physiologique optimum de plantation correspond au stade " germes multiples " vigoureux. Des plants issus de tubercules semences physiologiquement âgés ont un taux de croissance initial plus rapide, développent davantage de tiges, tubérisent plus tôt, produisent moins de feuilles et montrent des signes de sénescence plus précocement que ceux issus de tubercules jeunes (Van Der Zaag et al., 1987). Il semblerait cependant que le vieillissement physiologique affecte principalement l’émergence, ce qui conditionne par exemple la précocité de la tubérisation subséquente (Van Der Zaag et al., 1987). L’âge physiologique des tubercules semences influence ainsi les performances de la culture qui en découle : taux et pourcentage d’émergence, nombre de tiges par tubercule, date d’initiation de la tubérisation, vigueur de croissance, distribution de la matière sèche et rendement (Reust, 1982 ; Caldiz et al., 2001).
15Le vieillissement physiologique provoque finalement le « sucrage de sénescence » résultant de l’accumulation de sucres réducteurs dans le tubercule (Burton, 1989 ; Rousselle et al., 1996). Conceptuellement, cette dénomination est pourtant trompeuse et ne devrait pas être strictement associée à des événements liés à une sénescence avancée telle que définie pour les pétales d’œillet sénescents (Hartmann, 1992).
16Il est à remarquer que la définition du vieillissement se rapproche parfois chez certains auteurs du concept de sénescence, principalement dans les domaines liés à la physiologie du vieillissement humain (gérontologie notamment). Ainsi, Arking (1998) définit le vieillissement comme étant « une série indépendante du temps de changements cumulatifs, progressifs, intrinsèques et délétères, tant fonctionnels que structuraux, qui commencent habituellement à se manifester à la maturité reproductive pour éventuellement mener à la mort ».
2.3. Sénescence
17Le vieillissement et la sénescence des végétaux désignent l’ensemble des changements métaboliques dont la conséquence à brève ou à longue échéance sera la mort de l’ensemble ou d’une partie de l’organisme (Hartmann, 1992). La distinction entre ces deux notions intervient au niveau de la cause première de ces changements. L’usure progressive et passive d’un système vivant, principalement à la suite des attaques du milieu extérieur, relève du vieillissement alors que la sénescence implique des changements qualitatifs actifs qui trouvent leur origine au niveau du génome. Elle est définie comme la dernière phase du développement végétal où s’initient des séries d’événements de plus en plus irréversibles qui conduisent à la dégénérescence cellulaire et parfois à une mort cellulaire programmée pouvant être réversible à l’échelle d’un organe (Hartmann, 1992 ; Gan et al., 1997 ; Thomas, 2002 ; Dertinger et al., 2003 ; Yoshida, 2003 ; Jones et al., 2005 ; Zentgraf, 2007). Ce programme dépendant du patrimoine génétique de l’individu peut également être régulé par des facteurs internes (par exemple, le développement reproductif, l’âge physiologique ou les niveaux de phytohormones) ou environnementaux tels que des infections par des pathogènes, des blessures ou encore l’ombrage dans le cas d’une feuille (Hartmann, 1992 ; Gan et al., 1997 ; Zentgraf, 2007). Chez les plantes, en plus de ces caractéristiques, la sénescence implique plusieurs processus de mobilisation et de recyclage des biomolécules (Spiteller, 2003 ; Beck et al., 2003 ; Thomas et al., 2003).
3. Méthodes d’évaluation de l’âge physiologique des tubercules
3.1. Généralités
18En raison de son importance agronomique, de nombreuses tentatives ont été réalisées afin de développer un indicateur de l’âge physiologique de tubercules semences. On distingue ainsi trois grandes classes d’indicateurs (Caldiz et al., 2001).
19Les indicateurs biophysiques incluent l’accumulation de degrés-jours depuis la levée de dormance (O’Brien et al., 1983), la somme de températures de stockage (Scholte, 1987, notion décriée par Struik et al., 1999) et les indices de vigueur de croissance relative (Bodlaender et al., 1987 ; Van Ittersum, 1992).
20Des indicateurs physiologiques tels que le type de germe (Krijthe, 1958), la capacité germinative (Krijthe, 1962), la longueur du plus grand germe (O’Brien et al., 1981) et la longueur de la période d’incubation (Reust et al., 1975 ; Caldiz, 1991, cf. supra) ont été utilisés afin d’établir l’âge physiologique.
21Des indicateurs biochimiques notamment basés sur le contenu en sucres du tubercule ou des germes (Van Es et al., 1984), l’activité enzymatique (Van Es et al., 1987 ; Caldiz et al., 1996), le contenu en acides organiques (Reust et al., 1985), en polyamine (Apelbaum, 1984), en adénosine triphosphate, adénosine biphosphate et phosphates (Biotto et al., 1991) ou le contenu en électrolytes (De Weerd et al., 1995) ont également été développés.
3.2. Indicateurs biophysiques
22Différentes techniques basées sur des mesures de température ont été mises au point, mais aucune ne rencontre entièrement les objectifs poursuivis.
23Rapport de vigueur de croissance précoce. Van Ittersum et al. (1990) ont proposé d’utiliser le rapport de vigueur de croissance précoce de tubercules issus de deux (ou plusieurs) températures de stockage afin de mesurer le taux de vieillissement physiologique. Ils ont cependant rencontré un manque de transposabilité de leurs résultats de laboratoire en conditions de plein champ ainsi qu’une variabilité interannuelle importante.
24Index plastochrone ou phyllochrone. L’utilisation de ces deux index est également envisageable. L’index phyllochrone consiste à mesurer le taux d’apparence des feuilles supérieures à 10 mm et est exprimé en Kelvin∙jour en considérant une température de base de 0 °C. Les résultats obtenus par Firman et al. (1995) sur les variétés cultivées Vanessa, Désirée et Cara se sont cependant révélés contradictoires pour au moins deux des quatre dates de plantation examinées.
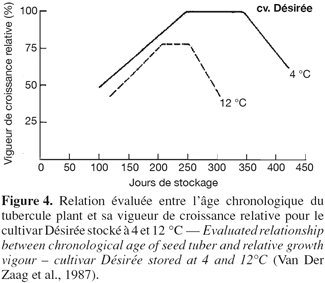
25Vigueur de croissance relative. La vigueur de croissance d’un tubercule semence est définie comme étant le potentiel du tubercule à produire des germes et des fanes dans des conditions favorables à la croissance (Van Der Zaag et al., 1987). Ces auteurs ont établi des courbes de vigueur de croissance relative en fonction de la durée de stockage (Figure 4) et ont ainsi mis en évidence des corrélations linéaires avant et après la période de maximum de croissance.
26Echelles thermiques. Au Royaume-Uni, une échelle thermique pour le vieillissement a été développée afin de mettre en relation le rendement des tubercules et leur « histoire thermique ». Les études initiales ont permis de mettre en évidence une corrélation positive entre, d’une part, la croissance des tiges et le rendement en tubercules et, d’autre part, le nombre de degrés-jours au-dessus d’une température basale de 4 °C accumulés après la fin de la dormance (Wurr, 1978 ; O’Brien et al., 1983). O’Brien et al. (1978) et Reust (1982) ont utilisé quant à eux une température seuil de 0 °C.
27On trouve cependant plusieurs arguments en défaveur de ces échelles thermiques au-dessus de 4 °C :
28– O’Brien et al. (1981) mettent en doute le vieillissement du tubercule à des températures trop basses pour la germination, ce qui contredit les données obtenues par Krijthe (1962),
29– Krijthe (1962) n’a pas observé de différence dans les profils de germination suivis par des tubercules stockés à 2 et 5 °C,
30– Wurr (1979) et Struik et al. (2006) ont montré qu’un même nombre de degrés-jours accumulés peut correspondre à des âges physiologiques différents selon que la température de stockage est stable ou variable,
31– les essais visant à mettre en relation la vigueur du tubercule (le poids sec des pousses, par exemple) et les températures accumulées durant le stockage se sont révélés infructueux (Scholte, 1987).
3.3. Indicateurs physiologiques
32Comme nous l’avons vu, le profil de germination suivi par un tubercule est fonction de son âge physiologique. Certains auteurs ont tenté de caractériser ces « réponses de germination » afin d’évaluer l’âge physiologique.
33Capacité germinative. La capacité germinative désigne le poids des germes produits après une incubation de 4 semaines à 20 °C (Krijthe, 1962) ou 18 °C à l’obscurité (Hartmans et al., 1987). Elle peut être exprimée en pourcentage du poids frais initial (Krijthe, 1962) ou par tubercule d’un lot de 40 unités (Hartmans et al., 1987). Les mesures de capacité germinative (en pourcentage du poids frais initial) effectuées par Krijthe (1962) sur des tubercules stockés à 2 °C se sont révélées très variables, peu quantitatives et dépendantes du lot et de la saison de culture. Hartmans et al. (1987) ont également mesuré la capacité germinative (par tubercule) de tubercules des variétés Jaerla et Désirée préalablement stockés à l’obscurité à 4 et 12 °C. Cette variable mesure la vitesse de production de matériel végétal influencée par l’année de récolte, la température de stockage et la durée de ce dernier. Elle atteint son maximum après minimum 300 jours de stockage à 4 °C pour la variété Désirée. Cette mesure est très nettement corrélée (R = 0,87) et donc interchangeable avec la longueur du plus grand germe par tubercule, mais est cependant plus adéquate en cas de ramification ou de nécrose apicale des germes. Notons, par ailleurs, qu'il est possible d’intégrer cette capacité de production au fil du temps et de dresser ainsi des courbes cumulatives de forme sigmoïdale (Coleman, 2000).
34Différentes améliorations à apporter à la définition de la capacité germinative ont été proposées par Coleman (2000) : température de 15 °C, lots de masse homogène, utilisation du nombre de germes ou de la longueur du plus grand germe après 2 à 3 semaines au lieu du poids frais de germes après 4 semaines. Les lots stockés à 4 °C montreront cependant encore des variations annuelles liées à la maturité de la culture et à ses effets sur le statut métabolique des tubercules fils (Coleman, 2000).
35Période d’incubation et index d’âge physiologique. La période d’incubation désigne le temps s’écoulant entre le début de la germination du tubercule (éventuellement égermé si des germes étaient déjà présents) et la formation de tubercules fils sur les nouvelles pousses durant un stockage à l’obscurité à 15-20 °C et 90-95 % d’humidité relative (Reust, 1982 ; Hartmans et al., 1987 ; Caldiz et al., 2001). La période d’incubation décroît de façon linéaire (R = -0,99) avec le temps de stockage (Hartmans et al., 1987). Pour le cultivar Désirée, une vigueur maximale de croissance des germes est obtenue lorsque sa valeur se situe entre 85 et 55 jours (Van Der Zaag et al., 1987).
36Un index d’âge physiologique (PAI : Physiological Age Index) basé sur la période d’incubation peut être défini afin de permettre des comparaisons inter-variétés (Coleman, 2000 ; Caldiz et al., 2001) :
37PAI = (T-T0)/(TI-T0)
38où T est la date de détermination de l’âge physiologique, T0 est la date de défanage (voire la date de fin de dormance, afin de réduire la variabilité annuelle) et TI est la date de fin de période d’incubation (boulage) à une température donnée (Coleman, 2000).
39La valeur de ce PAI se situe entre 0 et 1 selon que les tubercules sont respectivement physiologiquement jeunes ou vieux. Cet index s’est révélé utile pour mesurer les différences dues aux conditions de croissance, au cultivar, à la date de défanage, à l’origine des tubercules, au système de stockage et aux systèmes de préplantation (Caldiz et al., 2001). Ce PAI est, par ailleurs, corrélé avec la durée de couverture du sol et le rendement de la culture future. Il est facile à mesurer, non invasif, reproductible et fiable (Caldiz et al., 2001). Il nécessite cependant d’attendre la fin de la période d’incubation pour déterminer l’âge physiologique (pas de valeur prédictive).
3.4. Indicateurs biochimiques et moléculaires
40Historiquement, de nombreuses recherches ont été menées afin d'étudier les modifications biochimiques intervenant au cours du stockage des tubercules de pomme de terre. Ces études ne visaient cependant pas à établir un parallèle clair entre les dosages biochimiques effectués et des données physiologiques détaillées liées à la germination ou à la levée des tubercules. Les résultats obtenus sont donc difficilement utilisables directement comme marqueurs du vieillissement. De nombreuses pistes biochimiques se révèlent cependant prometteuses et mériteraient d'être ré-évaluées en utilisant un matériel végétal préalablement caractérisé au niveau physiologique. L'objectif poursuivi dans les chapitres suivants n'est pas de réaliser une synthèse exhaustive des études post-récolte réalisées, mais d'établir des bases bibliographiques permettant le développement d'approches biochimiques de caractérisation du processus de vieillissement des tubercules.
41Evolution du protéome. Durant le vieillissement des tubercules (de 3 à 30 mois de stockage à 4 °C), une diminution de leur contenu en protéines solubles (majoritairement représentées par la patatine de 40 KDa) a été observée (Kumar et al., 1993a). Cette modification du contenu en protéines solubles résulte d’une diminution de la capacité de synthèse protéique (Kumar et al., 1993a) ainsi que d’une protéolyse accrue liée à :
42– une augmentation de la concentration en protéases de 84,95 et 125 KDa,
43– une diminution de la concentration en multicystatine, un inhibiteur des protéases à cystéine,
44– des modifications non enzymatiques (oxydation accrue, glycation, désamination) des protéines, les rendant plus sensibles à la dégradation (Kumar et al, 1999).
45La diminution de capacité de synthèse de protéines aurait des conséquences sur la disponibilité de certaines enzymes impliquées dans la germination et pourrait ainsi expliquer la perte de potentiel de croissance qui intervient au cours du vieillissement (Kumar et al., 1993a).
46Complémentairement, plusieurs approches globales sans a priori basées sur l’électrophorèse bidimensionnelle ont été développées afin d’étudier l’évolution du protéome de tubercules de pomme de terre en stockage. Du fait de leurs limitations techniques, les premières recherches menées sur ce sujet n’ont cependant pas permis d’identifier les protéines différentiellement exprimées au cours de la transition puits–source (Borgmann et al., 1994), de la levée de dormance (Désiré et al., 1995) ou du stockage à basse température (Espen et al., 1999).
47Plus récemment, Lehesranta et al. (2006) ont réalisé une analyse protéomique du cycle de vie du tubercule de pomme de terre en utilisant une approche technique plus moderne couplée à une identification protéique par spectrométrie de masse en tandem. Leurs résultats indiquent que le processus de tubérisation est caractérisé par l’accumulation d’isoformes de patatine et d’enzymes impliquées dans les réactions de défense contre les pathogènes et les ravageurs. Les enzymes impliquées dans le métabolisme énergétique et dans la transformation protéique sont également associées au développement, mais voient leur concentration diminuer en cours de maturation. Bien que fondamentalement très intéressante, cette étude ne considère cependant que des périodes de stockage de 4 semaines à 5 °C sans caractérisation physiologique poussée du matériel végétal. Les résultats obtenus sont donc d’un intérêt limité dans le contexte du vieillissement post-récolte.
48Polyamines. Une augmentation de la synthèse d’acides nucléiques et de protéines marque la fin de la dormance des tubercules (Apelbaum, 1984 ; Macdonald et al., 1988). Du fait du rôle essentiel des polyamines dans les synthèses protéiques, une enzyme appartenant à leur voie métabolique (l’ornithine décarboxylase) a été proposée comme indicateur d’âge physiologique (Apelbaum, 1984).
49Lipides. Les lipides représentent environ 0,1 % du poids frais d’un tubercule de pomme de terre. Ce dernier ne contenant pas de réserves importantes de lipides, on admet que la composition totale en acides gras du tubercule est une bonne estimation de la composition de ses membranes (Spychalla et al., 1990b). Les changements membranaires et la perte du contrôle homéostatique sont souvent considérés comme des manifestations du vieillissement. On a donc longtemps supposé que le taux de perte d’électrolytes était un indicateur effectif du vieillissement physiologique des tubercules (Coleman, 2000). Plusieurs auteurs ont ainsi observé au cours du stockage une décroissance du pourcentage d’intégrité membranaire (Knowles et al., 1989 ; De Weerd et al., 1995 ; Zabrouskov et al., 2002 ; Fauconnier et al., 2002). Cette décroissance est accentuée lorsque les conditions expérimentales permettent la croissance des germes (De Weerd et al., 1995 ; Fauconnier et al., 2002).
50D’après Coleman (2000), les modifications d’intégrité membranaire liées au vieillissement sont la conséquence des changements subis par le degré de saturation des membranes, l’index de double liaison étant inversement corrélé avec le taux de perte d’électrolytes (Knowles et al., 1989). Ces résultats ont cependant été infirmés par Fauconnier et al. (2002), aucune corrélation claire n’ayant pu être établie entre la perte d’intégrité membranaire et la diminution de l'index de double liaison.
51Le mécanisme précis de détérioration des membranes n’est pas encore parfaitement connu. La cause la plus souvent avancée est la peroxydation, par les radicaux libres, des acides gras insaturés dans la bicouche lipidique (Knowles et al., 1989 ; Kumar et al., 1993a). D’autres causes sont cependant possibles : la désesterification et l’accumulation d’acides gras libres dans la bicouche, la perte de lipides de type diacylglycérol ou la transition des membranes et de leurs composés acyl-lipidiques d’une structure cristalline-liquide normale et flexible vers une structure gel solide (Spychalla et al., 1990b). Lojkowska et al. (1989) ont également émis l’hypothèse que la dégradation des membranes cellulaires est catalysée par des phospholipases endogènes, telles que l’acyl hydrolase lipolytique, certains produits de cette activité enzymatique étant des substrats des enzymes lipoxygénases (Turnbull et al., 1992).
52En ce qui concerne l’hypothèse oxydative de dégradation des membranes, les contenus en malondialdéhyde et en éthane sont souvent présentés comme des indicateurs de peroxydation lipidique, mais ils ne sont que des indicateurs indirects résultant de la métabolisation des produits de ces attaques oxydatives. La concentration en malondialdéhyde augmente (Kumar et al., 1993b ; Dipierro et al., 1997) ou reste stable au cours du vieillissement à 4 °C (Zabrouskov et al., 2002). Fauconnier et al. (2002) ont de plus démontré que la concentration en hydroperoxydes totaux diminuait au cours du vieillissement. Ces hydroperoxydes sont des marqueurs directs de peroxydation lipidique : ils peuvent être formés par autooxydation ou par l’action d’enzymes telles que l’α-dioxygénase ou la lipoxygénase sur les acides gras polyinsaturés. L’origine principale des pertes d’électrolytes ne résulte donc pas de l’oxydation des acides gras insaturés (Fauconnier et al., 2002).
53Polysaccharides. Hartmans et al. (1984) ont étudié l’évolution du contenu en amidon et en sucres des germes au cours du vieillissement. Leurs conclusions suggèrent que le processus de vieillissement diminue l’efficacité d’utilisation des composés hydrocarbonés, sans affecter leur translocation dans le tubercule. Au sein du tubercule, il est généralement admis que le sucrage de « sénescence », s’opérant d’autant plus rapidement que la température de stockage est élevée (Rousselle et al., 1996), est dû à des processus hydrolytiques et phosphorolytiques dégradant l’amidon alors que la phosphorolyse intervient majoritairement dans le développement du sucrage au froid précoce et réversible (Burton, 1989 ; Sowokinos, 1990). Le catabolisme et la compartimentation de l’amidon, ainsi que le sucrage au froid qui y est associé, sont des processus extrêmement complexes impliquant des interactions entre les voies de dégradation et de synthèse de l’amidon et du saccharose, la glycolyse, la voie oxydative des pentoses phosphates, la respiration mitochondriale et les fermentations lactique et alcoolique (Blenkinsop et al., 2003). Des sucres réducteurs (glucose, fructose) découlant de la dépolymérisation de l’amidon s’accumulent ainsi dans les tubercules stockés à basse température (Fauconnier et al., 2002). Des tubercules de la variété Désirée en stockage à 20 °C et traités avec de l'isopropyl N-(3-chlorophenyl) carbamate (CIPC) ont par ailleurs montré une très nette augmentation de la concentration en saccharose après 120 jours de stockage (Fauconnier et al., 2002). Le saccharose et les sucres réducteurs s’accumulant à basse température pourraient de plus agir comme cryoprotectants permettant une acclimatation aux basses températures (Malone et al., 2006).
54Calcium et régulateurs de croissance. Il semblerait que la vigueur germinative des tubercules dépende de leur capacité à transporter l’ion calcium vers les méristèmes (Coleman, 2000). Le calcium est en effet souvent considéré comme un ion antisénescence dont le mode d’action passe par une augmentation de l’intégrité membranaire (Kumar et al., 1993a). Au sein du tubercule, Lindblom (1966) a suggéré que la dominance apicale observée dans les premiers stades du vieillissement est déterminée par le rapport des concentrations en acide indole acétique et en acide gibbérellique GA3. Les études menées par Reverberi et al. (2001) ont par ailleurs montré que la concentration en acide indole acétique augmentait fortement au cours du vieillissement. Plus récemment, Coleman (2000) a avancé l’idée que l’acide indole acétique, les cytokinines et l’acide abscissique pourraient être impliqués dans la levée de dominance apicale et dans la modulation de la vigueur de croissance. Ces différentes classes de phytohormones influencent également la levée de dormance (Fernie et al., 2001).
55Taux respiratoire. Une diminution lente de la respiration est très généralement observée au cours du stockage à basse température des tubercules (Burton, 1989 ; Barichello et al., 1990 ; Marangoni et al., 1997). Cette diminution du taux respiratoire à basse température est liée à une inhibition des phosphorylations oxydatives mitochondriales (Blenkinsop, 2003). Si l’on place des tubercules d’âge physiologique croissant dans des conditions permettant la germination, les taux respiratoires et les capacités de production et de consommation d’adénosine triphosphate augmentent tandis que la vigueur germinative diminue et que la dominance apicale est levée. Cette évolution intervient que les tubercules aient ou non été égermés, mais son rôle physiologique reste encore à élucider (Kumar et al., 1996a).
56Evolution des systèmes antioxydants. La théorie des attaques oxydatives est basée sur le concept que des dégâts oxydatifs liés à des radicaux libres s’accumulent au cours du vieillissement (Harman, 1956). Malgré l’augmentation des capacités antioxydantes au cours du processus de vieillissement du tubercule de pomme de terre, cette évolution physiologique s’accompagnerait d’une augmentation des stress oxydatifs résultant d’un déséquilibre dans la balance pro- et anti-oxydants (Kumar et al., 1996b).
57De nombreuses études partielles ont déjà été menées sur ces sujets sans faire de lien direct avec une mesure de l’âge physiologique ou en considérant des durées de stockage peu réalistes au niveau agronomique. Par ailleurs, les résultats obtenus semblent parfois contradictoires, mais cela peut être dû aux unités utilisées ainsi qu’aux durées de stockage très disparates. Une augmentation des activités catalase et superoxyde dismutase et du contenu en α-tocophérol a ainsi été mesurée par Spychalla et al. (1990a) au cours d’un stockage de tubercules à basse température (3 et 9 °C) durant 40 semaines. Kumar et al. (1996b) ont quant à eux observé une activité accrue du système d’élimination des radicaux libres impliquant le glutathion dans des tubercules âgés après un stockage de 30 mois à 4 °C. Une augmentation au cours du stockage à basse température des activités glutathion réductase, peroxydase, ascorbate peroxydase et monodéhydroascorbate réductase a également été publiée par Zabrouskov et al. (2002). Finalement, Burton (1989), Dipierro et al. (1997) et Mizuno et al. (1998) ont mis en évidence une décroissance rapide du contenu en ascorbate.
58Méthylation de l’ADN. L’expression génique au cours du vieillissement pourrait être influencée par le degré de méthylation de l’ADN (Coleman, 2000 ; Semsei, 2000). Les résultats de Law et al. (2002) n’ont cependant pas permis de mettre en évidence des changements significatifs de concentration en 5-méthylcytosine à l’échelle du génome de cellules méristématiques du tubercule. Une déméthylation transitoire des résidus cytosine des séquences 5’-CCGG-3’ a été détectée, mais elle est indépendante de l’âge du tubercule et serait plutôt impliquée dans l’évolution de la dormance.
59Expression génique (partim transcriptomique). Une approche cDNA-AFLP (complementary DesoxyriboNucleicAcid - Amplified Fragment Length Polymorphism) a été développée afin d’étudier l’évolution du transcriptome de microtubercules de pomme de terre au cours de leur cycle de développement (principalement lors des étapes de tubérisation, de dormance et de germination) (Bachem et al., 1996 ; Bachem et al., 2000 ; Trindade et al., 2004).
60Des banques d’Expressed Sequence Tag (EST) construites à partir de stolons, de microtubercules en développement, de tubercules dormants et de germes en croissance ont été comparées par Ronning et al. (2003) et Flinn et al. (2005). Des études utilisant des puces à ADN complémentaire ont finalement été réalisées par Kloosterman et al. (2005) afin d’évaluer l’expression génique au cours du développement des tubercules. Ces études présentent des perspectives techniques intéressantes, mais n’ont pas ciblé de façon quantitative le processus de vieillissement lors du stockage à basse température. Leurs résultats restent donc à l’heure actuelle d’un intérêt limité pour la problématique qui nous préoccupe.
4. Evaluation critique des différents indicateurs du vieillissement
61Dans une perspective d’application agronomique, un indicateur d’âge physiologique idéal doit être :
62– facile à mesurer, objectif, reproductible et fiable
63– capable de prendre en compte l’environnement, le cultivar et leur interaction
64– sensible au traitement des tubercules semences
65– discriminant en fonction du lot, de son origine et de son histoire de stockage
66– compatible avec la notion d’âge chronologique (Caldiz et al., 2001)
67– peu coûteux
68– rapide à analyser afin de permettre le traitement de nombreux échantillons en parallèle.
69A l’heure actuelle, parmi les indicateurs cités dans cette revue de littérature, aucun ne rencontre l’ensemble de ces objectifs. En ce qui concerne les indicateurs biophysiques, leur utilisation est peu aisée et les résultats obtenus laissent entrevoir de nombreuses incohérences. Certains indicateurs physiologiques tels que le PAI ou la période d’incubation semblent particulièrement bien adaptés afin de caractériser l’état physiologique des tubercules utilisés pour les études de vieillissement. Leur détermination implique cependant d’attendre la fin de la période d’incubation, ce qui nécessite de nombreux mois. Ils n’ont donc aucune valeur prédictive leur permettant d’être utilisés directement au niveau agronomique. Dans les études de vieillissement, leur utilisation est cependant nécessaire – voire obligatoire – afin d’établir un cadre de référence plus précis que l’âge chronologique des tubercules. Les indicateurs biochimiques paraissent, quant à eux, bien adaptés au développement de marqueurs de vieillissement prédictifs. A titre d’exemple, nous retiendrons deux pistes nous semblant particulièrement prometteuses.
70La recherche d’indicateurs biochimiques du vieillissement peut premièrement se concevoir sans a priori à l’aide de techniques haut débit ciblant certaines étapes de l’expression génique. Ainsi, l’utilisation de puces à ADN complémentaire couplée à des techniques de confirmation permettrait de mesurer l’expression génique au cours du vieillissement et d’en déterminer les marqueurs potentiels. Pour les laboratoires de taille moyenne ne maîtrisant pas le développement de cette technologie intra muros, cette approche est cependant limitée par la disponibilité des puces. Fondamentalement, il n’y a, de plus, pas nécessairement de corrélation entre la concentration d’un ARN messager et celle de la protéine correspondante. L’étude du protéome via l’électrophorèse bidimensionnelle, quant à elle, cible une étape de l’expression génique située plus en aval. L’utilisation de méthodes d’extraction protéique adaptées au tubercule de pomme de terre (Delaplace et al., 2006) permettrait de quantifier sur gel d'électrophorèse bidimensionnelle et d’identifier en spectrométrie de masse les protéines différentiellement exprimées au cours du vieillissement. Chacune de ces protéines pourrait constituer un indicateur biochimique du vieillissement pouvant être mesuré via des techniques de type ELISA par exemple.
71A contrario, une approche biochimique ciblée et complémentaire pourrait être développée en s’inspirant des théories du vieillissement établies sur modèle animal. Sémantiquement, les termes vieillissement et sénescence peuvent être utilisés comme synonymes en gérontologie humaine (de Magalhães, 2006). Dans ce cadre théorique, nous parlerons donc de vieillissement sensu lato. De nombreuses théories ont été proposées afin de décrire le processus complexe du vieillissement sensu lato des systèmes biologiques. Selon Semsei (2000), il existe deux grands types de théories explicatives du vieillissement animal (Figure 5) : les théories programmées postulant l’existence de programmes internes ou externes qui déterminent le processus de vieillissement ab ovo et les théories des erreurs impliquant explicitement ou implicitement l’intervention de facteurs destructifs causant des erreurs, des mutations, des désordres fonctionnels entraînant in fine des dysfonctionnements et la mort. Si l’on transpose ce formalisme au niveau végétal, les théories des erreurs et les théories programmées s’appliquent respectivement aux concepts de vieillissement sensu stricto et de sénescence tels qu’ils ont été définis au point 2 (Hartmann, 1992).
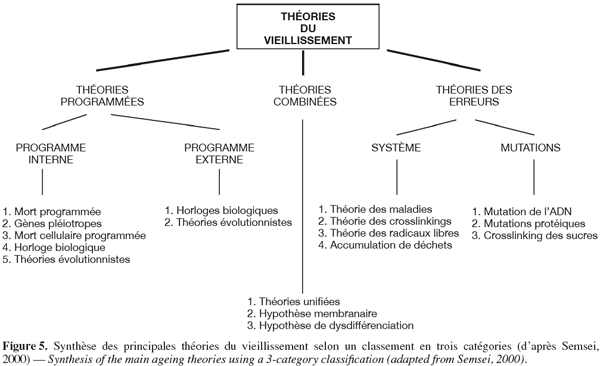
72Parmi l'ensemble de ces théories proposées, la théorie des attaques oxydatives est la plus souvent citée dans la littérature (Wickens, 2001 ; Sohal, 2002b). Cette théorie a été formulée pour la première fois en 1956 par Denham Harman, mais n’a cependant toujours pas été démontrée à l’aide de preuves directes (Wickens, 2001 ; Sohal et al., 2002 ; Sohal, 2002a). Elle postule que l'accumulation de modifications non enzymatiques sur les biomolécules cellulaires (ADN, lipides, protéines et sucres) causées par des attaques de formes actives d'oxygène est l’un des facteurs principaux responsables de la détérioration fonctionnelle des cellules âgées ou en cours de vieillissement (Sohal, 2002b ; Blokhina et al., 2003). Ces attaques oxydatives résultent généralement d’un déséquilibre de la balance des systèmes pro- et anti-oxydants (Figure 6, exemple protéique végétal), un stress oxydatif pouvant donc résulter d’une surproduction de formes actives d’oxygène et/ou d’une défaillance des systèmes antioxydants (Blokhina et al., 2003). Les formes actives d’oxygène agiraient aléatoirement, mais leurs cibles se différencieraient par leur proximité et leur sensibilité aux attaques, rendant ainsi le phénomène spécifique à certaines protéines (Sohal, 2002b).
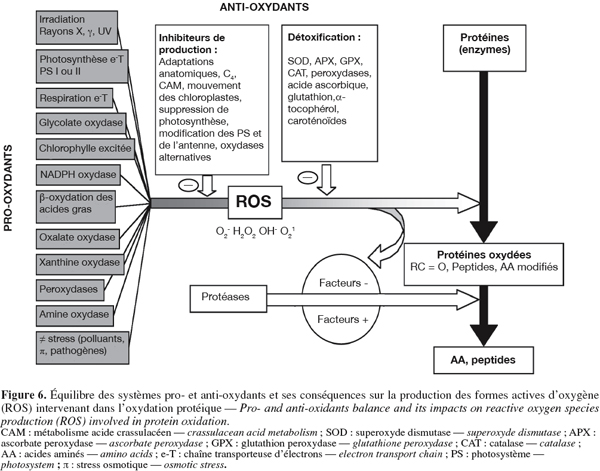
73Cette hypothèse du vieillissement pourrait être transposée à notre modèle végétal tout en permettant une étude intégrée de différents processus métaboliques liés au vieillissement. La mesure de l’évolution du système antioxydant en fonction de l’âge physiologique (évalué via le PAI ou la période d’incubation) nous renseignerait ainsi sur la capacité de notre système à prévenir l’accumulation de dégâts oxydatifs. Ces dégâts pourraient être directement dosés sur les protéines (via une mesure du contenu en carbonyles par exemple) et sur les lipides à l’aide de techniques chromatographiques adaptées (Laine et al., 2006). Le système antioxydant agit de plus en interaction avec les phytohormones, de nombreux échanges existant entre les voies de signalisation métabolique (Vranova et al., 2002 ; Desikan et al., 2005). Une mesure de l’évolution de ces phytohormones renforcerait donc encore le caractère intégré de cette approche biochimique.
74Au terme de cette évaluation des marqueurs de l'âge physiologique, il apparaît clairement qu'une approche intégrée combinant plusieurs types de marqueurs est nécessaire afin d'étudier le vieillissement. Il faut donc non seulement caractériser physiologiquement le matériel végétal à l'aide de marqueurs physiologiques quantitatifs, mais aussi valider ces données à l'aide de mesures liées à la levée des tubercules (délai avant levée, nombre de tiges produites, vigueur de croissance). Ces données peuvent être confrontées à d'autres types de marqueurs utilisables de façon prédictive.
5. Conclusion
75L’étude du vieillissement des tubercules de pomme de terre présente des finalités appliquées et fondamentales. Les indicateurs de vieillissement fiables développés jusqu'à présent n'ont pas de valeur prédictive et ne permettent donc pas de connaître l'âge physiologique des tubercules avant plantation. Toute étude future nécessite premièrement la mise en place d'un cadre de référence basé sur une caractérisation de l’état physiologique du matériel végétal utilisé à l’aide de paramètres liés à la germination et à la levée. Plusieurs approches biochimiques peuvent alors être développées, que ce soit sans a priori à l’aide de techniques transcriptomiques et protéomiques ou de manière ciblée en se basant sur la théorie oxydative du vieillissement. Cette dernière approche permet en outre d’envisager l’étude biochimique de façon intégrée car elle se situe à la croisée de nombreuses voies métaboliques importantes telles que le métabolisme primaire ou les voies de signalisation des phytohormones. Une fois ces données biochimiques obtenues, des corrélations pourront être établies avec l'âge physiologique des tubercules de pomme de terre et les paramètres de germination et de levée qui y sont associés. Cette étape essentielle permettra de développer, à terme, des marqueurs biochimiques prédictifs du vieillissement.
Bibliographie
Apelbaum A., 1984. Polyamines as possible indicators of physiological age. Potato Res., 27(3), 309.
Arking R., 1998. Biology of aging: observations and principles. 2nd ed. Sunderland, UK: Sinauer Associates.
Bachem C. et al., 2000. Functional genomic analysis of potato tuber life-cycle. Potato Res., 43(4), 297-312.
Bachem C.W.B. et al., 1996. Visualization of differential gene expression using a novel method of RNA fingerprinting based on AFLP: analysis of gene expression during potato tuber development. Plant J., 9(5), 745-753.
Barichello V., Yada R.Y., Coffin R.H. & Stanley D.W., 1990. Respiratory activity in low temperature sweetening of susceptible and resistant potatoes. J. Food Sci., 55(4), 1060-1063.
Beck E. & Scheibe R., 2003. Senescence and ageing in plants and cyanobacteria. Physiol. Plant., 119(1), 1-4.
Biotto C. & Siegenthaler P.A., 1991. Study of physiological states of seed potato tubers during their storage. Correlations between morphological and biochemical parameters. Réunion de la Section Physiologie EAPR, Le Conquet, France. Nyon, Switzerland: EAPR, 39-40.
Blenkinsop R.W., Copp L.J., Yada R.Y. & Marangoni A.G., 2003. A proposed role for the anaerobic pathway during low-temperature sweetening in tubers of Solanum tuberosum. Physiol. Plant., 118(2), 206-212.
Blokhina O., Virolainen E. & Fagerstedt K.V., 2003. Antioxidants, oxidative damage and oxygen deprivation stress: a review. Ann. Bot., 91(2), 179-194.
Bodlaender K.B.A. et al., 1987. Effect of physiological age on growth vigour of seed potatoes. A study with seed tubers of two cultivars stored at two different temperatures. Rapport 555. Wageningen, the Netherlands: Instituut voor Bewaring en Verwerking van Land bouwprodukten (IBVL), 142.
Borgmann K., Sinha P. & Frommer W.B., 1994. Changes in the two-dimensional protein pattern and in gene expression during the sink-to-source transition of potato tubers. Plant Sci., 99(1), 97-108.
Burton W.G., 1966. The potato. A survey of its history and of factors influencing its yield, nutritive value, quality and storage. Wageningen, The Netherlands: H. Weeman & Zonen N.V., 382.
Burton W.G., 1989. Post-harvest physiology. In: Burton W.G., ed. The potato. Harlow, UK: Longman Scientific and Technical, 423-522.
Caldiz D.O., 1991. Influence of crop origin and storage system on physiological age, crop growth and tuber yield of seed potato (Solanum tuberosum L.). Indian J. Agric. Res., 61(1), 1-6.
Caldiz D.O., Brocchi G., Alaniz J.R. & Marchan L., 1996. Effects of the physiological age of seed potatoes on tuber initiation and starch and dry matter accumulation. Pesq. Agropecu. Brasileira, 31(12), 853-858.
Caldiz D.O., Fernandez L.V. & Struik P.C., 2001. Physiological age index: a new, simple and reliable index to assess the physiological age of seed potato tubers based on the haulm killing date and length of the incubation period. Field Crop. Res., 69(1), 69-79.
Coleman W.K., 2000. Physiological ageing of potato tubers: a review. Ann. Appl. Biol., 137(2), 189-199.
De Magalhães J.P., 2006. Glossary: aging and gerontology. http://www.senescence.info/glossary.html, (07/07/07).
De Weerd J.W., Hiller L.K. & Thornton R.E., 1995. Electrolyte leakage of aging potato tubers and its relationship with sprouting capacity. Potato Res., 38(3), 257-270.
Delaplace P. et al., 2006. Potato tuber proteomics: comparison of two complementary extraction methods designed for 2-DE of acidic proteins. Proteomics, 6(24), 6494-6497.
Dertinger U., Schaz U. & Schulze E.D., 2003. Age-dependence of the antioxidative system in tobacco with enhanced glutathione reductase activity or senescence-induced production of cytokinins. Physiol. Plant., 119(1), 19-29.
Desikan R., Hancock J. & Neill S., 2005. Reactive oxygen species as signalling molecules. In: Smirnoff N., ed. Antioxidants and reactive oxygene species in plants. Oxford, UK: Blackwell Publishing, 169-196.
Désiré S., Couillerot J.P., Hilbert J.L. & Vasseur J., 1995. Protein changes in Solanum tuberosum during storage and dormancy breaking of in vitro microtubers. Plant Physiol. Biochem., 33(4), 479-487.
Dipierro S. & De Leonardis S., 1997. The ascorbate system and lipid peroxidation in stored potato (Solanum tuberosum L.) tubers. J. Exp. Bot., 48(3), 779-783.
Espen L.S., Morgutti S. & Cocucci S.M., 1999. Changes in the potato (Solanum tuberosum L.) tuber at the onset of dormancy and during storage at 23°C and 3°C. II. Evaluation of protein patterns. Potato Res., 42(1), 203-215.
FAO, 2007. FAOSTAT Database Results. Roma: FAO, http://faostat.fao.org/site/408/default.aspx, (02/06/07).
Fauconnier M.-L. et al., 2002. Lipoxygenase pathway and membrane permeability and composition during storage of potato tubers (Solanum tuberosum L. cultivars Bintje and Désirée) in different conditions. Plant Biol., 4(1), 77-85.
Fernie A.R. & Willmitzer L., 2001. Molecular and biochemical triggers of potato tuber development. Plant Physiol., 127(4), 1459-1465.
Firman D.M., O’Brien P.J. & Allen E.J., 1995. Appearance and growth of individual leaves in canopies of several potato cultivars. J. Agric. Sci., 125(3), 379-394.
Flinn B. et al., 2005. Potato expressed sequence tag generation and analysis using standard and unique cDNA libraries. Plant Mol. Biol., 59(3), 407-433.
Gan S. & Amasino R.M., 1997. Making sense of senescence. Plant Physiol., 113(2), 313-319.
Hadfield K.A. & Bennett A.B., 1997. Programmed senescence of plant organs. Cell Death Differ., 4(8), 662-670.
Harman D., 1956. Aging: a theory based on free radical and radiation chemistry. J. Gerontol., 11(3), 298-300.
Hartmann C., 1992. La sénescence des végétaux. 1ère éd. Paris : Hermann.
Hartmans K.J. & Van Es A., 1984. Changes in dry matter and carbohydrate content of potato sprouts during physiological ageing. Potato Res., 27(3), 311.
Hartmans K.J. & Van Loon C.D., 1987. Effect of physiological age on growth vigour of seed potatoes of two cultivars. I. Influence of storage period and temperature on sprouting characteristics. Potato Res., 30(3), 397-409.
Johnson S.B., 1997. Selecting, cutting and handling potato seed – University of Maine. http://www.umext.maine.edu/onlinepubs/htmpubs/2412.htm, (04/07/07).
Jones M.A. & Smirnoff N., 2005. Reactive oxygen species in plant development and pathogen defence. In: Smirnoff N., ed. Antioxidants and reactive oxygene species in plants. Oxford, UK: Blackwell Publishing, 197-214.
Kloosterman B. et al., 2005. Tuber on a chip: differential gene expression during potato tuber development. Plant Biotechnol. J., 3(5), 505-519.
Knowles N.R. & Knowles L.O., 1989. Correlations between electrolyte leakage and degree of saturation of polar lipids from aged potato (Solanum tuberosum L.) tuber tissue. Ann. Bot., 63(3), 331-338.
Krijthe N.K., 1958. Changes in the germinating power of seed potatoes. Eur. Potato J., 1(3), 69-72.
Krijthe N.K., 1962. Observation on the sprouting of seed potatoes. Eur. Potato J., 5(4), 316-333.
Kumar G.N.M. & Knowles N.R., 1993a. Age of potato seed-tubers influences protein synthesis during sprouting. Physiol. Plant., 89(2), 262-270.
Kumar G.N.M. & Knowles N.R., 1993b. Changes in lipid peroxidation and lipolytic and free-radical scavenging enzyme activities during aging and sprouting of potato (Solanum tuberosum) seed-tubers. Plant Physiol., 102(1), 115-124.
Kumar G.N.M. & Knowles N.R., 1996a. Nature of enhanced respiration during sprouting of aged potato seed tubers. Physiol. Plant., 97(2), 228-236.
Kumar G.N.M. & Knowles N.R., 1996b. Oxidative stress results in increased sinks for metabolic energy during aging and sprouting of potato seed-tubers. Plant Physiol., 112(3), 1301-1313.
Kumar G.N.M., Houtz R.L. & Knowles N.R., 1999. Age-induced protein modifications and increased proteolysis in potato seed-tubers. Plant Physiol., 119(1), 89-100.
Laine G. et al., 2006. Study of precursors for off-flavor formation during storage of potato flakes. J. Agric. Food Chem., 54(15), 5445-5452.
Law R.D. & Suttle J.C., 2002. Transient decreases in methylation at 5’-CCGG-3’ sequences in potato (Solanum tuberosum L.) meristem DNA during progression of tubers through dormancy precede the resumption of sprout growth. Plant Mol. Biol., 51(3), 437-447.
Lehesranta S.J. et al., 2006. Proteomic analysis of the potato tuber life cycle. Proteomics, 6(22), 6042-6052.
Lindblom H., 1966. Apical dominance in relation to indole-3-acetic acid and gibberellic acid. Proceedings 3rd Triennial conference EAPR, Zürich. Nyon, Switzerland: EAPR, 184-185.
Lojkowska E. & Holubowska M., 1989. Changes of the lipid catabolism in potato tubers from cultivars differing in susceptibility to autolysis during storage. Potato Res., 32(4), 463-470.
Lulai E.C. & Orr P.H., 1994. Techniques for detecting and measuring developmental and maturational changes in tuber native periderm. Am. Potato J., 71(8), 491-505.
Macdonald M.M. & Osborne D.J., 1988. Synthesis of nucleic acids and protein in tuber buds of Solanum tuberosum during dormancy and early sprouting. Physiol. Plant., 73(3), 392-400.
Malone J.G., Mittova V., Ratcliffe R.G. & Kruger N.J., 2006. The response of carbohydrate metabolism in potato tubers to low temperature. Plant Cell Physiol., 47(9), 1309-1322.
Marangoni A.G., Duplessis P.M. & Yada R.Y., 1997. Kinetic model for carbon partitioning in Solanum tuberosum tubers stored at 2°C and mechanism for low temperature stress-induced accumulation of reducing sugars. Biophys. Chem., 65(2), 211-220.
Martin M. & Gravoueille J.M., 2001. Stockage et conservation de la pomme de terre. 1ère éd. Paris : ITCF.
Mizuno M., Kamei M. & Tsuchida H., 1998. Ascorbate peroxidase and catalase cooperate for protection against hydrogen peroxide generated in potato tubers during low-temperature storage. Biochem. Mol. Biol. Int., 44(4), 717-726.
O’Brien P.J. & Allen E.J., 1978. The relationships between storage temperature of seed tubers and tuber yields. In: Proceedings of the 7th Triennial conference EAPR, Warsaw, Poland. Nyon, Switzerland: EAPR, 18-19.
O’Brien P.J. & Allen E.J., 1981. The concept and measurement of physiological age. In: Proceedings of the 8th Triennial conference on EAPR, München, Germany. Nyon, Switzerland: EAPR, 64-66.
O’Brien P.J. et al., 1983. Accumulated day-degrees as a measure of physiological age and the relationships with growth and yield in early potato varieties. J. Agric. Sci., 101(3), 613-631.
Reust, 1982. Contribution à l'appréciation de l'âge physiologique des tubercules de pommes de terre (Solanum tuberosum L.) et étude de son importance sur le rendement. Thèse de doctorat : Ecole Polytechnique Fédérale, Zurich (Suisse).
Reust W., 1986. EAPR working group physiological age of the potato. Potato Res., 29(2), 268-271.
Reust W. & Aerny J., 1985. Determination of physiological age of potato tubers using sucrose, citric and malic acid as indicators. Potato Res., 28(2), 251-261.
Reust W. & Munster W., 1975. La période d’incubation des variétés de pomme de terre de l’assortiment suisse et son importance. Rev. Suisse Agric., 7(6), 185-187.
Reverberi M. et al., 2001. Oxidative stress, growth factor production and budding in potato tuber during cold storage. Free Radic. Res., 35(6), 833-841.
Ronning C.M. et al., 2003. Comparative analyses of potato expressed sequence tag libraries. Plant Physiol., 131(2), 419-429.
Rousselle P., Robert Y. & Crosnier J.C., 1996. La pomme de terre : production, amélioration, ennemis et maladies, utilisations. Paris : INRA Editions.
Scholte K., 1987. Relation between storage T sum and vigour of seed potatoes. In: Proceedings of the 10th Triennial Conference EAPR, Wageningen, the Netherlands. Nyon, Switzerland: EAPR, 28-29.
Semsei I., 2000. On the nature of aging. Mech. Ageing Dev., 117(1-3), 93-108.
Sohal R.S., 2002a. Oxidative stress hypothesis of aging. Free Radic. Biol. Med., 33(5), 573-574.
Sohal R.S., 2002b. Role of oxydative stress and protein oxidation in the aging process. Free Radic. Biol. Med., 33(1), 37-44.
Sohal R.S., Mockett R.J. & Orr W.C., 2002. Mechanisms of aging: an appraisal of the oxidative stress hypothesis. Free Radic. Biol. Med., 33(5), 575-586.
Sowokinos J., 1990. Stress-induced alterations in carbohydrate metabolism. In: Vayda M.E. & Park W.D., eds. The molecular and cellular biology of the potato. Oxon, UK: C.A.B. International, 137-158.
Spiteller G., 2003. The relationship between changes in the cell wall, lipid peroxidation, proliferation, senescence and cell death. Physiol. Plant., 119(1), 5-18.
Spychalla J.P. & Desborough S.L., 1990a. Superoxide dismutase, catalase, and a-tocopherol content of stored potato tubers. Plant Physiol., 94(3), 1214-1218.
Spychalla J.P. & Desborough S.L., 1990b. Fatty acids, membrane permeability, and sugars of stored potato tubers. Plant Physiol., 94(3), 1207-1213.
Struik P.C. & Wiersema S.G., 1999. Seed potato technology. 1st ed. Wageningen, The Netherlands: Wageningen Press.
Struik P.C., van der Putten P.E.L., Caldiz D.O. & Scholte K., 2006. Response of stored potato seed tubers from contrasting cultivars to accumulated day-degrees. Crop Sci., 46(3), 1156-1168.
Thomas H., 2002. Ageing in plants. Mech. Ageing Dev., 123(7), 747-753.
Thomas H., Ougham H.J., Wagstaff C. & Stead A.D., 2003. Defining senescence and death. J. Exp. Bot., 54(385), 1127-1132.
Trindade L.M., Horvath B.M., Van Berloo R. & Visser R.G.F., 2004. Analysis of genes differentially expressed during potato tuber life cycle and isolation of their promoter regions. Plant Sci., 166(2), 423-433.
Turnbull N.D. & Cobb A.H., 1992. A study of tuber cell integrity and ultrastructure during prolonged potato storage. Aspects Appl. Biol., 33, 113-118.
Van Der Zaag D.E. & Van Loon C.D., 1987. Effect of physiological age on growth vigour of seed potatoes of two cultivars. 5. Review of literature and integration of some experimental results. Potato Res., 30(3), 451-472.
Van Es A. & Hartmans K.J., 1984. Some aspects of changes in chemical composition of tubers and sprouts during physiological aging. In: Proceedings of the 9th Triennial conference on EAPR, Interlaken, Switzerland. Nyon, Switzerland: EAPR, 231-232.
Van Es A. & Hartmans K.J., 1987. Effect of physiological age on growth vigour of seed potatoes of two cultivars. 2. Influence of storage and storage temperature on dry matter content and peroxidase activity of sprouts. Potato Res., 30(3), 411-421.
Van Ittersum M.K., 1992. Dormancy and growth vigour of seed potatoes. Thesis: Wageningen Agricultural University (the Netherlands).
Van Ittersum M.K., Scholte K. & Kupers L.J.P., 1990. A method to assess cultivar differences in rate of physiological ageing of seed tubers. Am. Potato J., 67(9), 603-613.
Vranová E., Inzé D. & Van Breusegem F., 2002. Signal transduction during oxidative stress. J. Exp. Bot., 53(372), 1227-1236.
Wickens A.P., 2001. Ageing and the free radical theory. Respir. Physiol., 128(3), 379-391.
Wurr D.C.E., 1978. The effects of the date of defoliation of the seed potato crop and the storage temperature of the seed on subsequent growth. 1. Sprout growth. J. Agric. Sci., 91(3), 737-745.
Wurr D.C.E., 1979. The effect of variation in the storage temperature of seed potatoes on sprout growth and subsequent yield. J. Agric. Sci., 93(3), 619-622.
Yoshida S., 2003. Molecular regulation of leaf senescence. Curr. Opin. Plant Biol., 6(1), 79-84.
Zabrouskov V., Kumar G.N.M., Spychalla J.P. & Knowles N.R., 2002. Oxidative metabolism and the physiological age of seed potatoes are affected by increased α-linolenate content. Physiol. Plant., 116(2), 172-185.
Zentgraf U., 2007. Oxidative stress and leaf senescence. In: Gan S., ed. Senescence processes in Plants. Oxford, UK: Blackwell Publishing, 39-62.






