- Home
- volume 13 (2009)
- numéro 1
- Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la bioconservation des produits alimentaires
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la bioconservation des produits alimentaires

Editor's Notes
Reçu le 5 mai 2008, accepté le 2 juillet 2008
Résumé
Les bactériocines produites par les bactéries lactiques sont des peptides antimicrobiens de faible poids moléculaire. Elles ont une activité inhibitrice dirigée contre les bactéries proches de la souche productrice. Leur spectre d'action est généralement étroit. Cependant, la plupart ont une activité contre des pathogènes alimentaires tels que Listeria monocytogenes. L'application des bactériocines ou des souches productrices dans les aliments pour y éviter le développement de bactéries pathogènes ou altérantes a donc été envisagée. Cet article décrit la classification, la structure, la fonction, le mode d'action, la biosynthèse et les applications alimentaires des principales bactériocines produites par les bactéries lactiques.
Abstract
Bacteriocins from lactic acid bacteria: interest for food products biopreservation. Bacteriocins from lactic acid bacteria are low molecular weight antimicrobial peptides. They have inhibitory activity against the bacteria that are closed related to the producer strains and a narrow inhibitory spectrum. Nevertheless, most of them have activity against some food-born pathogenic bacteria as Listeria monocytogenes. The application of bacteriocins or bacteriocin producing lactic acid bacteria in food products to inhibit pathogenic or food-spoilage bacteria has then been suggested. This review focuses on the classification, structure, function, mode of action, biosynthesis and current food applications of bacteriocins from lactic acid bacteria.
Table of content
1. Introduction
1Les bactéries lactiques sont un groupe hétérogène de microorganismes produisant de l'acide lactique comme produit principal du métabolisme. Elles colonisent de nombreux produits alimentaires comme les produits laitiers, la viande, les végétaux et les céréales et font partie de la flore intestinale et vaginale humaine ou animale. Elles sont impliquées dans un grand nombre de fermentations spontanées de produits alimentaires (Stiles et al., 1997), ce qui a conduit à la reconnaissance de leur statut GRAS (Generally Recognized As Safe) (Klaenhammer et al., 2005). Actuellement, les bactéries lactiques regroupent treize genres bactériens différents : Lactobacillus, Bifidobacterium, Leuconostoc, Lactococcus, Enterococcus, Streptococcus, Pediococcus, Carnobacterium, Oenococcus, Weissella, Aerococcus, Tetragenococcus et Vagococcus.
2Elles sont principalement utilisées en tant que starter dans les produits alimentaires fermentés où elles permettent de développer certaines caractéristiques organoleptiques et d'augmenter la durée de conservation (Abee, 1995 ; Hugenholtz et al., 1999). En effet, les bactéries lactiques produisent de nombreux métabolites aux propriétés antimicrobiennes tels que les acides organiques, le peroxyde d'hydrogène, le dioxyde de carbone, la reutérine, le diacétyl et les bactériocines. Les bactériocines sont des peptides antimicrobiens inhibant la croissance de bactéries altérantes ou pathogènes. Les souches les produisant peuvent donc également être utilisées dans des produits non fermentés en tant que culture protectrice. Une culture protectrice est une culture antagoniste ajoutée à un produit alimentaire pour inhiber les bactéries pathogènes et/ou altérantes et ainsi prolonger sa durée de vie en changeant ses propriétés organoleptiques le moins possible (Rodgers, 2001 ; 2003 ; Vermeiren et al., 2004). Cet article présente les bactériocines produites par les bactéries lactiques et leurs potentialités d'applications.
2. Définition des bactériocines
3Différentes définitions des bactériocines ont été données au cours du temps. Cependant, la définition qui reste la plus largement acceptée est celle de Klaenhammer (1988) qui définit les bactériocines comme des protéines, ou complexes de protéines, avec une activité bactéricide contre des espèces proches de la souche productrice. Les bactériocines représentent une large classe de substances antagonistes qui varient considérablement du point de vue de leur poids moléculaire, de leurs propriétés biochimiques, de leur spectre d'action et de leur mode d'action (Klaenhammer, 1988). Toutes les bactériocines produites par des bactéries lactiques décrites jusqu'à présent ont une activité dirigée contre les bactéries Gram+. Aucune bactériocine produite par des bactéries lactiques avec une activité contre des bactéries Gram- n'a été décrite, la membrane externe des bactéries Gram- ne permettant pas aux bactériocines d'atteindre la membrane interne, siège de leur activité.
3. Classification des bactériocines
4Les bactériocines produites par les bactéries lactiques sont réparties en quatre classes, comme proposé par Klaenhammer (1993). Ces quatre classes sont :
5Classe I. Les lantibiotiques : peptides de taille inférieure à 5 kDa, stables à la chaleur et qui contiennent des acides aminés inhabituels soufrés formés post-traductionnellement, c'est-à-dire la lanthionine, la β-méthyl lanthionine, la déhydrobutyrine et la déhydroalanine. Ils peuvent être divisés en deux types : la classe Ia qui comprend des peptides cationiques hydrophobes allongés contenant jusqu'à 34 acides aminés et la classe Ib qui comprend les peptides globulaires chargés négativement ou sans charge nette et contenant jusqu'à 19 acides aminés (McAuliffe et al., 2001 ; Twomey et al., 2002). Certains lantibiotiques sont par ailleurs constitués de deux peptides agissant ensemble pour avoir une activité comme la lacticin 3147. Les séquences et structures d'un lantibiotique de chaque type se trouvent à la figure 1.
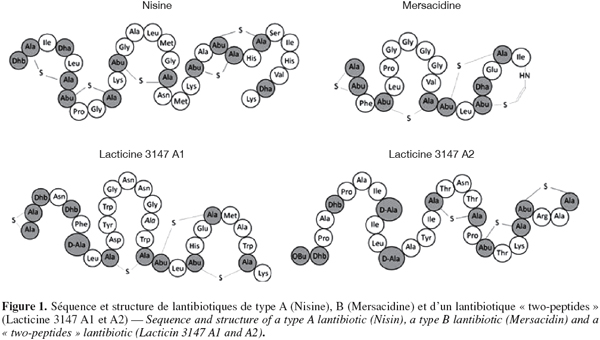
6Classe II. Peptides de taille inférieure à 10 kDa, stables à la chaleur, ne contenant pas d'acides aminés modifiés. Leur point isolélectrique varie entre 8 et 10. Les séquences de quelques bactériocines appartenant à cette classe se trouvent au tableau 1. Cette classe est divisée en trois sous-classes. Les bactériocines de la sous-classe IIa contiennent entre 27 et 48 acides aminés et ont toutes une partie N-terminale hydrophobe contenant la séquence consensus YGNGV ainsi qu'un pont disulfure et une partie C-terminale moins conservée, hydrophobe ou amphiphile qui détermine la spécificité d'action (Fimland et al., 2000 ; Richard et al., 2006). Elles ont toutes une activité contre Listeria monocytogenes. Certaines bactériocines de cette sous-classe contiennent également un deuxième pont disulfure dans leur domaine C-terminale qui semble être important dans la stabilisation de la structure tertiaire. Il semble par ailleurs qu'il leur conférerait une meilleure activité antimicrobienne, une meilleure résistance à l'exposition à des hautes températures et un spectre d'action plus large (Eijsink et al., 1998 ; Fimland et al., 2000 ; Drider et al., 2006 ; Richard et al., 2006). La sous-classe IIb comprend les bactériocines ayant besoin de deux peptides pour avoir une activité. Deux types de bactériocines de classe IIb peuvent être distingués : le type E (Enhancing) où la fonction d'un des deux peptides est d'augmenter l'activité de l'autre et le type S (Synergy) où les deux peptides sont complémentaires. La sous-classe IIc contient les bactériocines ne pouvant pas être classées dans les autres sous-classes.

7Classe III. Protéines de taille supérieure à 30 kDa et sensibles à la chaleur. La structure et le mode d'action de ces bactériocines diffèrent complètement des autres bactériocines produites par les bactéries lactiques. Cette classe ne contient que quatre bactériocines : l'helveticin J produite par Lactobacillus helveticus A, l'enterolysin A produite par Enterococcus faecium, la zoocin A produite par Spreptococcus zooepidemicus et la millericin B produite par Streptococcus milleri (Nilsen et al., 2003 ; Papagianni, 2003 ; Nigutova et al., 2007).
8Classe IV. Peptides requérant une partie carbohydratée ou lipidique pour avoir une activité. Aucune bactériocine de cette classe n'a été décrite.
4. Le mécanisme de production des bactériocines et sa régulation
9Différentes protéines sont impliquées dans la production des bactériocines et sa régulation. Les bactériocines sont produites sous forme d'un prépeptide non-biologiquement actif qui subira des modifications post-traductionnelles pour aboutir au peptide actif. Cette production est souvent régulée par un système de Quorum Sensing, un mécanisme permettant à certains gènes d'être exprimés en fonction de la densité de la population bactérienne.
4.1. Les lantibiotiques
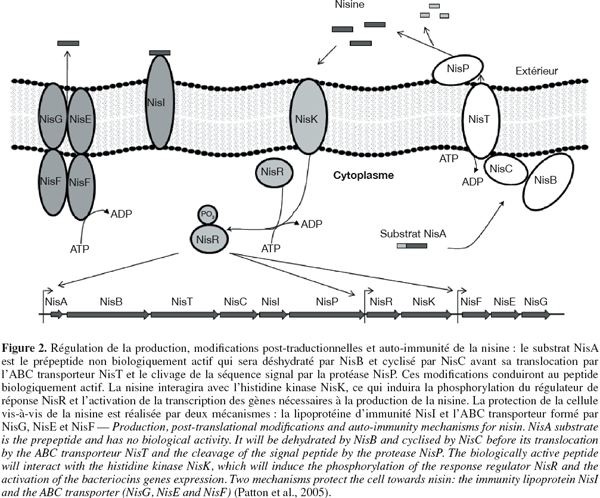
10L'organisation génétique et le mécanisme de production d'un lantibiotique, la nisine, est montrée à la figure 2. Les gènes de biosynthèse des lantibiotiques ont été désignés par le symbole commun Lan, avec un nom plus spécifique pour chaque lantibiotique (nis pour la nisine, par exemple). Le gène de structure, LanA, code pour un prépeptide contenant une séquence N-Terminale de 23 à 30 acides aminés qui sera clivée lors du transport à l'extérieur de la cellule. Ce prépeptide subira différentes modifications post-traductionnelles afin d'acquérir les quatre acides aminés inhabituels. La première étape de ces modifications consiste en la déshydratation de la sérine et de la thréonine pour former la déhydroalanine et la déhydrobutyrine. La deuxième étape consiste en la formation d'un lien thioéther entre ces résidus déshydratés et les cystéines environnantes, donnant aux lantibiotiques une structure cyclique. Les enzymes impliquées sont une déshydratase et une cyclase codée soit par les gènes LanB et LanC ou le gène LanM. Après ces modifications, le prépeptide sera clivé lors de l'excrétion hors de la cellule par la protéase LanP ou le domaine protéasique de l'ABC transporteur LanT. Cette dernière modification permettra d'obtenir le peptide biologiquement actif (McAuliffe et al., 2001 ; Kleerebezem, 2004 ; Xie et al., 2004 ; Patton et al., 2005). La production des lantibiotiques est sous le contrôle d'un mécanisme de régulation à deux composantes basé sur le Quorum Sensing. Une histidine kinase LanK réagira à un stimulus extérieur et induira la phosphorylation d'un régulateur de réponse LanR. Ce régulateur de réponse phosphorylé va permettre l'activation de l'expression de l'opéron. Le stimulus extérieur est la bactériocine elle-même qui est présente dans la culture à basse concentration en début de croissance. Elle s'accumule et quand un certain seuil est atteint, elle interagit avec le système de régulation pour activer la transcription du gène de structure mais également de ceux d'immunité et de transport, on parlera donc d'autorégulation (McAuliffe et al., 2001 ; Twomey et al., 2002 ; Kleerebezem, 2004 ; Patton et al., 2005). Les quatre gènes LanI, LanF, LanE et LanG codent pour des protéines impliquées dans l'immunité de la souche vis-à-vis de la bactériocine qu'elle produit. Bien que le mécanisme d'action ne soit pas complètement compris, il semblerait que LanI est une lipoprotéine qui s'attache à la surface externe de la membrane et interagit avec le lantibiotique afin de l'empêcher d'y former des pores. LanF, LanE et LanG forment un ABC transporteur. Il permettrait d'exporter à l'extérieur de la membrane cytoplasmique les lantibiotiques qui n'auraient pas interagi avec la lipoprotéine LanI et qui s'y trouveraient, l'empêchant ainsi de former des pores (McAuliffe et al., 2001 ; Twomey et al., 2002 ; Stein et al., 2003 ; Lubelski et al., 2008).
4.2. Les bactériocines de classe II
11La figure 3 montre l'organisation génétique de l'opéron codant pour deux bactériocines de classe IIa, la sakacin P et la piscicolin 126, ainsi que pour une bactériocine de classe IIb, l'ABP118. Les bactériocines de classe IIa sont également produites sous la forme d'un pré-peptide non biologiquement actif dont la séquence N-terminal très conservée, appelée séquence signal et contenant une vingtaine d'acides aminés, sera clivée du côté C-terminal d'un motif GG par le domaine protéasique de l'ABC transporteur lors de l'excrétion pour donner le peptide biologiquement actif (Ennahar et al., 2000). Avec la formation d'un ou deux ponts disulfures cruciaux pour l'activité, ce sera la seule transformation post-traductionnelle (Drider et al., 2006). Certaines bactériocines de classe IIa sont excrétées par le « sec-dependent pathways » revu par Keyser et al. (2003) et basé sur la translocation du peptide par un pore aqueux composé de plusieurs protéines (van Wely et al., 2001 ; Ruch et al., 2007). Les peptides signaux de ces bactériocines ne contiennent donc pas de doublet glycine mais bien la séquence signal typique des protéines secrétées par ce système qui sera clivé par une peptidase durant la translocation (van Wely et al., 2001 ; De Kwaadsteniet et al., 2006 ; Sanchez et al., 2007).
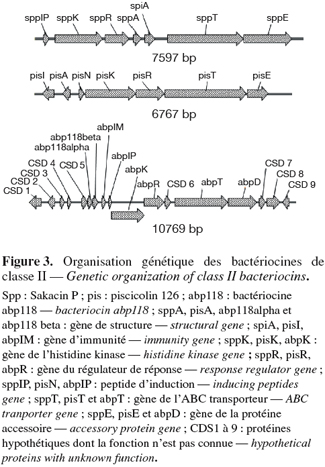
12La régulation de la production des bactériocines de classe IIa est sous le contrôle d'un système de Quorum Sensing à trois composantes qui sont un peptide d'induction, une histidine kinase et un régulateur de réponse. Les gènes codant pour ces trois protéines sont co-transcrits (Eijsink et al., 2002). Le peptide d'induction est produit à basse concentration comme un prépeptide de bas poids moléculaire, sans ou avec une très faible activité inhibitrice, stable à la chaleur, cationique et hydrophobe et dont la partie N-Terminal est clivée au niveau d'un doublet glycine lors de l'excrétion par l'ABC transporteur également impliqué dans l'excrétion de la bactériocine (Ennahar et al., 2000 ; Eijsink et al., 2002). A une certaine concentration externe du peptide d'induction, l'histidine kinase transmembranaire est activée, ce qui induit la phosphorylation du régulateur de réponse et l'activation de l'expression des gènes de structure, d'immunité et de transport mais également du système de régulation à trois composantes. Le système est donc auto-induit (Eijsink et al., 2002 ; Drider et al., 2006). Cependant, il a été récemment suggéré que le gène codant pour le régulateur de réponse de la sakacin P (sppR), une bactériocine de classe IIa, pouvait produire deux protéines : une protéine complète et cette même protéine dont l'extrémité N-terminal est tronquée. Cette deuxième protéine tronquée peut alors réprimer l'expression des gènes codant pour la sakacin P, probablement en interférant avec l'action de la molécule complète (Straume et al., 2007).
13Les gènes codant pour la production des bactériocines de classe IIa sont, la plupart du temps, organisés en trois opérons, le premier contenant les gènes de structure et d'immunité, le deuxième les gènes nécessaires à la sécrétion de la bactériocine (l'ABC transporteur et une protéine accessoire) et le troisième les gènes du système de régulation à trois composantes. Le gène d'immunité code pour une protéine intracellulaire qui, en interagissant avec le complexe membranaire formé par la bactériocine et la « mannose perméase » (voir ci-dessous), l'empêche de former des pores dans la membrane de la cellule productrice (Diep et al., 2007).
14Peu d'informations sont disponibles concernant la régulation de la production des bactériocines de classe IIb. Néanmoins, il a été montré qu'un système de régulation à trois composantes identique à celui retrouvé pour les bactériocines de classe IIa est impliqué dans la production de l'ABP-118 par Lactobacillus salivarius subsp. salivarius UCC118 et des plantaricin E/F et J/K par Lactobacillus plantarum C11 (Flynn et al., 2002 ; Oppegard et al., 2007).
5. Les mécanismes d'action des bactériocines
15Le siège d'activité des bactériocines est la membrane cellulaire, raison pour laquelle les bactériocines n'ont pas d'activité contre les bactéries Gram-. Cependant, les mécanismes d'action des bactériocines sur la membrane sont variés.
5.1. Les lantibiotiques
16Les lantibiotiques interagissent avec la membrane cellulaire par des interactions électrostatiques ou par liaison à des récepteurs spécifiques tels que le lipide II (undecaprenyl-pyrophosphoryl-MurNAc-pentapeptides-GlcNAc), un précurseur de peptidoglycanes. Suite à cette liaison, les lantibiotiques peuvent former des pores larges et non spécifiques dans la membrane cytoplasmique, ce qui va causer l'efflux rapide des petits composés cytoplasmiques tels que les ions, les acides aminés, l'ATP, etc. Cette augmentation de la perméabilité membranaire va conduire à la dissipation des deux composantes de la force proton motrice, à la cessation rapide des activités cellulaires et à la mort de la cellule. L'interaction avec le lipide II permet d'augmenter la stabilité des pores formés et de réduire la concentration du lantibiotique nécessaire à la formation des pores, mais peut également conduire à l'inhibition de la synthèse de la paroi cellulaire (McAuliffe et al., 2001 ; Twomey et al., 2002 ; Bauer et al., 2005 ; Patton et al., 2005).
17Les lantibiotiques de type A dissipent la force proton-motrice par formation de pores et interfèrent avec la synthèse des peptidoglycanes alors que la plupart des lantibiotiques de type B agissent par inhibition de la synthèse des peptidoglycanes. Néanmoins, certains forment également des pores dans la membrane des cellules cibles (Bauer et al., 2005; Patton et al., 2005). La nisine, un lantibiotique de type A, interagit avec le lipide II au niveau du MurNAc tandis que la mersacidine, un lantibiotique de type B, interagit avec le GlcNAc du lipide II (Willey et al., 2007).
18Les lantibiotiques composés de deux peptides comme la lacticine 3147 agissent également par formation de pores dans la membrane des cellules cibles (McAuliffe et al., 2001). La lacticine 3147 (Figure 1) a un spectre d'action large. Le peptide A1 a une activité qui est plus élevée en présence du peptide A2. Il a été récemment proposé que la lacticine 3147 A1 agit en se liant au lipide II, inhibant la synthèse des peptidoglycanes et permettant à la lacticine 3147 A2 de former un pore dans la membrane de la cellule cible (Morgan et al., 2005 ; Wiedemann et al., 2006).
5.2. Les bactériocines de classe II
19Le mécanisme d'action supposé des bactériocines de classe IIa est l'interaction de la bactériocine avec la membrane ou un récepteur spécifique, la « mannose perméase », pour ensuite former un pore dans la membrane de la cellule, ce qui induit la perméabilisation de la membrane, la dissipation des deux composantes de la force proton motrice et la mort de la cellule (Dalet et al., 2000 ; Héchard et al., 2001 ; Gravesen et al., 2002 ; Arous et al., 2004 ; Vadyvaloo et al., 2004 ; Bauer et al., 2005). Le mécanisme de formation des pores n'est pas connu, même si l'hypothèse la plus courante est l'association de différentes molécules de la bactériocine (Ennahar et al., 2000 ; Fimland et al., 2000 ; Diep et al., 2007).
20Les bactériocines de classe IIb ont en général un spectre d'action inhibant une large gamme de bactéries Gram+. Elles forment des pores et rendent la membrane perméable à différentes petites molécules, des cations monovalents ou des anions, ce qui dissipe une ou les deux composantes de la force proton motrice. Les ions transportés sont spécifiques de la bactériocine (Oppegard et al., 2007). Le ratio optimal d'activité entre les deux sous-unités est en général de 1:1 mais il est de 4:1 pour la lactocine 705 (Castellano et al., 2007 ; Oppegard et al., 2007). Néanmoins, les mécanismes d'interaction des deux bactériocines entre elles et avec la membrane cellulaire ne sont que très peu connus. Il a été montré qu'il n'y avait pas de liaison au même récepteur que pour les bactériocines de classe IIa (la « mannose perméase ») (Diep et al., 2007). Castellano et al. (2007) ont récemment montré que les deux peptides composant la lactocine 705 ont des activités bien spécifiques. La lactocine 705α interagit avec la surface de la membrane cellulaire et la déshydrate, ce qui permet à la lactocine 705β de former des pores.
5.3. Les bactériocines de classe III
21Le mode d'action de ces bactériocines diffère complètement des bactériocines des autres classes. En effet, l'enterolysin A, la zoocin A et la millericin B agissent par l'hydrolyse des liens peptidiques des peptidoglycanes des cellules sensibles. La zoocin A a un spectre d'action étroit alors que l'enterolysin A et la millericin B ont un spectre d'action large. L'helveticin J a un mode d'action bactéricide (Nilsen et al., 2003).
6. La production et le conditionnement des bactériocines
6.1. La production des bactériocines
22Les bactériocines sont généralement produites à la fin de la phase exponentielle et au début de la phase stationnaire de croissance. Elles peuvent ensuite être dégradées par les protéases produites par la bactérie lactique productrice (Savijoki et al., 2006) ou être adsorbées à sa surface, ce qui mène à la baisse de la concentration de bactériocines dans la culture. Les facteurs influençant la production de bactériocines sont principalement la souche productrice, la température, le pH, la composition du milieu et la technologie de fermentation employée.
23Comme l'ont montré Moretro et al. (2000) pour la production de sakacin P par L. sakei, une même bactériocine peut être produite par des souches ou espèces différentes dont la capacité de production peut être variable. Lors d'une optimisation de production, si différentes souches sont disponibles, le choix de la souche pourra être déterminant.
24Les conditions de culture influencent fortement la production de bactériocines. En effet, l'optimalisation de la croissance ne résulte pas nécessairement en l'optimalisation de la production de bactériocines (Parente et al., 1999). Il a même été suggéré que des conditions de croissance défavorables permettent de stimuler leur production (Verluyten et al., 2004). Les températures et pH optimaux de production sont souvent inférieurs à ceux optimaux pour la croissance. C'est par exemple le cas pour la production de bactériocine par L. curvatus LTH1174 (Messens et al., 2003), Leuconostoc mesenteroides L124 et L. curvatus L442 (Mataragas et al., 2003), de sakacin P par L. sakei CCUG42687 (Moretro et al., 2000), d'amylovorin L471 par L. amylovorus DCE471 (De Vuyst et al., 1996) et de pediocin PA-1 par Pediococcus damnosus (Nel et al., 2001).
25La composition du milieu, tout particulièrement les sources et concentrations de carbone et azote, affectent fortement la production de bactériocines. Les bactéries lactiques productrices requièrent de nombreux nutriments pour leur croissance et des milieux riches contenant de l'extrait de viande, de levure et des hydrolysats de protéines sont nécessaires. Il a déjà été montré que l'augmentation des concentrations en extrait de levure, extrait de viande ou peptone peut permettre une augmentation de la production de bactériocines (Aasen et al., 2000 ; Nel et al., 2001 ; Mataragas et al., 2004 ; Todorov et al., 2004 ; Verluyten et al., 2004). D'autre part, quelques études ont montré que la source de carbone utilisée et sa concentration est un facteur important dans l'optimisation de la production de bactériocines (Leal-Sanchez et al., 2002 ; Leroy et al., 2006 ; Chen et al., 2007 ; Anastasiadou et al., 2008). L'ajout de ces nutriments lors d'une culture fed-batch permet souvent d'augmenter la production comparativement à une culture en batch (Callewaert et al., 2000 ; Lv et al., 2005 ; Pèrez Guerra et al., 2005).
26L'utilisation de la technique des cellules immobilisées peut permettre d'augmenter la durée et la stabilité de la production de bactériocines. Les cellules peuvent être immobilisées dans des biofilms ou des billes d'alginates de calcium. Cette technique a déjà été utilisée avec succès pour la lacticine 3147 et la nisine (Scannell et al., 2000 ; Pongtharangkul et al., 2006).
6.2. Le conditionnement des bactériocines
27Il est très difficile de conditionner les bactériocines sous une forme purifiée. La purification des bactériocines est une procédure longue et couteuse qui nécessite la mise en œuvre de nombreuses techniques, à savoir une précipitation des protéines au sulfate d'ammonium, différentes combinaisons de chromatographies sur colonne telles que des échanges d'ions ou des interactions hydrophobes et une étape finale de chromatographie liquide à haute performance en phase inverse. Ces traitements ne sont pas applicables à l'échelle industrielle. La stratégie souvent mise en œuvre consiste dès lors en l'adsorption de la bactériocine sur la cellule productrice suivie d'une centrifugation ou d'une ultrafiltration de la culture et de la désorption de la bactériocine par abaissement du pH à 2 et augmentation de la concentration en chlorure de sodium. Les bactériocines semi-purifiées peuvent alors être conditionnées sous forme sèche par atomisation ou lyophilisation par exemple (Parente et al., 1999). La nisine, la seule bactériocine légalement approuvée comme additif alimentaire, est commercialisée sous une forme semi-purifiée.
7. Les applications des bactériocines dans l'industrie alimentaire
7.1. Les propriétés des bactériocines pour une application alimentaire
28Les bactériocines sont habituellement reconnues comme sûres, sont sensibles aux protéases digestives et ne sont pas toxiques pour les cellules eucaryotes (Wijaya et al., 2006). Elles ont une grande tolérance aux variations de pH et aux traitements thermiques. Leur spectre antimicrobien peut être large ou étroit, elles peuvent donc cibler sélectivement des bactéries pathogènes ou altérantes sans inhiber les bactéries indispensables et ont un mode d'action bactéricide (Galvez et al., 2007). Les bactériocines doivent cependant être considérées comme un moyen de préservation complémentaire à ceux déjà existant (Deegan et al., 2006).
7.2. L'application des bactériocines dans le secteur alimentaire
29Les bactériocines peuvent être appliquées sous une forme purifiée, semi-purifiée ou sous la forme d'un concentré obtenu après fermentation d'un substrat alimentaire. Les bactéries productrices peuvent également être appliquées dans les produits alimentaires, la bactériocine sera alors produite in situ.
30L'application de la bactériocine. Les bactériocines purifiées ou semi-purifiées sont appliquées après production en fermenteur, purification ou semi-purification et conditionnement par les techniques adéquates, qui peuvent être relativement couteuses. D'un point de vue législatif, une telle préparation est considérée comme un additif alimentaire. Jusqu'à présent, seule la nisine, un lantibiotique, est acceptée comme additif alimentaire (E234) (Guinane et al., 2005).
31Les bactériocines peuvent également être appliquées sous la forme d'un concentré obtenu après fermentation par la souche productrice et atomisation d'un substrat alimentaire tel que le lait, par exemple. Cette préparation sera considérée comme un ingrédient fermenté. Elle contiendra la bactériocine mais également d'autres métabolites microbiens tels que l'acide lactique. La pédiocine, une bactériocine de classe IIa, est commercialisée sous cette forme sous le nom ALTA 2341. Des essais ont été récemment fait avec la lacticine 3147, un lantibiotique (Deegan et al., 2006 ; Galvez et al., 2007). Au niveau législatif, cette forme ne nécessite pas d'approbation. Cependant, si la culture n'est pas traditionnellement consommée, il faudra se référer à la législation sur les « novel food » (EC258/97).
32Un autre mode d'application des bactériocines consiste en leur immobilisation sur les cellules productrices, dans des gels ou des films telle que l'alginate de calcium, la gélatine, la cellulose, les protéines de soja, des films de polysaccharides, etc. La bactériocine sera alors libérée dans le produit au cours de la conservation. Depuis peu, des emballages en polyéthylène ou d'autres films plastiques contenant des bactériocines ont été développés. Ces emballages permettent de réduire la croissance des microorganismes pathogènes ou indésirables pouvant se développer en surface durant la conservation du produit (Luchansky et al., 2004 ; Deegan et al., 2006 ; Ghalfi et al., 2006 ; Galvez et al., 2007).
33L'application de la bactérie productrice de bactériocines. L'utilisation des bactéries productrices de bactériocines peut être intéressante tant au niveau législatif qu'économique. Les bactéries productrices de bactériocines peuvent être ajoutées comme starter dans des produits fermentés ou comme culture protectrice. Elles doivent être capables de croître et de produire des bactériocines dans l'aliment à conserver. La composition du produit (nutriments accessibles, pH, additifs alimentaires, etc.) et les conditions de stockage (température, atmosphère, activité d'eau, etc.) doivent donc permettre la croissance et la production de bactériocines. Cette production étant souvent sous le contrôle d'un système de Quorum Sensing, la concentration en molécule inductrice doit être suffisante, son interaction avec la matrice alimentaire peut donc être un facteur limitant.
34Si les bactéries sont ajoutées en tant que starter dans des produits fermentés, elles doivent pouvoir conférer au produit les propriétés organoleptiques désirables tout en produisant des bactériocines. Les bactéries productrices de bactériocines peuvent être également ajoutées en combinaison avec un autre starter qui conférera les propriétés organoleptiques désirables. Dans ce cas, la bactérie productrice de bactériocines ne doit pas détériorer les qualités organoleptiques de l'aliment fermenté et la bactériocine produite ne doit pas avoir d'activité contre le starter (Deegan et al., 2006 ; Galvez et al., 2007).
35Si la bactérie est appliquée en tant que culture protectrice, elle doit être capable de produire sa bactériocine sans modifier les propriétés organoleptiques (Rodgers, 2001). La concentration cellulaire maximale atteinte dans le produit doit par ailleurs être inférieure à la limite de 106 cfu.g-1 généralement admise pour les produits non fermentés.
7.3. Les facteurs influençant l'activité des bactériocines dans les produits alimentaires
36Lors d'une application alimentaire, la composition du produit est un des premiers facteurs pouvant réduire ou totalement dissiper l'activité de la bactériocine de par son adsorption sur des composantes du produit, la limitation de sa solubilité et de sa diffusion, sa dégradation par des protéases, l'interaction avec des additifs alimentaires ou des ingrédients et/ou un pH inapproprié. Les traitements appliqués aux produits constituent un deuxième facteur pouvant limiter l'activité inhibitrice dans un produit alimentaire. En effet, des traitements thermiques trop élevés peuvent dégrader les bactériocines présentes. La température de stockage pourra également réduire l'activité des bactériocines, qui varie en fonction de la température (Galvez et al., 2007).
37Un autre facteur limitant l'activité des bactériocines est la flore autochtone, principalement sa concentration, la présence de bactéries résistantes, la présence de microorganismes produisant des protéases dégradant la bactériocine et l'état physiologique de cette flore. Un état physiologique stationnaire ou stressé ainsi que la formation de spores peut conduire à une résistance accrue. En outre, dans les produits solides, les bactéries forment des microcolonies ou des biofilms dont la résistance aux bactériocines peut être plus élevée (Schöbitz et al., 2003).
38D'autre part, il sera également important de considérer l'impact de la bactériocine sur la flore résidente favorable des aliments. Si celle-ci est sensible à la bactériocine, son déséquilibre pourra conduire à la croissance de microorganismes résistants aux bactériocines, pathogènes et/ou altérants avec des conséquences sanitaires et/ou organoleptiques défavorables. A notre connaissance, malheureusement, cet aspect n'a pas encore été étudié en détail.
39Ces phénomènes peuvent conduire à :
40– une absence totale d'activité antimicrobienne,
41– une inhibition partielle des bactéries cibles,
42– une diminution initiale de la concentration des bactéries cibles sous la limite de détectabilité suivie d'une reprise de croissance au cours du stockage, un phénomène appelé « rebond »,
43– un effet inacceptable sur l'état sanitaire et/ou sur les qualités organoleptiques (Bouttefroy et al., 2000 ; Vignolo et al., 2000 ; Schöbitz et al., 2003 ; Kouakou et al., 2008).
7.4. La combinaison de différentes bactériocines pour augmenter la durée de vie du produit
44La combinaison de différentes bactériocines permet d'augmenter l'activité et le spectre d'action, tout particulièrement en combinant des bactériocines appartenant à des classes différentes (Vignolo et al., 2000). Cependant, une attention toute particulière devra être portée au développement de résistances chez les bactéries cibles. Le mécanisme de résistance aux bactériocines de classe IIa, par exemple, semble être identique pour toutes les bactériocines de cette sous-classe. Une bactérie résistante à une bactériocine de classe IIa sera donc résistante à d'autres bactériocines de classe IIa. D'autre part, des « cross-resistances », c'est-à-dire l'apparition de résistance à des bactériocines de classes différentes chez une bactérie cible, peuvent également être observées (Deegan et al., 2006 ; Naghmouchi et al., 2007).
7.5. La combinaison des bactériocines avec d'autres agents
45La combinaison des bactériocines avec d'autres traitements de conservation chimique ou physique donne des résultats prometteurs pour la conservation des aliments. Les molécules chimiques peuvent être des acides organiques, le nitrite, le chlorure de sodium, l'éthanol, des huiles essentielles (l'impact sur les propriétés organoleptiques doit être soigneusement évalué) ou des agents chélatants tel que l'EDTA, le phosphate trisodique, le citrate. Ces agents chélatants permettent de séquestrer les ions magnésium des lipopolysaccharides de la membrane externe des bactéries Gram- permettant aux bactériocines d'atteindre la membrane interne, siège de leur activité. Les traitements physiques peuvent être des traitements thermiques, le stockage sous atmosphère contrôlé, l'application de champs électriques ou l'application des hautes pressions (Rodgers, 2004 ; Deegan et al., 2006 ; Galvez et al., 2007). D'autre part, l'utilisation d'inhibiteurs de protéases ou de protéines de soja a été suggérée afin de prévenir la dégradation des bactériocines par les protéases présentes dans le produit à conserver (Kouakou et al., 2008).
8. Conclusion
46Les bactériocines sont des peptides antimicrobiens produits par certaines souches de bactéries lactiques et dont beaucoup ont une activité contre des bactéries pathogènes tels que L. monocytogenes. Ces bactériocines ont des atouts indéniables pour représenter une technologie douce de préservation des aliments. Cependant, leur utilisation est soumise à de nombreuses contraintes. Celles-ci sont liées principalement à la production de la bactériocine et de la souche productrice et leur conditionnement, au produit à conserver et à la législation en vigueur pour les bactériocines considérées jusqu'à présent comme des additifs alimentaires.
Bibliographie
Aasen I. et al., 2000. Influence of complex nutrients, temperature and pH on bacteriocin production by L. sakei CCUG 42687. Appl. Microbiol. Biotechnol., 53, 159-166.
Abee T., 1995. Pore-forming bacteriocins of Gram+ bacteria and self-protection mechanisms of producer organisms. FEMS Microbiol. Lett., 129, 1-9.
Anastasiadou S., Papagianni M., Ambrosiadis I. & Koidis P., 2008. Rapid quantifiable assessment of nutritional parameters influencing pediocin production by Pediococcus acidilactici NRRL B5627. Bioresource Technol., 99(14), 6646-6650.
Arous S., Dalet K. & Héchard Y., 2004. Involvement of the mpo operon in resistance to class IIa bacteriocins in L. monocytogenes. FEMS Microbiol. Lett., 238, 37-41.
Bauer R. & Dicks L.M.T., 2005. Mode of action of lipid II-targeting lantibiotics. Int. J. Food Microbiol., 101, 201-216.
Bouttefroy A. & Millière J.B., 2000. Nisin-curvaticin 13 combinations for avoiding the regrowth of bacteriocin resistant cells of L. monocytogenes ATCC15313. Int. J. Food Microbiol., 62, 65-75.
Callewaert T. & De Vuyst L., 2000. Bacteriocin production with L. amylovorus DCE471 is improved and stabilized by fed-batch fermentation. Appl. Environ. Microbiol., 66(2), 606-613.
Castellano P. et al., 2007. Molecular view by fourier transform infrared spectroscopy of the relationship between lactocin 705 and membranes: speculations on antimicrobial mechanism. Appl. Environ. Microbiol., 73(2), 415-420.
Chen Y.S., Srionnual S., Onda T. & Yanagida F., 2007. Effects of prebiotic oligosaccharides and trehalose on growth and production of bacteriocins by lactic acid bacteria. Lett. Appl. Microbiol., 45, 190-193.
Dalet K., Briand C., Cenatiempo Y. & Héchard Y., 2000. The rpoN gene of Enterococcus faecalis directs sensitivity to subclass IIa bacteriocins. Curr. Microbiol., 41(6), 441-443.
Deegan L.H., Cotter P.D., Hill C. & Ross P., 2006. Bacteriocins: biological tools for bio-preservation and shelf-life extension. Int. Dairy J., 16, 1058-1071.
De Kwaadsteniet M., Fraser T., Van Reenen C.A. & Dicks L.M., 2006. Bacteriocin T8, a novel class IIa sec-dependent bacteriocin produced by Enterococcus faecium T8, isolated from vaginal secretions of children infected with human immunodeficiency virus. Appl. Environ. Microbiol., 72(7), 4761-4766.
De Vuyst L., Callewaert R. & Crabbé K., 1996. Primary metabolite kinetics of bacteriocin biosynthesis by L. amylovorus and evidence for stimulation of bacteriocin production under unfavourable growth conditions. Microbiology, 142, 817-827.
Diep D., Salehian Z., Holo H. & Nes I.F., 2007. Common mechanisms of target cell recognition and immunity for class II bacteriocin. Proc. Natl Acad. Sci., 104, 2384-2389.
Drider D. et al., 2006. The continuing story of class IIa bacteriocin. Microbiol. Mol. Biol. Rev., 70(2), 564-582.
Eijsink V.G. et al., 1998. Comparative studies of class IIa bacteriocins of lactic acid bacteria. Appl. Environ. Microbiol., 64(9), 3275-3281.
Eijsink V.G. et al., 2002. Production of class II bacteriocins by lactic acid bacteria; an example of biological warfare and communication. Antonie Van Leeuwenhoek, 81(1-4), 639-654.
Ennahar S., Sashihara T., Sonomoto K. & Ishizaki A., 2000. Class IIa bacteriocins: biosynthesis, structure and activity. FEMS Microbiol. Rev., 24, 85-106.
Fimland G. et al., 2000. A C-terminal disulfide bridge in pediocin-like bacteriocins renders bacteriocin activity less temperature dependent and is a major determinant of the antimicrobial spectrum. J. Bacteriol., 182, 2643-2648.
Flynn S. et al., 2002. Characterization of the genetic locus responsible for the production of ABP-118, a novel bacteriocin produced by the probiotic bacterium L. salivarius subsp. salivarius UCC118. Microbiology, 148, 973-984.
Galvez A., Abriouel H., Lopez R.L. & Ben Omar N., 2007. Bacteriocin-based strategies for food biopreservation. Int. J. Food Microbiol., 120(1-2), 51-70.
Ghalfi H. et al., 2006. Bacteriocin activity by L. curvatus CWBI-B28 to inactivate Listeria monocytogenes in cold-smoked salmon during 4 degrees C storage. J. Food Protect., 69, 1066-1071.
Gravesen A. et al., 2002. High-level resistance to class IIa bacteriocins is associated with one general mechanism in L. monocytogenes. Microbiology, 148, 2361-2369.
Guinane C.M., Cotter P.D., Hill C. & Ross P., 2005. A review: microbial solutions to microbial problems; lactococcal bacteriocins for the control of undesirable biota of food. J. Appl. Microbiol., 98, 1316-1325.
Héchard Y., Pelletier C., Cenatiempo Y. & Frère J., 2001. Analysis of sigma(54)-dependent genes in Enterococcus faecalis: a mannose PTS permease (EII(Man)) is involved in sensitivity to a bacteriocin, mesentericin Y105. Microbiology, 147, 1575-1580.
Hugenholtz J. & Kleerebezem M., 1999. Metabolic engineering of lactic acid bacteria: overview of the approaches and results of pathway rerouting involved in food fermentations. Curr. Opin. Biotechnol., 10(5), 492-497.
Keyzer J., van der Does C. & Driessen A., 2003. The bacterial translocase: a dynamic protein channel complex. Cell. Mol. Life Sci., 60, 2034-2052.
Klaenhammer T.R., 1988. Bacteriocins of lactic acid bacteria. Biochimie, 70, 337-349.
Klaenhammer T.R., 1993. Genetics of bacteriocins produced by lactic acid bacteria. FEMS Microbiol. Rev., 12(1-3), 39-85.
Klaenhammer T.R., Barrangou R., Logan Buck B. & Azcarate-Peril M.A., 2005. Genomic features of lactic acid bacteria effecting bioprocessing and health. FEMS Microbiol. Rev., 29, 393-409.
Kleerebezem M., 2004. Quorum sensing control of lantibiotic production; nisin and subtilin autoregulate their own biosynthesis. Peptides, 25, 1405-1414.
Kouakou P. et al., 2008. Enhancing the antilisterial effect of L. curvatus CWBI-B28 in pork meat and cocultures by limiting bacteriocin degradation. Meat Sci., 80(3), 640-648
Leal-Sanchez M.V. et al., 2002. Optimization of bacteriocin production by batch fermentation of L. plantarum LPCO10. Appl. Environ. Microbiol., 68, 4465-4471.
Leroy F. et al., 2006. Sugars relevant for sourdough fermentation stimulate growth of and bacteriocin production by L. amylovorus DCE 471. Int. J. Food Microbiol., 12, 102-111.
Lubelski J. et al., 2008. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell. Mol. Life Sci., 65, 455-476.
Luchansky J.B. & Call J.E., 2004. Evaluation of nisin-coated cellulose casings for the control of L. monocytogenes inoculated onto the surface of commercially prepared frankfurters. J. Food Prot., 67, 1017-1021.
Lv W., Zhang X. & Cong W., 2005. Modelling the production of nisin by Lactococcus lactis in fed-batch culture. Appl. Microbiol. Biotechnol., 68, 322-326.
Mataragas M., Metaxopoulos J., Galiotou M. & Drosinos E.H., 2003. Influence of pH and temperature on bacteriocin production by Leuconostoc mesenteroides L124 and L. curvatus L442. Meat Sci., 64, 265-271.
Mataragas M., Drosinos E.H., Tsakalidou E. & Metaxopoulos J., 2004. Influence of nutrients on growth and bacteriocin production by Leuconostoc mesenteroides L124 and L. curvatus L442. Antonie van Leeuwenhoek, 85, 191-198.
McAuliffe O. & Hill C., 2001. Lantibiotics: structure, biosynthesis and mode of action. FEMS Microbiol. Rev., 25, 285-308.
Messens W., Verluyten J., Leroy F. & De Vuyst L., 2003. Modelling growth and bacteriocin production by L. curvatus LTH1174 in response to temperature and pH values used for European sausage fermentation processes. Int. J. Food Microbiol., 81, 41-52
Moretro T., Aasen I.M., Storro I. & Axelsson L., 2000. Production of sakacin P by L. sakei in a completely defined medium. J. Appl. Microbiol., 88(3), 536-545.
Morgan S.M. et al., 2005. Sequential actions of the two component peptides of the lantibiotic lacticin 3147 explain its antimicrobial activity at nanomolar concentration. Antimicrob. Agents Chemother., 49(7), 2606-2611.
Naghmouchi K., Kheadr E., Lacroix C. & Fliss I., 2007. Class I/class IIa bacteriocin cross-resistance phenomenon in L. monocytogenes. Food Microbiol., 24, 718-727.
Nel H.A., Bauer R., Vandamme E.J. & Dicks L.M., 2001. Growth optimization of Pediococcus damnosus NCFB1832 and the influence of pH and nutrients on the production of pediocin PD-1. J. Appl. Microbiol., 91, 1131-1138.
Nigutova K. et al., 2007. Production of enterolysin A by rumen Enterococcus faecalis strain and occurrence of enlA homologues among ruminal Gram+ cocci. J. Appl. Microbiol., 102(2), 563-569.
Nilsen T., Nes I.F. & Holo H., 2003. Enterolysin A, a cell wall-degrading bacteriocin from Enterococcus faecalis LMG2333. Appl. Environ. Microbiol., 69(5), 2975-2984.
Oppegard C. et al., 2007. The two-peptide class II bacteriocins: structure, production and mode of action. J. Mol. Microbiol. Biotechnol., 13(4), 210-219.
Papagianni M., 2003. Ribosomally synthesized peptides with antimicrobial properties: biosynthesis, structure, function and applications. Biotechnol. Adv., 21(6), 465-499.
Parente E. & Ricciardi A., 1999. Production, recovery and purification of bacteriocins from lactic acid bacteria. Appl. Microbiol. Biotechnol., 52, 628-638.
Patton G.C. & Van Der Donk W.A., 2005. New developments in lantibiotic biosynthesis and mode of action. Curr. Opin. Microbiol., 8, 543-551.
Pèrez Guerra N. et al., 2005. Fed-batch pediocin production by Pediococcus acidilactici NRRL B-5627 on whey. Biotechnol. Appl. Biochem., 42, 17-23.
Pongtharangkul T. & Demirci A., 2006. Evaluation of culture medium for nisin production in a repeated-batch biofilm reactor. Biotechnol. Prog., 22, 217-224.
Richard C. et al., 2006. Evidence on correlation between number of disulfide bridge and toxicity of class IIa bacteriocins. Food Microbiol., 23(2), 175-183.
Rodgers S., 2001. Preserving non-fermented refrigerated foods with microbial cultures: a review. Trends Food Sci. Technol., 12, 276-284.
Rodgers S., 2003. Potential applications of protective cultures in cook-chill catering. Food Control, 14(1), 35-42.
Rodgers S., 2004. Novel approaches in controlling safety of cook-chill meals. Trends Food Sci. Technol., 15, 366-372.
Rusch S. & Kendall D., 2007. Interactions that drive sec-dependent bacterial protein transport. Biochemistry, 46, 9665-9673.
Sanchez J. et al., 2007. Amino acid and nucleotide sequence, adjacent genes and heterologous expression of hiracin JM79, a sec-dependent bacteriocin produced by Enterococcus hirae DCH5, isolated from Mallard ducks (Anas platyrhynchos). FEMS Microbiol. Lett., 270, 227-236
Savijoki K., Ingmer H. & Varmanen P., 2006. Proteolytic systems of lactic acid bacteria. Appl. Microbiol. Biotechnol., 71, 394-406.
Scannell A.G. et al., 2000. Continuous production of lacticin 3147 and nisin using cells immobilized in calcium alginate. J. Appl. Microbiol., 89, 573-579.
Schöbitz R., Suazo V., Costa M. & Ciampi L., 2003. Effects of a bacteriocin-like inhibitory substance from Carnobacterium piscicola against human and salmon isolates of Listeria monocytogenes. Int. J. Food Microbiol., 84, 237-244.
Stein T., Heinzmann S., Solovieva I. & Entian K.D., 2003. Function of Lactococcus lactis nisin immunity genes nisI and nisFEG after coordinated expression in the surrogate host Bacillus subtilis. J. Biol. Chem., 278(1), 89-94.
Stiles M.E. & Holzapfel W., 1997. Lactic acid bacteria of foods and their current taxonomy. Int. J. Food Microbiol., 36(1), 1-29.
Straume D., Kjos M., Nes I.F. & Diep D.B., 2007. Quorum-sensing based bacteriocin production is down-regulated by N-terminally truncated species of gene activators. Mol. Genet. Genomics, 278(3), 283-293.
Todorov S.D. & Dicks L.M., 2004. Influence of growth conditions on the production of a bacteriocin by Lactococcus lactis subsp. lactis ST34BR, a strain isolated from barley beer. J. Basic Microbiol., 44, 305-316.
Twomey D., Ryan M., Meaney B. & Hill C., 2002. Lantibiotics produced by lactic acid bacteria: structure, function and applications. Antonie van Leeuwenhoek, 82, 165-185.
Vadyvaloo V., Snoep J.L., Hasting J.W. & Rautenbach M., 2004. Physiological implications of class IIa bacteriocin resistance in L. monocytogenes strains. Microbiology, 150, 335-340.
Van Wely K., Swaving J., Freudl R. & Driessen A., 2001. Translocation of proteins across the cell envelope of Gram+ bacteria. FEMS Microbiol. Rev., 25, 437-454.
Verluyten J., Leroy F. & De Vuyst L., 2004. Influence of complex nutrient source on growth of and curvacin A production by sausage isolated L. curvatus LTH 1174. Appl. Environ. Microbiol., 70, 5081-5088.
Vermeiren L., Devlieghere F. & Debevere J., 2004. Evaluation of meat born lactic acid bacteria as protective cultures for the biopreservation of cooked meat products. Int. J. Food Microbiol., 96(2), 149-164.
Vignolo G. et al., 2000. Combined effect of bacteriocins on the survival of various Listeria species in broth and meat system. Curr. Microbiol., 41, 410-416.
Wiedemann I. et al., 2006. The mode of action of the lantibiotic lacticin 3147 - a complex mechanism involving specific interaction of two peptides and the cell wall precursor lipid II. Mol. Microbiol., 61(2), 285-296.
Wijaya A., Neudeker C., Holzapfel W. & Franz C., 2006. Influence of bacteriocin-producing Enterococcus faecalis BFE 1071 on Lactobacillus spp. in the rat gastrointestinal tract. In: Proceedings of Food Micro, August 2006, University of Bologna, Bologna, Italy, 124.
Willey J.M. & van der Donk W.A., 2007. Lantibiotics: peptides of diverse structure and function. Annu. Rev. Microbiol., 61, 477-501.
Xie L. & van der Donk W.A., 2004. Post-translational modifications during lantibiotic biosynthesis. Curr. Opin. Chem. Biol., 8(5), 498-507.
To cite this article
About: Carine Dortu
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : dortu.c@fsagx.ac.be
About: Philippe Thonart
Gembloux Agricultural University – FUSAGx. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique).






