Origine et évolution du cannibalisme dans les populations animales : pourquoi manger son semblable ?
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : alabi.t@fsagx.ac.be
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Reçu le 6 août 2008, accepté le 6 janvier 2009
Résumé
Le cannibalisme est issu d’une déformation linguistique de la terminologie Arawak (Amérindiens des Antilles) caribal qui signifie courageux. Christophe Colomb l’emploie pour désigner les Indiens des Caraïbes réputés pour être des mangeurs d’hommes. Le cannibalisme est largement répandu au sein du règne animal. Sa pratique au sein de l’espèce humaine remonte au Paléolithique et persiste encore dans certaines sociétés actuelles, bien qu’elle ne répond pas exclusivement à des besoins alimentaires comme chez les autres espèces animales. Au regard de sa large distribution, il y a lieu de s’interroger sur les causes, origines et avantages évolutifs de ce comportement au sein du règne animal. Le cannibalisme est induit soit par des facteurs écologiques directement liés à une insuffisance des ressources alimentaires, à de fortes densités d’individus et à une hétérogénéité structurale de la population, soit par des facteurs sociaux comme des besoins de reproduction, ou des contraintes de soins parentaux face à une progéniture trop nombreuse. Les avantages de ce comportement sont les gains nutritionnel et énergétique, les gains de territoire pour vivre et se développer. Par contre, les inconvénients résident dans la réduction des effectifs et de la variabilité génétique de la population, ainsi que dans la possibilité de transmission de parasites, virus et de maladies.
Abstract
Origin and evolution of cannibalism in the animal populations: why to eat conspecific? The term «Cannibalism» is a linguistic distortion resulting from Arawak terminology (Amerindians in the Antilles) caribal that means courageous. Columbus uses it to describe Caribbean Indians identified as eaters of human flesh. Cannibalism behavior is widespread in the animal kingdom. It has occurred in human society since the paleolithic and many typologies of cannibalism have recently been described. Identifying the evolutionary causes and benefits of cannibalism in animal populations may provide information about its taxonomic diversity. In general cannibalism is favored by ecological factors related to the low availability of alternative food. It may also depend to varying degrees upon population density. Social factors, like competition for mates and offspring parental care when food is scare may also promote cannibalism behavior. Significant nutritional and energy benefits combined to a territorial advantage were provided by cannibalism. For many species cannibalism can strongly affect population dynamics and mortality rates with enhancing the risk of infection from parasites and viruses.
1. Introduction
1Une population est formée d’un ensemble d’individus d’une espèce occupant un territoire déterminé à un moment donné. Considérée comme une unité biologique fondamentale, elle est caractérisée par une série de variables d’état telles que l’effectif (ou la densité), la structure spatiale (modalités de distribution des individus dans le milieu), la structure démographique (âge et sexe), la structure génétique (fréquences alléliques) et l’organisation sociale (Ramade, 2001). Cependant, les populations naturelles (biocénose) ne peuvent s’appréhender de manière isolée : elles s’insèrent dans un biotope avec lequel elles constituent un écosystème. Selon la théorie de l’évolution, toute population constituée d'individus présentant des caractéristiques génétiques et reproductives peut évoluer en fonction de son biotope (Maynard Smith, 1978). La population est alors soumise à une dynamique de changements variables au cours du temps. Sous l’influence de pressions sélectives, la population évolue en s’adaptant pour les besoins de sa survie et sa pérennité (McFarland, 2001). Ainsi, le maintien par une population d’effectifs peu différents d’année en année résulterait d’un équilibre entre d’une part, son succès reproducteur et d’autre part, les ressources disponibles et divers facteurs antagonistes comme la compétition intraspécifique pour la nourriture, le territoire ou la survie, la sélection par la prédation, le parasitisme et la maladie (Krebs et al., 1993). Un tel équilibre peut être facilement rompu, impliquant ainsi des taux de mortalité d’autant plus élevés que la population est plus prolifique. Les chances d’un individu de survivre et de se reproduire dépendent fortement de son comportement et la sélection naturelle aura tendance à favoriser des animaux qui peuvent trouver de la nourriture, éviter les prédateurs, s’accoupler avec succès, et procurer des soins adéquats à leur progéniture, etc. (Krebs et al., 1993). Il est démontré que des espèces présentant des modes d’utilisation des ressources identiques ne peuvent continuer à coexister dans un environnement stable, la plus apte élimine l’autre (MacArthur, 1958). La compétition s’installe dès lors que plusieurs organismes utilisent des ressources communes présentes en quantité limitée (Ricklefs et al., 2005). La compétition intraspécifique est considérée comme un des processus majeurs de la régulation des populations. Ses effets se répercutent sur la valeur sélective des individus (Klomp, 1964). Généralement, le partage inéquitable des ressources résulte d'interactions ou d’interférence entre les compétiteurs et dépend donc de la mobilité des individus, de la fréquence de leur rencontre et de leur agressivité (Bakker, 1969 ; Ricklefs et al., 2005). Le degré ultime de l'interférence aboutit au cannibalisme (Crowley et al., 1987). Le cannibalisme est une forme spéciale de prédation qui survient au sein d'une espèce dont les individus s'entre-dévorent (Ramade, 2001) et ses effets sont autorégulateurs pour les populations qui le pratiquent (Begon et al., 1996 ; Begon, 2006).
2Traditionnellement, le cannibalisme est considéré comme un comportement anormal et de faible intérêt évolutif ou écologique (Elgar et al., 1992). Des raisons sociologiques peuvent en partie expliquer pourquoi le cannibalisme a été négligé dans la littérature scientifique mais il est aussi reconnu que la fréquence du cannibalisme, comparativement à d’autres comportements (communication, reconnaissance des congénères, reproduction, etc.), est une raison de ce désintérêt (Bailey et al., 1987). Toutefois, des observations ont très vite permis de se rendre compte des apports nutritionnels du cannibalisme dans l’augmentation de la survie, de la fécondité, de la durée de développement des individus cannibales soumis à diverses pressions de sélection (Ho et al., 1996). Le cannibalisme est considéré comme une stratégie de foraging dont les variables sont les conditions environnementales plutôt liées à la densité de population et de proies, l’hétérogénéité structurale de la population qu’à toute influence génétique (Hecht et al., 1993 ; Braband, 1995 ; Fessahaye et al., 2004 ; Svenning et al., 2005).
2. Origine, évolution et distribution taxonomique du cannibalisme
3Le cannibalisme est largement répandu au sein du règne animal, des arthropodes (arachnides et insectes en particulier) jusqu'aux vertébrés où il se rencontre chez les poissons, les oiseaux, les rongeurs et les sociétés humaines (Elgar et al., 1992 ; Hseu, 2002). Fox estimait en 1975 que plus de trois quart des espèces cannibales vivaient en milieu terrestre, les espèces cannibales aquatiques étant surtout présentes dans les eaux douces. Cette large distribution au sein de différents groupes taxonomiques permet de comprendre son importance. Le cannibalisme se développe dans divers contextes dont notamment l’infanticide, l’accouplement, les parades nuptiales, l’oophagie et les interactions compétitives.
4Le cannibalisme est généralement associé à une asymétrie de taille et de stade de développement entre la victime et l’individu cannibale (Claessens et al., 2003 ; Persson et al., 2003). Généralement, la proie est à un stade de vie plus vulnérable que le cannibale (Tableau 1). La disparité de taille et de forme est considérée comme un facteur de choix au sein des populations (Claessens et al., 2003) puisque les individus cannibales sont généralement de morphologie plus grande que leurs victimes (Polis, 1981). Cela est d’autant plus vrai que la croissance est caractérisée par plusieurs stades de développement (Persson et al., 2003).
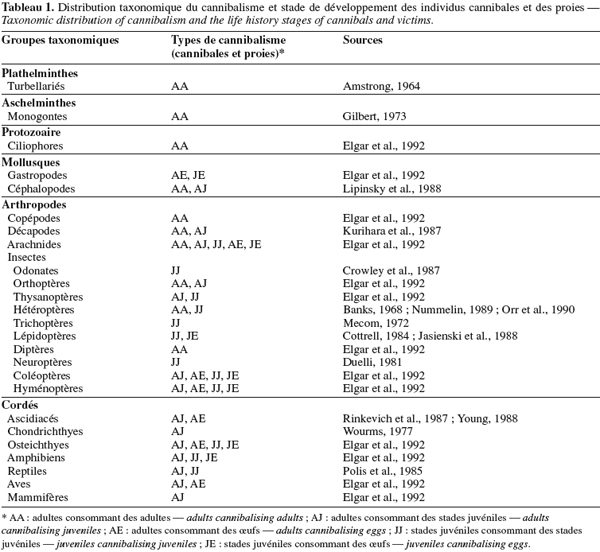
5Conformément à la théorie de l’évolution, le maintien et l’évolution du cannibalisme ne se feront au sein d’une population que si les avantages directs et indirects induits sont supérieurs aux couts engendrés pour le réguler (Elgar et al., 1992).
2.1. Le cannibalisme chez les humains
6Issue d’une altération du terme caribal des caraïbes qui signifie hardi, homme cruel et féroce, la terminologie " cannibalisme " est apparue au 18e siècle (Encyclopaedia Universalis, 2009). Bien qu’il soit considéré par les sociétés occidentales comme un interdit capital à l’instar de l’inceste, sa pratique par les sociétés humaines est très ancienne et remonte à l’époque préhistorique (Freud, 1913). Phénomène social et ritualisé d’une part, effroyable, cruel et abject d’autre part, le cannibalisme a systématiquement été pratiqué dans l’espèce humaine depuis le Paléolithique jusqu’à nos jours (Patou-Mathis, 2002 ; Lindenbaum, 2004). Les populations d’Homo erectus, de Néandertaliens et d’Homo sapiens ont successivement eu recours au cannibalisme (Lindenbaum, 2004). La découverte des premiers indices anthropophagiques a déclenché de vives polémiques au sein du monde scientifique. Des divergences de vues sont apparues. Si toutefois le préhistorien White (1986 ; 1992) atteste l’existence du cannibalisme à Kaprina (Croatie), Trinkaus (1978) par contre le réfute et justifie les incisions observées sur les ossements humains de Kaprina par une action de nettoyage à l’aide de pierres. Bien que l’existence du cannibalisme pendant la préhistoire soit dure à avaler comme le prétend Bahn (1996), les travaux de Patou-Mathis (2002 ; 2006) apportent des preuves tangibles sur la pratique du cannibalisme par les Néandertaliens. Comment peut-on alors nier l’existence du cannibalisme sous le prétexte d’une pure imagination ou la justification de méthodes violentes et disproportionnées des colons à l’égard des populations amérindiennes comme l’évoque Arens en 1979 ? Pourtant, hormis dans les cas de disette alimentaire, sa pratique s’intègre dans une institution sociale aux règles strictes et aux rites complexes et variés selon les sociétés. Il correspond à l’actualisation des mythes et des croyances et s’insère dans des schémas symboliques concernant la nature et la mort, les représentations du monde des ancêtres, la conception de la personne. Cette complexité est peut-être due à l’ambivalence du cannibalisme, c'est-à-dire le privilège accordé à la conservation du corps par ingestion par rapport à sa simple destruction par putréfaction (Patou-Mathis, 2006). Les travaux de Patou-Mathis (2006) montrent que l’aire d’extension du cannibalisme, tant spatiale que temporelle, reste vaste. Nullement unique, le cannibalisme prend de multiples formes avec la variabilité des rites observés. Le mythe le plus fréquent est lié à la création de l’homme et à sa perpétuation : la régénérescence du groupe chez les Aztèques se fait au cours des repas anthropophagiques impliquant la participation de chaque individu (Patou-Mathis, 2006). Des populations préhistoriques ont donc été cannibales selon Patou-Mathis (2002). Les ossements humains les plus anciens datés de 800 000 ans découverts sur les sites de la Grande Doline (Espagne) portaient des marques de décapitation, de stries de boucherie et des fractures résultant d’une action humaine. La consommation de la chair humaine confirmée par l’étude des fossiles était indépendante du sexe et de l’âge des proies. Par ailleurs, loin d’être géographiquement localisé, le cannibalisme a été attesté chez les peuples chasseurs-cueilleurs de la plupart des continents allant des Amériques (Algonquins, Hurons, Cree, Iroquois Guayaki, Tupi-mambas, Tupi-guarani, Aztèques) à l’Océanie (Foré) en passant par l’Afrique (Azandés) et l’Europe (Youkanghirs, Toungouses, Samoyèdes).
7De façon générale, deux grands types de cannibalisme se distinguent :
8– le cannibalisme alimentaire ou de subsistance. C’est essentiellement l’expression d’un besoin alimentaire (Patou-Mathis, 2006). Ce type de cannibalisme humain est ponctuel et pourrait disparaitre une fois les conditions normales rétablies ;
9– le cannibalisme rituel est organisé et correspond à l’actualisation des mythes. La nature et les parties du cadavre à consommer, de même que les participants au rituel sont spécifiés avec leur attribution. Par exemple, chez les tribus indiennes d’Amérique citées plus haut, les os étaient broyés et mélangés à des breuvages rituels ; tandis que chez les tribus mélanésiennes, le cerveau, siège de la force physique, morale et sexuelle, était prisé de tous (Patou-Mathis, 2006).
10Le cannibalisme rituel est lui-même subdivisé en deux groupes incompatibles : l'endo-cannibalisme et l'exo-cannibalisme. L’endo-cannibalisme est une pratique funéraire au sein du groupe destinée à s’approprier l’âme d’un membre défunt du clan. Ce type de cannibalisme ne présuppose pas la mise à mort préalable, même si parfois la mort naturelle n’était pas attendue. Il ne concerne que des sujets apparentés soit par la filiation, l’alliance ou le pacte de sang. L’infanticide pratiqué dans certaines tribus de l’Australie devrait assurer la renaissance des enfants avec une force et des valeurs ajoutées. Par contre, l'exo-cannibalisme est associé à des pratiques guerrières et suppose la mise à mort préalable, il est pratiqué sur des ennemis. Il vise à humilier la dépouille mortelle de l’ennemi mais aussi à assimiler les vertus de l’étranger que le groupe ne possède pas. La transmission de la force vitale du mort se fait du mort au vivant par la consommation de la chair (Patou-Mathis, 2006). Chez les Uroquois, l’ennemi, pour être comestible, doit être torturé et traité en gibier.
11Dans les sociétés occidentales, le cannibalisme semble n'avoir jamais existé en tant que rite institutionnalisé, bien que dans la Rome antique et impériale, les spectateurs se précipitaient dans l'arène pour boire le sang des gladiateurs morts. Ce sang était censé guérir les épileptiques et porter bonheur si l’on y trempait les cheveux (Pottier, 2007). On relève tout de même des cas isolés de consommation de la chair humaine dans des circonstances particulières. Ainsi, en ex Union soviétique, la population durement touchée par la grande famine des années 1932-1933 se serait parfois nourrie de cadavres, de même que les membres d'une équipe de football uruguayenne, rescapés d'un accident d'avion en 1972, choisirent la même solution pour survivre pendant septante jours (Rémy, 2003). Le crime cannibale est aussi pratiqué en Allemagne où subsistent des réseaux internet sur lesquels le sadomasochisme est poussé jusqu’à ses limites les plus morbides. Certaines victimes n'offrent de sacrifier qu'une partie de leur corps, un pied, une main ou une oreille, que l'acquéreur pourra accommoder sur les conseils des recettes du site "Gourmet girls" : " seins farcis " ou encore " brochette de pied " (AFP, 2002).
12Il n’est pas rare d’observer encore des actes de cannibalisme dans notre société d’aujourd’hui. Il se présente sous forme de cannibalisme guerrier, de vengeance ou de haine et de découverte. La population pygmée de la forêt de l'Ituri (République Démocratique du Congo) a payé un lourd tribut au cannibalisme des soldats rebelles qui mangeaient, exhibaient des têtes de pygmées autour du cou avec des sexes humains utilisés comme amulettes (Pottier, 2007). La consommation de la chair et du sang des pygmées les rendrait forts et invincibles (Rémy, 2003 ; Pottier, 2007). Ces atrocités ont été recensées dans deux rapports des Nations Unies adressés au Président du Conseil de sécurité par le Secrétaire général des Nations Unies, le 25 juin 2003. Autant d’éléments qui nous plongent dans la réalité actuelle de l’anthropophagie.
2.2. Le cannibalisme chez les rongeurs
13Le cannibalisme se présente couramment sous deux formes chez les rongeurs : le cannibalisme filial ou parental et le cannibalisme non-parental.
14Le cannibalisme parental. Le cannibalisme est dit parental lorsque l'adulte tue et dévore une partie de sa descendance. C'est généralement la femelle qui en est responsable (Elwood, 1992). Le cannibalisme parental peut être anormal ou adaptatif (Elwood, 1992).
15Le cannibalisme parental est anormal quand il est dû à une perturbation de la femelle lors de la parturition ou lorsque ses petits ont subi une influence de l’extérieur suite à une manipulation ou encore lorsqu'elle est maintenue au laboratoire en présence d'autres rongeurs (Elwood, 1992). L'exemple type est celui de la femelle de Mesocricetus auratus (communément appelé Hamster doré ou Hamster de Syrie) qui consomme ses petits lorsqu'elle est en présence d'autres rongeurs. Ce comportement s’explique par le fait que dans la nature, ce rongeur vit à l'état solitaire et ne supporte pas les fortes densités d’individus. Il ne tolère pas la présence de congénères sur son territoire, sauf pendant la période de reproduction. Pour cela, il maintient au minimum une centaine de mètres entre chaque terrier et se montre très agressif vis-à-vis de ses congénères et conspécifiques en cas d’intrusion (Elwood, 1992). Par ailleurs, les souris souffrant d’un dysfonctionnement du récepteur nucléaire de la vitamine D présentent des troubles anormaux caractérisés par une réduction des soins parentaux et un développement du cannibalisme maternel (Kalueff et al., 2006). De même, les souris atteintes de surdité consomment après la mise-bas le placenta, le cordon ombilical et les petits dont les cris ne peuvent être entendus. La perception des cris est susceptible d’induire chez la femelle un comportement affectif (Noirot, 1972).
16Le cannibalisme parental est adaptatif lorsque la femelle adapte l'effectif de sa descendance aux ressources énergétiques disponibles. Incapable d’allaiter tous ses petits, elle va réduire leur nombre par cannibalisme. La femelle sélectionne les victimes selon leur taille. En général, ce sont les individus maigres, à faible valeur sélective (incapables d'assurer la survie de la population) qui sont consommés. Le cannibalisme adaptatif est fréquent chez la souris Mus musculus de la famille des Muridae (Elwood, 1992). Elle consomme sa descendance en fonction de la disponibilité des ressources pendant les 10 premiers jours qui suivent la mise-bas (Elgar et al., 1992). L’espèce Peromyscus maniculatus ne tue ses petits que pendant les périodes d’extrême disette.
17Le cannibalisme non-parental. Contrairement au cannibalisme parental, le cannibalisme non-parental survient lorsqu’une femelle tue et consomme les petits des autres femelles. L'objectif recherché peut être soit de se procurer un territoire plus grand, comme chez Spermophilus beldingi (Sherman, 1981) ou soit de satisfaire les besoins énergétiques nécessaires à la gestation ou à la lactation. Le cannibalisme non-parental a également été observé chez les mâles de Peromyscus leucopus qui s'attaquent aux petits afin de raccourcir la période de l'allaitement. Ainsi, les femelles seront plus rapidement disponibles pour l'accouplement (Elwood, 1992 ; Ebensperger, 1998).
2.3. Le cannibalisme chez les mollusques
18Le cannibalisme a fait l’objet d’étude chez les gastropodes prédateurs (Murex trunculus, Triplofusus giganteus) vivant aussi bien dans les milieux naturels que dans les laboratoires (Basedow, 1996 ; Dietl, 2003). Chez les mollusques, les cannibales adultes consomment des œufs, des larves et des adultes, tandis que les larves ne consomment que des œufs (Baur, 1992). Le cannibalisme est essentiellement dû au manque de ressources alimentaires et à des contraintes environnementales. Taylor (1970) écrivait que le cannibalisme chez les Naticidae prédateurs résulterait d’une absence de proies alternatives. Dielt (2003) avançait la même raison pour expliquer la pratique du cannibalisme chez les Fasciolariidae. L'espèce aquatique Natica unifasciata ne s’adonne au cannibalisme que pendant les périodes de marée basse (Hughes, 1985). Généralement, c’est la présence et la forme de la coquille du prédateur qui va conditionner la taille de la proie à capturer (Baur, 1992). Ainsi, les espèces cannibales présentant une coquille fortement développée sont incapables d'avaler de grosses proies. Par exemple, les adultes de l’espèce terrestre Oxychilus draparnaudi consomment uniquement des individus dont le diamètre de la coquille reste inférieur à 4,5 mm. Par contre, les espèces sans coquille sont capables d'ingérer de grosses proies, c'est le cas pour l'espèce Navanax inermis (Baur, 1992). Le cannibalisme des œufs par les adultes a été observé chez quelques rares espèces de la famille des Buccinidae et chez plusieurs espèces terrestres de la famille des Zonitidae comme Oxychilus cellarius. Chez certains mollusques terrestres comme Arianta arbustorum et Helix pomatia, le cannibalisme adaptatif s’observe sur les sites de ponte (Baur, 1992). Ces mollusques pondent en effet des groupes de 20 à 80 œufs sphériques de 3 mm de diamètre dans le sol. Ces pontes groupées ont lieu une à trois fois par an (Baur, 1992). L’émergence des larves se fait de manière étalée dans le temps. Ainsi, les premières larves se nourrissent des œufs. Ces œufs peuvent provenir de la même ponte ou des pontes voisines. Le taux du cannibalisme des œufs diminue avec l'âge des larves car seules les jeunes larves se nourrissent des œufs, les larves âgées sont phytophages. En effet, les jeunes larves sont dépourvues d’enzymes telles que la cellulase et la chitinase nécessaires à la digestion des feuilles. Elles vont exclusivement se nourrir aux œufs durant les quatre premières semaines. Dès qu’elles disposent d’enzymes digestives spécifiques aux plantes (généralement après quatre semaines), elles vont préférentiellement se nourrir aux feuilles. Le cannibalisme est donc spécifique à l’âge des larves. Les études comparatives de Baur (1990) au laboratoire montrent que les larves d’A. arbustorum nourries aux œufs affichent une augmentation de poids de 2,6 fois supérieure à celui des larves nourries avec des laitues 10 jours après leur émergence. L’augmentation du poids corporel est positivement corrélée à la quantité d'œufs consommés (Baur, 1990). Toutefois, la consommation des œufs n'influence pas la survie des larves pendant les premiers jours du développement. Néanmoins, elle accélère la croissance et améliore la survie des adultes en raison de leur richesse en mucopolysaccharides, polysaccharides, glycosaminoglycannes, glycoprotéines et calcium (Crowell, 1973). Ils représentent à cet effet un apport nutritif hautement significatif.
2.4. Le cannibalisme chez les amphibiens
19Chez les amphibiens, l’œuf constitue le stade de développement le plus vulnérable au cannibalisme des adultes et des larves en raison de son immobilité et de sa grande richesse en calcium et en phosphore (Crump, 1992). Selon Crump (1992), le cannibalisme s’observe chez 12 familles de crapauds, 7 familles de salamandres et 1 famille de gymnophiones (Lissamphibiens). Dans la nature, les genres les plus cannibales sont Scaphiopus sp., Chacophrys sp., Ceratophrys sp., Lepidobatrachus sp. et Pysxicephalus sp. L’oophagie se présente sous deux formes distinctes. Une forme, dite opportuniste, est pratiquée par les têtards lorsque la nourriture est insuffisante (Crump, 1983). La seconde forme, dite évolutive, se traduit par la consommation des œufs non fertiles (dits trophiques) fournis par les femelles aux têtards (Lannoo et al., 1987). Les œufs trophiques, moins couteux à produire par les femelles, sont généralement destinés à la nourriture des têtards. La taille, la structure et le processus de développement de ces œufs sont distincts des œufs viables. L'oophagie peut être observée soit sur les sites de ponte, soit directement dans l’utérus des femelles gravides comme chez l'espèce Salamandra salamandra (Warburg et al., 1979).
20Le cannibalisme larvaire est aussi répandu chez les amphibiens, notamment chez les urodèles et les anoures dont les espèces des familles Ambystomatidae (Ambystoma annulatum), Cryptobranchidae (Andrias japonicus), Dicamptodontidae (Dicamptodon ensatus), Hynobiidae (Hynobius nebulosus) Myobatrachidae (Lechriodus fletcheri) et Pelobatidae (Scaphiopus bombifrons) sont représentatives du comportement.
21Les causes du cannibalisme chez les amphibiens sont variables. Le cannibalisme peut être induit par : – une fécondité trop abondante, avec pour corollaire une descendance de petite taille, plus vulnérable à la prédation ;
22– une compétition entre les individus induite par une forte densité de population. Les larves de Ambystoma tigrinum s’entre-dévorent une fois que la fréquence de rencontre est élevée (Collins et al., 1983) ;
23– l’assèchement des sites de ponte associé à un accroissement de la densité et une diminution de ressources ;
24– le polyphénisme, c’est-à-dire des différences phénotypiques discrètes de la morphologie entre les individus de la population. Cette différence morphologique se traduit par une variation du taux de croissance et de comportement entre les individus, certains croissent plus vite et développent une morphologie adaptée au cannibalisme, d'autres se développent normalement (Crump, 1992 ; Wakano, 2003). Les espèces Ambystoma tigrinum (Rose et al., 1976), Hynobius retardatus (Wakahara, 1995), Scaphiopus couchii (Pfennig, 1990 ; Dayton et al., 2002) sont caractérisées par des individus cannibales à grosse tête et à large bouche par rapport à la taille du corps. Certains individus pourraient avoir une morphologie intermédiaire entre celle d'un individu cannibale et celle d'un individu non-cannibale (Wakano, 2003). Cette hétérogénéité de la croissance chez les batraciens trouve son explication pour certains à travers des facteurs génétiques se traduisant par des différences dans la fréquence d’allozyme chez les individus cannibales et non-cannibales (Pierce et al., 1983 ; Wakano, 2003), et pour d'autres à travers des facteurs environnementaux (Collins et al., 1983). Toutefois, selon Nishihara (1996), Hoffman et al. (1999), Nishihara-Takahashi (1999) et Kohmatsu et al. (2001), la morphologie cannibale résulterait d’une plasticité phénotypique liée aux conditions environnementales.
2.5. Le cannibalisme chez les arthropodes
25Le cannibalisme est largement répandu dans la classe des insectes et a fait l’objet de nombreuses études chez les Diptères, les Coléoptères, les Hyménoptères, les Mantodea et bien d’autres ordres, et non des moindres.
26Chez les Diptères, le cannibalisme se présente sous deux formes : le cannibalisme prénatal et le cannibalisme postnatal.
27Le cannibalisme prénatal se rencontre chez les larves d’insectes ovovivipares qui s’entre-dévorent dans l’utérus de leur génitrice. Par exemple, l’espèce Emblemasoma auditrix est un parasitoïde ovovivipare qui donne simultanément naissance à 38 larves utérines. Ces larves sont ensuite déposées individuellement dans un hôte (Okanagana rimosa, Homoptère) dans lequel elles se développeront. Comme la recherche des hôtes par la femelle peut prendre plusieurs semaines, les larves restent dans l’utérus de cette dernière avant leur dépôt dans un hôte approprié. Bien que leur développement soit ralenti, le poids des larves augmente dans l’utérus pendant que leur nombre diminue. La croissance des larves utérines est étroitement corrélée à la diminution de leur nombre (DeVries et al., 2007).
28Le cannibalisme postnatal s’observe lorsque les conditions environnementales sont défavorables. Les larves de Chrysomyia albiceps et de Anopheles beklemishevi se dévorent entre elles dès qu’une compétition s’instaure pour les ressources disponibles (Omar, 1995) ou lorsque la densité de population est élevée (Polis, 1981 ; Gordeev et al., 1995).
29Chez les Mantodea, le cannibalisme est dit sexuel, il est essentiellement caractérisé par la consommation des mâles par les femelles pendant ou après les parades nuptiales et l’accouplement (Elgar et al., 1992 ; Maxwell, 1998). Ce type de cannibalisme procure suffisamment de nutriments à la femelle pour pondre. Si les avantages du cannibalisme sexuel sont supérieurs aux couts, alors la convergence évolutive des mâles se fera en faveur de ce type de cannibalisme (Gould, 1984). Forster (1992) et Andrade (1996) qualifient ce comportement de suicidaire et précisent qu’il est répandu chez Latrodectus hasselti (Araneae : Theridiidae).
30Chez les Hyménoptères, le cannibalisme semble être adaptatif. La consommation des œufs trophiques est largement répandu dans les colonies de certaines espèces de fourmis, dont notamment Dolichoderus quadripunctatus et Plagiolepis pygmea. L’importance de ces œufs dans le bilan trophique de la colonie de la fourni Dolichoderus quadripunctatus a été étudié par Torossian en 1979. En effet, les ouvrières de Dolichoderus quadripunctatus sont normalement fertiles et pondent, lorsqu’elles sont éloignées de leur reine, deux catégories d’œufs :
31– des œufs reproducteurs qui évoluent en mâles par parthénogénèse arrhénotope. Ces œufs présentent un chorion rigide avec une forme elliptique et une structure constante,
32– des œufs trophiques qui sont des ovocytes normaux ayant subi une dégénérescence précoce dans les gaines ovariennes. Dépourvus de membrane vitelline, ces œufs abortifs sont émis au profit du couvain et des membres de la colonie, pendant la période de ponte et d’élevage des larves. Toutefois, en présence de la reine fertile, la production d’œufs reproducteurs par les ouvrières est totalement inhibée mais les œufs abortifs sont pondus exclusivement (Torossian, 1968 ; 1979) pour être consommés. Environ 50 % des œufs pondus sont consommés par les ouvrières et les larves. La fréquence d’émission de l’œuf abortif trophique de Dolichoderus quadripunctatus est 100 à 150 fois supérieure à celle de Plagiolepis pygmea.
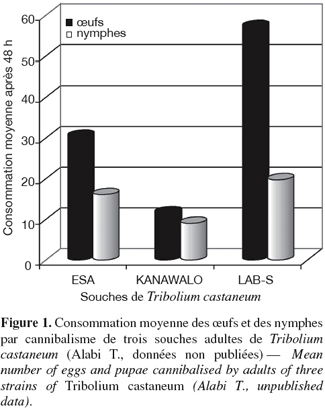
33Chez les Coléoptères, le cannibalisme touche les stades mobiles (adultes et larves) considérés comme les cannibales et les stades immobiles (œufs et nymphes) considérés comme les proies. Les adultes ont des élytres sclérifiés qui les rendent peu vulnérables au cannibalisme (Stevens, 1989). Il est toutefois possible de voir des larves qui consomment d’autres larves, de même que des adultes qui consomment occasionnellement des larves, voire des adultes, bien qu’ils soient tous à des stades mobiles. Toutes les espèces du genre Tribolium spp. semblent être omnivores dans leur milieu de vie (Sokoloff, 1974). Au laboratoire, même en présence de nourriture riche, fraiche et abondante, les stades mobiles (adultes et larves) consomment les stades immobiles (œufs et nymphes). La fréquence du cannibalisme chez Tribolium spp. est perçue par certains auteurs comme étant un inconvénient majeur pour l’étude de ce genre (Sokoloff, 1974). Du point de vue écologique, c’est bien entendu important puisque c’est une cause majeure de mortalité. Cette importance est également soulignée par les variations observées dans les fréquences de cannibalisme en fonction des souches (Figure 1). Certaines souches sont tellement cannibales que leur pérennité au laboratoire pourrait être menacée sans l’intervention de l’homme pour retirer les adultes et permettre ainsi aux œufs d’éclore ou aux nymphes de se métamorphoser en adultes. Par contre, d’autres espèces sont peu cannibales mais fortement prédatrices (Alabi et al., 2008). Du point de vue génétique, les opinions divergent : selon Sokoloff (1974), le cannibalisme est indépendant du génotype. Par contre, Stevens (1989) et Giray et al. (2001) estiment que le cannibalisme a une base génétique qui se traduit d’ailleurs par sa stabilité. Chez les coccinelles, les œufs sont aussi en proie au cannibalisme. En effet, les coccinelles femelles pondent des œufs groupés sur des feuilles non infestées par des pucerons. Les larves émergent de manière étalée dans le temps en fonction de la taille de la ponte et de la température (Banks, 1956). Elles y restent fixées pendant un certain temps avant de se disperser. La survie des larves néonatales est assurée par le cannibalisme des œufs dans les premiers moments de leur émergence (Osawa, 1992). Ce cannibalisme est aussi adaptatif car il permet aux femelles et aux mâles de coccinelles d’accroître respectivement leur fécondité et leur succès reproducteur en leur procurant une grande vigueur biologique (Osawa, 1989 ; 2002). Michaud (2003) a suffisamment décrit des cas de cannibalisme des œufs et des larves de Coccinella sanguinea par des larves et des adultes au champ.
34Enfin, chez les Paederus sp. (Coleoptera : Staphylinidae), la pédérine (amide vésicant et toxique présent dans l’hémolymphe) assure la protection contre la prédation des araignées-loups (Araneae : Lycosidae). La pédérine est produite par les endosymbiontes présents chez les femelles de Paederus. Toutefois, les larves qui émergent des œufs pondus par les femelles aposymbiotiques sont dépourvus de pédérine. Elles acquièrent la pédérine et les endosymbiontes (nécessaires à la production de la pédérine au stade adulte) par le cannibalisme des œufs pondus par les femelles endosymbiotiques.
3. Facteurs responsables du cannibalisme et de son évolution
35Les pressions de sélection favorisant le cannibalisme peuvent être écologiques ou sociales (Elgar et al., 1992). Il semble d’ailleurs exister des liens écologiques entre la nature de la pression de sélection et le stade de développement de l’animal cannibale et de la proie (Elgar et al., 1992). Par exemple, le cannibalisme résultant d’une compétition directe entre des individus pour une ressource limitée peut s’observer soit entre des stades de développement ou pour tous les stades de développement, par opposition au cannibalisme parental intervenant pour réguler la taille de la progéniture (Alexandre, 1974 ; Manica, 2002 ; 2003). Il impliquera seulement le parent cannibale et une proportion de la descendance.
3.1. Facteurs écologiques favorisant le cannibalisme
36Le facteur écologique le plus important qui favorise le cannibalisme est la faible disponibilité de la nourriture, qui est liée à la densité de la population (Elgar et al., 1992 ; Via, 1998). De nombreuses études indiquent que le taux de cannibalisme augmente avec la densité (Fox, 1975 ; Polis, 1981). Les causes écologiques du cannibalisme sont diverses. Un individu consomme un autre individu de la même espèce :
37– pour satisfaire ses exigences énergétiques et nutritionnelles (Fox, 1975 ; Polis, 1981 ; Whoriskey et al., 1985 ; Fitzgerald et al., 1989 ; Stevens, 1989 ; Hiraiwa-Hasegawa, 1992 ; Michaud, 2003),
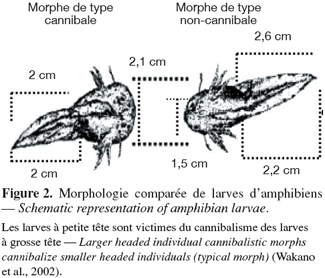
38– pour éliminer les éventuels compétiteurs (Blum et al., 2002),
39– pour récupérer l’investissement de la reproduction si les conditions sont si défavorables que probablement la progéniture ne survivra pas (Elgar et al., 1992 ; Wourms, 1977). Une telle stratégie a l’avantage de compenser les pertes énergétiques liées à la reproduction et aussi de fournir des ressources suffisantes pour la production d’ovocytes,
40– pour la survie des parents jusqu’à l’amélioration des conditions de vie (Osawa, 1989 ; 2002 ; Elgar et al., 1992),
41– pour limiter ou compenser les pertes de temps et d’énergie lors de la recherche de nourriture alternative. En effet, Dong et al. (1992) précisent que le cannibalisme représente un cas spécial de la théorie de l’approvisionnement optimal ou optimal foraging, qui se définit comme étant le rendement qu’un animal obtient par unité de temps passée à chercher sa nourriture. Les animaux qui sont à la recherche de nourriture sont souvent contraints par le temps de manipulation nécessaire pour reconnaitre, capturer et consommer la proie. Un animal à la recherche d’une proie trouvera à une vitesse qui dépend de la disponibilité ou de la densité des proies dans l’environnement, mais aussi de ses propres aptitudes physiques (Mcfarland, 2001). Les individus cannibales sélectionnent leurs proies de manière à maximiser leur taux net d’acquisition d’énergie (MacArthur et al., 1966 ; Stephens et al., 1982). Ainsi, les proies consommées par cannibalisme devraient entrainer une augmentation du taux net d’acquisition d’énergie. Le cannibalisme représente essentiellement une source de nourriture complémentaire dans la ration alimentaire d’un animal (Elgar et al., 1992).
3.2. Facteurs sociaux favorisant le cannibalisme
42L’aptitude darwinienne d’un animal est liée à sa capacité à estimer les ressources et les contraintes d’un environnement complexe et à adapter en conséquence sa réponse comportementale. Chez les espèces grégaires ou sociales, la coordination efficace de l’activité du groupe dépend en outre des règles de décision qui gouvernent les interactions et la communication entre congénères (Maynard Smith, 1978). Les sociétés d’insectes sont capables d’ajuster leurs réponses collectives à un milieu en perpétuel changement. Par exemple, dans une colonie de fourmis Pachycondyla goeldii (Hymenoptera : Formicidae) ayant perdu la reine (individu reproducteur et « dominant »), les ouvrières se livrent à des combats de dominance en vue d’établir une hiérarchie susceptible de structurer leur reproduction. Cette perte remet en cause la hiérarchie, et la valeur sélective de chacun. Les ouvrières sont potentiellement toutes équivalentes et apparentées les unes aux autres. Elles pondent des œufs, parfois avant toute régulation par des relations de dominance. De même, les développements ovariens d’un ou de quelques individus qui mettent en place leur dominance, généralement parmi les plus jeunes, deviennent supérieurs à ceux des autres membres de la colonie. Dans ces conditions, on observe un développement du cannibalisme des œufs dont la fonction évolutive est la régulation de la population du couvain et l’optimisation de la productivité du groupe (Dietemann et al., 2000 ; Heinze et al., 2002).
43Une compétition entre des individus vivant en société peut aussi conduire au cannibalisme à travers une élimination des rivaux (Elgar et al., 1992). Ce type de cannibalisme peut être la conséquence de la supériorité de certains individus mâles sur d’autres pour l’accouplement avec une femelle ou bien pour accéder aux ressources alimentaires. Le conflit entre les mâles pour l’accouplement peut aboutir au cannibalisme si les femelles s’accouplent avec plusieurs partenaires (polyandrie) ou bien si elles peuvent se soumettre immédiatement à l’accouplement après la perte de leur progéniture. Par exemple, chez certains mammifères (les félidés et les rongeurs), la femelle entre plus rapidement en œstrus si sa progéniture est tuée à bas âge que si elle l'avait sevrée (Hausfater et al., 1984 ; Elwood, 1985 ; Hiraiwa-Hasegawa, 1992). Un mâle qui dévore la progéniture d’une femelle pourrait accroître ses chances de s’accoupler avec cette dernière au détriment d’un autre mâle (Elgar et al., 1992).
4. Couts du cannibalisme
4.1. Le risque associé à la prédation
44Le cannibalisme a des couts et le plus évident est qu’un animal qui essaye de tuer et manger un individu de la même espèce, de taille et de capacité prédatrice similaire, court un grand risque, celui d’être la proie de sa potentielle victime (Elgar et al., 1992). Ce cout est le risque associé à la prédation et il est étroitement rattaché à la théorie de foraging. Ce n’est donc pas surprenant que le cannibalisme implique une asymétrie de taille entre la proie, plus vulnérable à être attaquée, et l’individu cannibale.
4.2. Le risque d’infection par les parasites et le développement de maladies dégénératives
45Le risque d’infection par des parasites, des virus et autres maladies peut aussi représenter un cout potentiellement important du cannibalisme (Tableau 2). La possibilité d’une infection par les parasites (particulièrement les hôtes spécifiques) qui peuplent le système digestif serait donc accentuée par le cannibalisme. Williams et al. (2006) ont étudié les couts du cannibalisme chez les larves de Spodoptera frugiperda (Lepidoptera : Noctuidae) en présence d’individus infectés par un virus (IIV) iridescent et mortel. Ils ont montré une corrélation positive entre la densité d'insectes et la probabilité de la transmission de la maladie par le cannibalisme. La transmission de la maladie est négligeable lorsque les larves sont contaminées par les fèces d’insectes infectés. Par contre, 92 % des larves ayant ingéré des insectes infectés sont mortes avant l’âge adulte. Les larves malades sont plus exposées au cannibalisme comparativement aux larves saines. Les couts du cannibalisme sont énormes en présence de larves malades. La survie est réduite de 50 % au laboratoire et de 30 % aux champs. La transmission de virus par cannibalisme a également fait l’objet d’étude chez les larves de Plodia interpunctella (Boots, 1998).
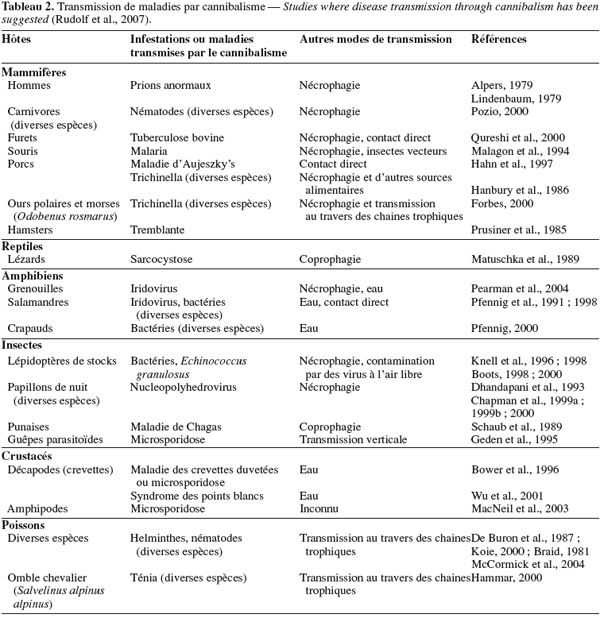
46Chez les humains, les populations cannibales ont souffert du Kuru (maladie infectieuse due à la présence de prions " anormaux "). Le prion est une protéine que l’on trouve à la surface des cellules. Le prion anormal est une protéine infectieuse capable de se répliquer en l’absence de toute information génétique et qui se retrouve dans les plaques amyloïdes, substances pathologiques infiltrant les tissus nerveux ayant l’aspect de l’amidon (d’où son nom). Il s’attache à d’autres protéines cellulaires du cerveau et les déforme. Ces dernières attaquent le cerveau en tuant les cellules et en créant des cavités dans les tissus ou des plaques spongieuses. Cette maladie n'a été décrite qu'en Nouvelle-Guinée, chez la tribu Fore caractérisée par sa pratique de rites cannibales. Dix pour-cent de la population étaient touchés par la maladie chaque année. Vingt-cinq pour-cent de la population atteinte étaient des enfants et environ deux tiers des malades adultes étaient des femmes. Les femmes et les enfants mangent les abats dont le cerveau, cuit à la vapeur, tandis que les hommes et les adolescents mangent les muscles, symbole de force (Gajduzek et al., 1959 ; 1975 ; Gilgenkrantz, 2004).
4.3. La diminution de la vigueur biologique
47Probablement, le cout le plus intriguant est la diminution de la vigueur biologique pour un cannibale qui tue et consomme un individu génétiquement semblable. Cette perte potentielle de la vigueur biologique dépendra du niveau de la parenté entre le cannibale et la proie (Elgar et al., 1992). L’importance du lien génétique entre le cannibale et la proie a conduit à faire la distinction entre l’hétérocannibalisme, le cannibalisme sibling ou entre individus apparentés et le cannibalisme filial. L’hétérocannibalisme est le cannibalisme qui à lieu entre individus génétiquement différents. Le cannibalisme est dit sibling quand il est observé chez des individus issus de mêmes parents. Enfin, le cannibalisme filial désigne le cannibalisme qui a lieu entre les parents et leur progéniture. Bien qu’il soit commode de distinguer le cannibalisme parental du non-parental, la dichotomie peut induire en erreur pour deux raisons (Polis, 1981) :
48– la liaison génétique est une variable continue, par conséquent le niveau selon lequel deux individus de faible liaison génétique peuvent être considérés comme apparentés est plus ou moins arbitraire (Elgar et al., 1992),
49– la relation génétique entre des individus apparentés peut être moins ou tout à fait ambigüe sous certains systèmes d’accouplement comme la polygamie.
50Ainsi, les couts en termes de diminution de la vigueur biologique, de consommation d’un membre de la nichée diffèrent selon l’individu cannibale et la proie (Elgar et al., 1992).
51La perte potentielle de la vigueur biologique comme conséquence du cannibalisme entre individus génétiquement liés laisse supposer que le cannibalisme n’est préférentiellement pas pratiqué à l’intérieur de groupes d’individus génétiquement semblables, dans des situations où il représente un mécanisme d’acquisition de la nourriture (Elgar et al., 1992). Cette évidence mérite d’être nuancée. Toutefois, des individus de plusieurs groupes taxonomiques évitent de tuer et consommer un membre apparenté. Ce comportement s’observe chez des poissons (Fitzgerald et al., 1985), des rongeurs (Elwood, 1985) et des larves d’ascidie (Young, 1988), par opposition aux gastéropodes qui ne font aucune différence de lien génétique avec la proie (Baur, 1992). Le mécanisme selon lequel des individus apparentés sont épargnés du cannibalisme chez les insectes sociaux et certains Coléoptères reste inconnu et requiert certainement des investigations complémentaires (Elgar et al., 1992).
4.4. Absence de partenaire pour les femelles cannibales
52Lorsque le cannibalisme a lieu au moment des parades nuptiales ou de l’accouplement, les mâles pourraient éviter les femelles cannibales et celles-ci risquent de rester vierges (Elgar, 1990). Les hypothèses évolutives qui en découlent sont de deux ordres :
53– si les femelles ont très peu de chance de rencontrer un mâle courtisant, elles finiront par devenir moins cannibales,
54– les femelles qui resteront vierges à la fin de la saison des amours seront moins cannibales que les femelles vierges au tout début de la saison d’accouplement (Elgar et al., 1992).
5. Quelques stratégies de lutte contre le cannibalisme
55Le cannibalisme et la prédation exercent de fortes pressions de sélection sur les populations de proies. Certaines espèces de proies ont alors développé des mécanismes de défense pour échapper au cannibalisme ou à la prédation (Raven et al., 2007). Les caractères susceptibles de réduire leur vulnérabilité sont privilégiés et leur évolution aboutit à une sélection naturelle par adaptation souvent opposée à celle des individus cannibales ou des prédateurs. Il en résulte une coévolution des caractères, les proies acquièrent constamment de meilleures défenses, tandis que les individus cannibales développent des meilleurs moyens pour contourner ces défenses. Par exemple, les grenouilles à dard empoisonné de la famille des Dendrobatidae produisent des alcaloïdes toxiques dans le mucus qui recouvre leur peau de coloration vive. Ces alcaloïdes sont mortels pour les animaux qui tentent de les manger. Grâce à leur instinct ou à leur apprentissage, les prédateurs évitent ces espèces vivement colorées qui sont pourtant des proies potentielles (Raven et al., 2007). Aussi, le cannibalisme qui se développe au sein de cette espèce ne touche que les œufs, les adultes colorés sont épargnés. De même, les œufs et les larves d’amphibiens sont souvent protégés par une épaisse cuticule dont l’hydrolyse partielle du collagène produit une gélatine amère et toxique par simple contact. Cette substance gélatineuse est de nature à repousser les individus cannibales et dissuader les éventuels prédateurs. Certaines espèces comme Notophthalmus viridescens (Wood et al., 1954), Lepidobatrachus llanensis (Crump, 1991) vont rechercher des sites de ponte susceptibles d’offrir une plus grande protection à leur progéniture. Les Tetragnatha elongata mâles (Araneae : Tetragnathidae) vont chercher à s’accoupler avec les femelles tout juste après leur mue pour éviter qu’ils ne soient dévorés, car au moment de la mue, les femelles évitent les attaques. D’autres mâles par contre attendront que la femelle ait mangé avant de la séduire (Robinson et al., 1980). Enfin, chez les fourmis Hypoponera opacior, les ouvrières procèdent à la séparation des larves les unes des autres pour réduire le cannibalisme entre les larves (Rüger, 2008).
6. Le cannibalisme est-il une stratégie évolutive stable ?
56Du point de vue évolutif, une stratégie évolutive stable (SES) est une stratégie qui ne peut être améliorée par aucune stratégie alternative réalisable, pour autant qu’elle soit adoptée par les individus de la population. Ainsi, la meilleure stratégie pour un individu dépend-elle des stratégies adoptées par les autres individus de la population. Une véritable SES ne peut pas être envahie avec succès par un gène mutant (McFarland, 2001). Le cannibalisme serait-il une stratégie évolutive stable ? Serait-il dû à une mutation d’un gène ou s’agirait-il d’un comportement adaptatif sous l’influence de la variance environnementale ? Ces questions ont été développées par Wakano et al. (2002) à travers l’étude de la stratégie optimale de la croissance des larves cannibales d’amphibiens. Mais auparavant, Stevens, en 1989, aborde déjà la question de la génétique du cannibalisme. La variabilité d’expression du cannibalisme entre des souches de Tribolium confusum lui ont permis de conclure que le cannibalisme a une base génétique et que les différences d’expression du comportement seraient dues aux effets de la variance génétique additive. De plus, les gènes responsables du cannibalisme sont héritables à plus de 75 % et portés par des autosomes. Les conditions environnementales influencent l’expression du gène par un phénotype comportemental donné.
57Selon Wakano et al. (2002), le cannibalisme est couramment observé durant la période allant de l’éclosion à la métamorphose chez les amphibiens. La morphologie des individus cannibales se traduit par une grosse tête avec une large bouche proportionnelle à la longueur du corps (Figure 2). Cette morphologie de type cannibale a été observée chez les salamandres du genre Ambystoma sp. (Rose et al., 1976) et Hynobius sp. (Wakahara, 1995) et chez les crapauds du genre Scaphiopus sp. (Pfennig, 1990). Comme un individu avec une petite tête peut être cannibale, la morphologie des individus cannibales est considérée comme une stratégie de croissance adaptative (Kusano et al., 1985 ; Ohdachi, 1994). Toutefois, si tous les individus acquièrent la morphologie cannibale, le cannibalisme ne s’observe pas (Wakano et al., 2002). Plusieurs expériences ont montré que l’ampleur du déséquilibre dans la largeur du corps des individus cannibales était grande quand la densité était élevée (Nishihara, 1996 ; Hoffman et al., 1999). Mais même quand la densité était élevée, certains individus pouvaient conserver la morphologie caractéristique de l’espèce, ce qui engendrait un polymorphisme dans la population (Pfennig et al., 1993 ; Wakahara, 1995). Généralement, la fréquence du cannibalisme augmente avec une diminution des ressources (Polis, 1981), et cela a bien été prouvé chez les larves d’amphibiens (Crump, 1992 ; Wakahara, 1995). Toutefois, l’induction de la morphologie cannibale n’est pas liée à la disponibilité de nourriture (Collins et al., 1983 ; Lannoo et al., 1984). Les couts engendrés par l’acquisition d’une morphologie de type cannibale et celui de la pratique du cannibalisme sont entièrement distincts, dans la mesure où le taux du cannibalisme est nul si tous les individus présentent la morphologie de type cannibale (Wakano et al., 2002). Toutefois, lorsque le polymorphisme existe, la probabilité de voir le comportement cannibale s’exprimer est élevée. Selon Wakano (2003), l’acquisition de la morphologie cannibale est associée à une diminution de la vitesse de déplacement : en effet, les individus à morphologie cannibale sont moins rapides à la nage et très lents à la métamorphose, ce qui est de nature à accroître leur vulnérabilité aux attaques des prédateurs. La consommation d’individus génétiquement liés a aussi un cout, même si l’habilité à la reconnaissance familiale chez les amphibiens a été développée par Pfennig et al. (1993). Une augmentation de la mortalité par les infections de pathogènes est aussi présentée comme un cout de la pratique du cannibalisme chez les larves d’amphibiens (Pfennig et al., 1991 ; 1998 ; Sadler et al., 1994 ; Kiesecker et al., 1999). Par ailleurs, certaines études ont démontré que les modèles de croissance sont sous contrôle environnemental, connu sous le nom de plasticité phénotypique (Collins et al., 1983 ; Pfennig et al., 1993), d’autres par contre ont révélé des différences dans la fréquence d’allozyme entre les individus à morphologie de type cannibale et de type non-cannibale (Pierce et al., 1983), bien que cela n’indique pas nécessairement un dimorphisme allélique au niveau des loci (Wakano, 2003). Crump (1992) affirmait déjà que les facteurs responsables de l’induction de morphes de type cannibale n’étaient pas clairs. Wakano (2003), qui poursuit actuellement les études sur la stratégie de croissance des larves, a émis deux hypothèses sur le cannibalisme et la stratégie évolutive stable : selon lui, si une SES existe, alors tous les individus qui présentent une plasticité phénotypique la choisiront, par contre si elle n’existe pas, la stratégie de croissance s’articulera essentiellement autour du polymorphisme.
7. Conclusion
58Le cannibalisme, défini comme étant une prédation intraspécifique, est largement répandu au sein du règne animal. Il a fait l’objet de plusieurs études dans la dynamique des populations animales (Elgar et al., 1992). Parmi les variables susceptibles de l’engendrer, on cite la disponibilité de la nourriture, la qualité de la nourriture, la densité de la population par rapport aux ressources disponibles, la disparité de taille au sein de la population. Le cannibalisme se développe dans divers contextes incluant l’infanticide, l’accouplement et les parades nuptiales, l’oophagie, les interactions compétitives, la conquête d’un nouvel environnement et l’actualisation des rituels chez les humains. La diversité des organismes et la variabilité de leurs histoires de vie caractérisent le monde vivant. Le challenge de la biologie évolutive est d'expliquer cette diversité et d'analyser les causes responsables des différences de valeur sélective (ou fitness) observées entre les variants (Stearns, 1992 ; Roff, 1992). Les hypothèses sous-jacentes aux analyses sont d'une part que la sélection naturelle maximise une quantité mesurable, la valeur sélective, et d'autre part que l'amplitude des variations phénotypiques observées est limitée dans une large mesure par des compromis évolutifs (ou trade-off). C'est l'ensemble des interactions entre les différents traits d'histoire de vie qui détermine l'adaptation phénotypique des individus.
Bibliographie
AFP, 2002. Ces hommes qui cherchent à se faire manger sur le web, http://tf1.lci.fr/infos/high-tech/2002/0,,972870,00-ces-hommes-qui-cherchent-faire-manger-sur-web-.html, (03/07/2009).
Alabi T., Michaud J.P., Arnaud L. & Haubruge E., 2008. A comparative study of cannibalism and predation in seven species of flour beetles. Ecol. Entomol., 33, 716-726.
Alexander R., 1974. The evolution of social behaviour. Annu. Rev. Ecol. Syst., 5, 325-383.
Alpers M., 1979. Epidemiology and ecology of Kuru. In: Prusiner S.B. & Hadlow W.J., eds. Slow transmissible diseases of the nervous system, 1. New York, USA: Academic Press.
Amstrong J., 1964. The population dynamics of the planarian, Dugesia tigrina. Ecology, 45, 361-365.
Andrade M.C., 1996. Sexual selection for male sacrifice in the Australian redback spider. Science, 271, 70-72.
Arens W., 1979. The man-eating myth. New York, USA: Oxford University Press.
Bahn P., 1996. The Cambridge illustrated history of archaeology. Cambridge, UK: Cambridge University Press.
Bailey K. & Polis G., 1987. An experimental analysis of optimal and central place foraging by the harvester ant, Pogonomyrmex californicus. Oecologia, 72, 440-448.
Bakker K., 1969. Selection for the rate of growth and its influence on competitive ability of larvae of Drosophila melanogaster. Neth. J. Zool., 19, 541-595.
Banks C., 1956. Observations on the behavior and mortality in Coccinellidae before dispersal from the egg shell. Proc. R. Entomol. Soc. London (A), 31, 56-60.
Banks C., 1968. Cannibalism and predation by aphids. Nature, 218, 491.
Basedow T., 1996. Contribution to the nutritional and population ecology of Murex trunculus (L. 1767) (Gastropoda, Muricidae), derived from findings at the north coast of Crete (Eastern Mediterranean), with remarks on two species of Naticidae (Gastropoda). Zool. Beitr., 37(2), 157-170.
Baur B., 1990. Possible benefits of egg cannibalism in the land snail Arianta arbustorum. Funct. Ecol., 4, 679-684.
Baur B., 1992. Cannibalism in gasteropods. In: Elgar M. & Crespi J., eds. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press, 102-127.
Begon M., 1996. Ecology. 3rd edition. Cambridge, MA, USA: Blackwell Science Inc.
Begon M., Townsend C.R. & Harper J.C., 2006. Ecology: from individuals to ecosystems. 4th edition. Oxford, UK: Blackwell Publishing.
Blum M.S. & Hilker M., 2002. Chemical protection of insect eggs. In: Hilker M. & Meiners T., eds. Chemoecology of insect eggs and egg deposition. Berlin: Blackwell.
Boots M., 1998. Cannibalism and the stage-dependent transmission of a viral pathogen of the Indian meal moth, Plodia interpunctella. Ecol. Entomol., 23, 118-122.
Boots M., 2000. Density-independent resource limitation and transmission of an insect pathogen. Oecologia, 124, 172-175.
Bower S.M., Meyer G.R. & Boutillier J.A., 1996. Stained prawn disease (SPD) of Pandalus platyceros in British Columbia, Canada, caused by a rickettsial infection. Dis. Aquat. Org., 24, 41-54.
Braband A., 1995. Intra-cohort cannibalism among larval stages of perch (Perca fluviatilis). Ecol. Freshwater Fish, 4, 70-76.
Braid J., 1981. Incidence of cannibalism among striped bass fry in an intensive culture system. Prog. Fish-Cult., 43, 210-212.
Chapman J.W. et al., 1999a. Age-related cannibalism and horizontal transmission of a nuclear polyhedrosis virus in larval Spodoptera frugiperda. Ecol. Entomol., 24, 268-275.
Chapman J.W. et al., 1999b. Fitness consequences of cannibalism in the fall armyworm, Spodoptera frugiperda. Behav. Ecol., 10, 298-303.
Chapman J.W. et al., 2000. Does cannibalism in Spodoptera frugiperda reduce the risk of predation? Behav. Ecol. Sociobiology, 48, 321-327.
Claessen D., de Roos A.M. & Persson L., 2003. Population dynamic theory of size dependent cannibalism. Proc. R. Soc. London (B), 271, 333-340.
Collins J. & Cheek J., 1983. Effect of food and density on development of typical and cannibalistic salamander larvae in Ambystoma tigrinum nebulosum. Am. Zool., 23, 77-84.
Cottrell C., 1984. Aphytophagy in butterflies: its relationship to myrmecophily. Zool. J. Linn. Soc., 79, 1-57.
Crowell H., 1973. Laboratory study of calcium requirements of the brown garden snail, Helix aspertsa Müller. Proc. Malacol. Soc. Lond., 40, 491-503.
Crowley P.H., Dillon D.M., Johnson D.M. & Watson C.N., 1987. Intraspecific interference among larvae in a semivoltine dragonfly population. Oecologia, 71, 447-456.
Crump M.L., 1983. Opportunistic cannibalism by amphibian larvae in temporary aquatic environments. Am. Nat., 121, 281-289.
Crump M.L., 1991. Choice of oviposition site and egg load assessment by a treefrog. Herpetologica, 47, 308-315.
Crump M.L., 1992. Cannibalism in amphibians. In: Elgar M. & Crespi B., eds. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press, 256-276.
Dayton G.H. & Wapo S.D., 2002. Cannibalistic behaviour in Scaphiopus couchii: more evidence for larval anuran oophagy. J. Herpetol., 36, 531-532.
De Buron I. & Maillard C., 1987. Experimental transfer by ichthyophagy and cannibalism of adult helminths, parasite of fishes. Ann. Parasit. Hum. Comp., 62, 188-191.
DeVries Th. & Lakes-Harlan R., 2007. Prenatal cannibalism in an insect. Naturwissenschaften, 94, 477-482.
Dhandapani N., Jayaraj S. & Rabindra R.J., 1993. Cannibalism on nuclear polyhedrosis-virus infected larvae by Heliothis armigera (Hubn) and its effect on viral infection. Insect Sci. Appl., 14, 427-430.
Dietemann V. & Peeters C., 2000. Queen influence on the shift from trophic to reproductive eggs laid by workers of the ponerine ant Pachycondyla apicalis. Insectes Sociaux, 47, 223-228.
Dietl G.P., 2003. First report of cannibalism in Triplofusus giganteus (Gastropoda: Fasciolariidae). Bull. Mar. Sci., 73, 757-761.
Dong Q. & Polis G., 1992. The dynamics of cannibalism populations: a foraging perspective. In: Elgar M. & Crespi J., eds. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press, 13-37.
Duelli P., 1981. Is larval cannibalism in lacewings (Chrysopa carnea) adaptative (Neuroptera: Chrysopidae)? Res. Popul. Ecol., 23, 193-209.
Ebensperger L., 1998. Strategies and counterstrategies to infanticide in mammals. Biol. Rev., 73, 321-346.
Elgar M., 1990. Evolutionary compromise between a few large and many small eggs: comparative evidence in teleost fish. Oikos, 59, 283-287.
Elgar M. & Crespi J., 1992. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press.
Elwood R., 1985. The inhibition of infanticide and the onset of paternal care in male mice Mus musculus. J. Comp. Psychol., 99, 457-467.
Elwood R., 1992. Pup-cannibalism in rodents: causes and consequences. In: Elgar M. & Crespi J., eds. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press, 299-322.
Encyclopaedia Universalis, 2009. Encyclopaedia Universalis. Paris : Avanquest Emme.
Fessahaye Y., Rezk M., Bovenhuis H. & Komen H., 2004. Size dependent cannibalism in juvenile Nile tilapia. In: Proceedings of the 6th International Symposium on Tilapia in Aquaculture, ICLARM Conference, Manila, Philippines, 230-238.
Fitzgerald G.J. & Whoriskey F.G., 1985. The effects of interspecific interactions upon male reproductive success in two sympatric sticklebacks, Gasterosteus aculeatus and G. wheatlandi. Behaviour, 93, 112-126.
Fitzgerald G., Guderley H. & Picard P., 1989. Hidden reproductive costs in the three-spined stickleback (Gasterosteus aculeatus). J. Exp. Bot., 48, 295-300.
Forbes L.B., 2000. The occurrence and ecology of Trichinella spp. in marine mammals. Vet. Parasitol., 93, 321-334.
Forster L., 1992. The stereotyped behaviour of sexual cannibalism in Latrodectus hasselti Thorell (Araneae: Theridiidae), the Australian redback spider. Austral. J. Zool., 40, 1-11.
Fox L., 1975. Cannibalism in natural populations. Annu. Rev. Ecol. Syst., 6, 87-106.
Freud S., 1913. Totem and taboo: resemblances between the mental lives of savages and neurotics. New York, USA: Moffat, Yard and Company.
Gajduzek D.C. & Zigas V., 1959. Kuru: clinical, pathological and epidemiological study of an acute progressive degenerative disease of the central nervous system among natives of the Eastern Highlands of New Guinea. Am. J. Med., 26, 442-469.
Gajduzek D.C. & Gibbs C.J., 1975. Familial and sporadic chronic neurological degenerative disorders transmitted from man to primates. Adv. Neurol., 10, 291-317.
Geden C.J., Long S.J., Rutz D.A. & Becnel J.J., 1995. Nosema disease of the parasitoid Muscidifurax raptor (Hymenoptera, Pteromalidae)-prevalence, patterns of transmission, management, and impact. Biol. Control, 5, 607-614.
Gilbert J., 1973. The adaptative significance of polymorphism in the rotifer Asplanchna. Hamps in males and females. Oecologia, 13, 135-146.
Gilgenkrantz S., 2004. Nos ancêtres les cannibales. Med. Sci., 20(1), 14-16.
Giray T., Luyten Y.A., MacPherson M. & Stevens L., 2001. Physiological bases of genetic differences in cannibalism behavior of the confused flour beetle Tribolium confusum. Evolution, 55(4), 797-806.
Gordeev M.I. & Sibataev A.K., 1995. Age-dependent selection and ability for cannibalism in malaria mosquito larvae with different karyotypes. Genetika, 31, 939-946.
Gould S.J., 1984. Only his wings remained. Nat. Hist., 93, 10-18.
Hahn E.C. et al., 1997. Mechanisms of transmission of Aujeszky’s disease virus originating from feral swine in the USA. Vet. Microbiol., 55, 123-130.
Hammar J., 2000. Cannibals and parasites: conflicting regulators of bimodality in high latitude Arctic char, Salvelinus alpinus. Oikos, 88, 33-47.
Hanbury R.D., Doby P.B., Miller H.O. & Murrell K.D., 1986. Trichinosis in a herd of swine-cannibalism as a major mode of transmission. J. Am. Vet. Med. Assoc., 188, 1155-1159.
Hausfater G. & Hrdy S., 1984. Infanticide: comparative and evolutionary perspectives. New York, USA: Aldine Publishing Company.
Hecht T. & Pienaar G.A., 1993. A review of cannibalism and its implications in fish larviculture. J. World Aquacult. Soc., 24, 246-259.
Heinze J., Stengl B. & Sledge M.F., 2002. Worker rank, reproductive status and cuticular hydrocarbon signature in the ant, Pachycondyla cf. inversa. Behav. Ecol. Sociobiology, 52, 59-65.
Hiraiwa-Hasegawa M., 1992. Cannibalism among non-human primates. In: Elgar M. & Crespi J., eds. Cannibalism: ecology and evolution among diverse taxa. Oxford, UK: Oxford University Press, 323-338.
Ho F. & Dawson P., 1966. Egg cannibalism by Tribolium larvae. Ecology, 47, 318-322.
Hoffman E. & Pfennig D., 1999. Proximate causes of cannibalistic polyphenism in larval tiger salamanders. Ecology, 80, 1076-1080.
Hseu J.R., 2002. Effects of size difference and stocking density on cannibalism rate of juvenile grouper, Epinephelus coioides. Fish. Sci., 68, 1384-1386.
Hughes R., 1985. Predatory behavior of Natica unifasciata feeding intertidally on gastropods. J. Molluscan Stud., 51, 331-335.
Jasienski M. & Jasienska G., 1988. Parental correlates of the variability in body mass at hatching in Arctia caja larvae (Lepidoptera: Arctiidae). Entomol. Genet., 13, 87-93.
Kalueff A. et al., 2006. Behavioural anomalies in mice evoked by ‘‘Tokyo’’ disruption of the Vitamin D receptor gene. Neurosci. Res., 54, 254-260.
Kiesecker J. & Blaustein A., 1999. Pathogen reverses competition between larval amphibians. Ecology, 80, 2442-2448.
Klomp H., 1964. Intraspecific competition and the regulation of insect numbers. Annu. Rev. Entomol., 9, 17-40.
Knell R. J., Begon M. & Thompson D.J., 1996. Transmission dynamics of Bacillus thuringiensis infecting Plodia interpunctella: a test of the mass action assumption with an insect pathogen. Proc. R. Soc. B, 263, 75-81.
Knell R. J., Begon M. & Thompson D.J., 1998. Transmission of Plodia interpunctella granulosis virus does not conform to the mass action model. J. Anim. Ecol., 67, 592-599.
Kohmatsu Y., Nakano S. & Yamamura N., 2001. Effects of head shape variation on growth, metamorphosis and survivorship in larval salamanders (Hynobius retardatus). Ecol. Res., 16, 73-83.
Koie M., 2000. Life cycle and seasonal dynamics of Cucullanus cirratus of Miller, 1777 (Nematoda, Ascaridida, Seuratoidea, Cucullanidae) in Atlantic cod, Gadus morhua L. Can. J. Zool., 78, 182-190.
Krebs J.R. & Davies N.B., 1993. Behavioural Ecology. 4th edition. Oxford, UK: Blackwell Science.
Kurihara Y. & Okamoto K., 1987. Cannibalism in a grapsid crab, Hemigrapsus penicillatus. Mar. Ecol. Prog. Ser., 41, 123-127.
Kusano T., Kusano H. & Miyashita K., 1985. Size-related cannibalism among larval Hynobius nebulosus. Copeia, 1985, 472-476.
Lannoo M. & Bachmann M., 1984. Aspects of cannibalistic morphs in a population of Ambystoma tigrinum larvae. Am. Midl. Nat., 112, 103-109.
Lannoo M.J., Townsend D.S. & Wassersug R.J., 1987. Larval life in the leaves: arboreal tadpole types, with special attention to the morphology, ecology, and behavior of the oophagous Osteopilus brunneus (Hylidae) larva. Fieldiana Zool., 38, 1-31.
Lindenbaum S., 1979. Kuru sorcery: disease and dangers in the New Guinean highlands. Mountain Few, CA, USA: Mayfield Publishing Company.
Lindenbaum S., 2004. Thinking about cannibalism. Ann. Rev. Anthropol., 33, 475-498.
Lipinski M. & Linkowski T., 1988. Food of the squid Ommastrephes bartramii (Lesueur, 1821) from the South-West Atlantic Ocean. S. Afr. J. Mar. Sci., 6, 43-46.
MacArthur R.H., 1958. Population ecology of some warblers of the northeastern coniferous forest. Ecology, 39, 599-619.
MacArthur R.H. & Pinaka E.R., 1966. On optimal use of a patchy environment. Am. Nat., 100, 603-609.
MacNeil C. et al., 2003. Parasite transmission and cannibalism in an amphipod (Crustacea). Int. J. Parasitol., 33, 795-798.
Malagon F., Castillo L. & Tapia J.L., 1994. Experimental transmission of murine malaria by cannibalism on mice infected by Plasmodium berghei yoelii. Acta Protozool., 33, 191-193.
Manica A., 2002. Filial cannibalism in teleost fish. Biol. Rev., 77, 261-277.
Manica A., 2003. The effect of brood size and age on partial filial cannibalism. J. Fish Biol., 63, 37-47.
Matuschka F.R. & Bannert B., 1989. Recognition of cyclic transmission of Sarcocystis stehlinii n-sp in the Gran Canarian giant lizard. J. Parasitol., 75, 383-387.
Maxwell M.R., 1998. Lifetime mating opportunities and male mating behaviour in sexually cannibalistic praying mantids. Anim. Behav., 55, 1011-1028.
Maynard Smith J., 1978. The evolution of sex. Cambridge, UK: Cambridge University Press.
McCormick A.L. & Nickol B.B., 2004. Postcyclic transmission and its effect on the distribution of Paulisentis missouriensis (Acanthocephala) in the definitive host Semotilus atromaculatus. J. Parasitol., 90, 103-107.
McFarland D., 2001. Le comportement animal. Psychobiologie, éthologie et évolution. Paris ; Louvain-la-Neuve, Belgique : De Boeck Université.
Mecom J., 1972. Feeding habits of Trichoptera in a mountain stream. Oikos, 23, 401-407.
Michaud J.P., 2003. A comparative study of larval cannibalism in three species of ladybird. Ecol. Entomol., 28(1), 92-101.
Nishihara A., 1996. Effects of density on growth of head size in larvae of the salamander Hynobius retardatus. Copeia, 1996, 478-483.
Nishihara-Takahashi A., 1999. Faster growth of head size of prefeeding larvae in a cannibalistic population of the salamander Hynobius retardatus. Zool. Sci., 16, 303-307.
Noirot E., 1972. Ultrasounds and maternal behaviour in small rodents. Dev. Psychobiol., 5, 371-387.
Numelin M., 1989. Cannibalism in waterstriders (Heteroptera: Gerrridae): is there kin recognition? Oikos, 56, 87-90.
Ohdachi S., 1994. Growth, metamorphosis and gape-limited cannibalism and predation on tadpoles in larvae of salamanders Hynobius retardatus. Zool. Sci., 11, 127-131.
Omar A.H., 1995. Cannibalism and predation behaviour of the blowfly, Chrysomyia albiceps (Wiedemann) larvae (Diptera: Calliphoridae). J. Egypt Soc. Parasitol., 25, 729-743.
Orr B., Murdoch W. & Bence J., 1990. Population regulation, convergence and cannibalism in Notonecta (hemiptera). Ecology, 71, 68-82.
Osawa N., 1989. Sibling and non sibling cannibalism by larvae of lady beetle Harmonia axyridis Pallas (Coteoptera: Coccinellidae) in the field. Res. Popul. Ecol., 31, 153-160.
Osawa N., 2002. Sex-dependent effects of sibling cannibalism on life history traits in the ladybird beetle Harmonia axyridis (Coleoptera: Coccinellidae). Biol. J. Linn. Soc., 76, 349-360.
Patou-Mathis M., 2002. Comportements de subsistance durant le dernier interglaciaire en Europe. In: Tuffreau A. & Roebroek W., eds. Le dernier interglaciaire et les occupations humaines du Paléolithique Moyen. Oxford, UK: Oxbow, 53-65.
Patou-Mathis M., 2006. Neanderthal. Une autre humanité. Paris : Édition Perrin.
Pearman P.B., Garner T.W.J., Straub M. & Greber U.F., 2004. Response of the Italian agile frog (Rana latastei) to a Ranavirus, frog virus 3: a model for viral emergence in naive populations. J. Wildl. Dis., 40, 660-669.
Persson L. et al., 2003. Gigantic cannibals driving whole lake trophic cascades. Proc. Natl Acad. Sci., 100, 4035-4039.
Pfennig D.W., 1990. The adaptive significance of an environmentally cued developmental switch in an anuran tadpole. Oecologia, 85, 101-107.
Pfennig D., Leob L. & Collins J., 1991. Pathogens as a factor limiting the spread of cannibalism among tiger salamanders. Oecologia, 88, 161-166.
Pfennig D. & Collins J., 1993. Kinship affects morphogenesis in cannibalistic salamanders. Nature, 362, 836-838.
Pfennig D., Ho S. & Hoffman E., 1998. Pathogen transmission as a selective force against cannibalism. Anim. Behav., 55, 1255-1261.
Pfennig D.W., 2000. Effect of predator-prey phylogenetic similarity on fitness consequences of predation: a trade-off between nutrition and disease. Am. Nat., 155, 335-345.
Pierce B., Mitton J., Jacobson L. & Rose F., 1983. Head shape and size in cannibal and noncannibal larvae of the tiger salamander from West Texas. Copeia, 1983, 1006-1012.
Polis G., 1981. The evolution and dynamics of intraspecific predation. Annu. Rev. Ecol. Syst., 12, 125-151.
Polis G. & Myers C., 1985. A survey of intraspecific predation among reptiles and amphibians. J. Herpetol., 19, 99-107.
Pottier J., 2007. Rights violations, rumour, and rhetoric: making sense of cannibalism in Mambasa, Ituri (Democratic Republic of Congo). J. R. Anthropol. Inst., 13(4), 825-843.
Pozio E., 2000. Factors affecting the flow among domestic, synanthropic and sylvatic cycles of Trichinella spp. Vet. Parasitol., 93, 241-262.
Prusiner S.B., Cochran S.P. & Alpers M.P., 1985. Transmission of scrapie in hamsters. J. Infect. Dis., 152, 971-978.
Qureshi T. et al., 2000. Transmission of Mycobacterium bovis from experimentally infected ferrets to non-infected ferrets (Mustela furo). N. Z. Vet. J., 48, 99-104.
Ramade F., préf., 2001. Dictionnaire de l’écologie. Encyclopaedia Universalis. Paris : Albin Michel.
Raven P.H., Johnson G.B., Losos J.B. & Singer S.S., 2007. Biologie. Bruxelles : Edition De Boeck Université.
Remy J., 2003. Actes de cannibalisme au Congo : rapport de la mission des Nations d’Observation des Nations Unies (Monuc.Org), http://repositories.lib.utexas.edu/handle/2152/5298, (03/07/09).
Ricklefs R.E. & Miller G.L., 2005. Ecologie. Paris ; Louvain-la-Neuve, Belgique : De Boeck Université.
Rinkevich B. & Weissman I., 1987. The fate of Botryllus (Ascidiacea) larvae cosettled with parental colonies: beneficial or deleterious consequences. Biol. Bull., 173, 474-488.
Robinson M.H. & Robinson B., 1980. Comparative studies of the courtship and mating behaviour of tropical araneid spiders. Honolulu, Hawaii: Bishop Museum, 40-47.
Roff D.A., 1992. The evolution of life histories. New York, USA: Routledge, Chapman and Hall, Inc.
Rose F.L. & Armentrout D., 1976. Adaptive strategies of Ambystoma tigrinum Green inhabiting the Llano Estacado of West Texas. J. Anim. Ecol., 45, 713-729.
Rüger M., Fröba J. & Foitzik S., 2008. Larval cannibalism and worker-induced separation of larvae in Hypoponera ants: a case of conflict over caste determination. Insect Soc., 55, 12-21.
Sadler L. & Elgar M., 1994. Cannibalism among amphibian larvae: a case of good taste. Trends Ecol. Evol., 9, 5-6.
Schaub G.A., Boker C.A., Jensen C. & Reduth D., 1989. Cannibalism and coprophagy are modes of transmission of Blastocrithidia triatomae (Trypanosomatidae) between triatomines. J. Protozool., 36, 171-175.
Sherman P.W., 1981. Reproductiven competition and infanticide in Belding’s ground squirrels and other animals. In: Alexander R.D. & Tinkle D.W., eds. Natural selection and social behaviour. New York, USA: Chiron Press, 311-331.
Sokoloff A., 1974. The biology of Tribolium. II. Oxford, UK: Clarendon Press.
Stearns S.C., 1992. The evolution of life histories. Oxford, UK: Oxford University Press.
Stephens D.W. & Charnov E.L., 1982. Optimal foraging: some simple stochastic models. Behav. Ecol. Sociobiol., 10, 251-263.
Stevens L., 1989. The genetics and evolution of cannibalism in flour beetles, genus Tribolium spp. Evolution, 43, 169-179.
Svenning M.A. & Borgstrom R., 2005. Cannibalism in Arctic charr: do all individuals have the same propensity to be cannibals? J. Fish Biol., 66, 957-965.
Taylor J.D., 1970. Feeding habits of predatory gastropods in a Tertiary (Eocene) molluscan assemblage from the Paris basin. Palaeontology, 13, 254-260.
Torossian C., 1968. Les caractères de la ponte des ouvrières de la fourmi Dolichoderus quadripunctatus. Insect Soc., 15, 51-72.
Torossian C., 1979. Importance quantitative des œufs abortifs d’ouvrières dans le bilan trophique de la colonie de la fourmi Dolichoderus quadripunctatus. Insect Soc., 26, 295-299.
Trinkaus E., 1978. Functional implications of the Kaprina Neanderthal lower limb remains. In: Malez M., ed. Krainiski Pracovjek i evolucija Hominida. Zagreb, Croatia: J.A.ZU., 155-192.
Via S., 1998. Cannibalism facilitates the use of the novel environment in the flour beetle, Tribolium castaneum. Heredity, 82, 267-275.
Wakahara M., 1995. Cannibalism and the resulting dimorphism in larvae of a salamander Hynobius retardatus, inhabited in Hokkaido. Jpn Zool. Sci., 12, 467-473.
Wakano J.Y., Kohmatsu Y. & Yamamura N., 2002. Evolutionary dynamics of frequency-dependent growth strategy in cannibalistic amphibians. Evol. Ecol. Res., 4, 719-736.
Wakano J.Y., 2003. Drastic growth effect may explain sympatric cannibalistic polymorphism. J. Theor. Biol., 226, 69-77.
Warburg M., Degani G. & Warburg L., 1979. Growth and population structure of Salamandra salamandra (L.) larvae in different limnological conditions. Hydrobiologia, 64, 147-55.
White T.D., 1986. Cutmarks on the bodo cranium: a case of prehistoric defleshing. Am. J. Phys. Anthropol., 69, 503-509.
White T.D., 1992. Prehistoric cannibalism at Mancos 5MTUMR-2346. Princeton, NJ, USA: Princeton University Press.
Whoriskey F. & Fitzgerald G., 1985. Sex, cannibalism and sticklebacks. Behav. Ecol. Sociobiol., 18, 15-18.
Williams T. & Hernández O., 2006. Costs of cannibalism in the presence of an iridovirus pathogen of Spodoptera frugiperda. Ecol. Entomol., 31, 106-113.
Wood J.T. & Goodwin O.K., 1954. Observations on the abundance, food, and feeding behaviour of the newt, Notophthalmus viridescens viridescens (Rafinesque), in Virginia. J. Elisha Mitchell Sci. Soc., 70, 27-30.
Wourms J., 1977. Reproduction and development in chondrichthyan fishes. Am. Zool., 17, 379-410.
Wu J.L. et al., 2001. Effects of shrimp density on transmission of penaeid acute viremia in Penaeus japonicus by cannibalism and the waterborne route. Dis. Aquat. Org., 47, 129-135.
Young C., 1988. Ascidian cannibalism correlates with larval behavior and adult distribution. J. Exp. Mar. Biol. Ecol., 117, 9-26.
