- Accueil
- Volume 15 (2011)
- numéro 4
- Culture in vitro de Jatropha curcas L.
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Culture in vitro de Jatropha curcas L.

Notes de la rédaction
Reçu le 18 janvier 2011, accepté le 14 avril 2011
Résumé
L'extension de la culture de Jatropha curcas L. comme espèce productrice de biocarburant nécessite la mise à la disposition des producteurs d'un très grand nombre de plantes en un laps de temps très court. Ces plantes doivent pouvoir donner un haut rendement en huile et être morphologiquement et phénologiquement homogènes afin de faciliter les opérations culturales. Si les fortes teneurs en huile peuvent être obtenues par sélection variétale, l'obtention de matériel homogène passe par la propagation in vitro. Diverses méthodes de production massive par culture axénique ont été publiées. La présente étude passe en revue les protocoles de multiplication in vitro connus de J. curcas et discute de leurs possibilités d'application à l'échelle industrielle.
Abstract
In vitro culture of Jatropha curcas L. The extension of Jatropha curcas L. cultivation as a biofuel feedstock species requires the distribution of a very large number of plants to the producers in a very short period of time. These plants have to be able to give a high oil yield and be morphologically and phenotypically homogeneous to facilitate cultural operations. If high oil content can be obtained by varietal selection, the achievement of homogeneous material passes by the in vitro propagation. Various methods of mass production of plant material by axenic culture have been published. This study reviews the protocols published for in vitro propagation of J. curcas and discusses their applicability to an industrial scale.
Table des matières
1. Introduction
1Parmi les cultures potentiellement utilisables pour fournir la matière première indispensable pour la production de biocarburant, Jatropha curcas L., de la famille des Euphorbiaceae, est celle qui suscite le plus d'intérêt pour divers organismes de développement dans les régions tropicales et subtropicales. Ses graines contiennent 30 à 40 % d'une huile non comestible (Takeda, 1982 ; Heller, 1996 ; Sujatha et al., 1996). C'est un petit arbre ou un grand arbuste qui peut atteindre une hauteur de 3 à 5 m, voire 8 à 10 m dans des conditions favorables (Kumar et al., 2008). Il est largement distribué à l'état sauvage ou semi-cultivé en Amérique Centrale et du Sud, en Afrique sub-saharienne, en Inde et en Asie du Sud-Est (Baker, 1877 ; Cano-Asseleih, 1986 ; Cano-Asseleih et al., 1989). J. curcas est présent dans les climats tropicaux semi-arides et subtropicaux chauds. Il se développe à des altitudes de 0 à 1 500 m au-dessus du niveau de la mer. Il ne nécessite aucun entretien particulier pour fructifier, demande au moins 400 à 600 mm de précipitations annuelles mais supporte mal des précipitations supérieures à 2 000 mm. C'est une plante héliophile, se développant bien sous des températures moyennes allant de 20 à 32 °C (Henning, 2007 ; Kumar et al., 2008). Elle est décrite comme résistant à des sècheresses pouvant durer jusqu'à 7 mois et tolérant des températures basses voire même un gel de très courte durée (Katwal et al., 2003). J. curcas peut pousser sans beaucoup de soins sur des sols salins, infertiles ou marginaux (Singh et al., 2007). Si toutes les parties de J. curcas sont utilisées en médecine traditionnelle pour des usages très variés, il a été montré, entre autres, que le latex contient de la jatrophine, un alcaloïde aux propriétés anti-cancéreuses (Parsons, 2005).
2Contrairement à d'autres plantes oléagineuses, cet arbuste commence généralement à produire des fruits à partir de la deuxième année et sa durée de production serait de 40 à 45 ans sans replantation. Utilisé depuis longtemps comme haie dans les régions sahéliennes, ses fruits accumulent de l'huile qui brûle sans dégagement de fumée. Cette huile sert généralement de matière première pour la fabrication du savon. Elle peut également être utilisée dans les moteurs diesel sans transformation ou être trans-estérifiée en biocarburant avec la production de glycérine comme sous-produit (Datta et al., 2007). La qualité de l'huile de J. curcas est idéale pour une utilisation en tant que biodiesel. De plus, selon Prabakaran et al. (1999), cette huile est économique en termes de bilan carbone par rapport au carburant fossile.
3Différentes sources bibliographiques affirment que J. curcas est une plante unique, parmi les cultures énergétiques, si l'on considère le nombre d'avantages qui peuvent être attendus de sa culture à grande échelle. Son utilisation pour la production de biocarburant pourrait être d'un intérêt majeur pour pallier les pénuries d'énergie, accélérer la réduction des émissions de gaz à effet de serre par un bilan carbone neutre et contribuer à l'augmentation des revenus des agriculteurs (Openshaw, 2000). Cependant, plusieurs défis technologiques subsistent pour son exploitation commerciale. La diffusion de sa culture à large échelle demande notamment la production massale, en un laps de temps court, d'un matériel végétal de plantation de qualité, phénotypiquement homogène, adapté aux conditions de culture des zones d'implantation, à mettre à la disposition des paysans et autres exploitants. Sa multiplication se fait classiquement par graines ou par boutures au champ ainsi que par semis et bouturages en pépinière (Henning, 2007 ; Nyamai et al., 2007). Toutefois, ces méthodes de multiplication présentent toutes des inconvénients. Jha et al. (2007) affirment que la multiplication de J. curcas par semis permet de cultiver au champ des plantes qui sont hétérogènes et dont les graines contiennent des quantités variables en huile. D'autre part, dans le cas des cultures en pépinière, la nécessité de transporter les plants produits vers le lieu de transplantation rend la méthode onéreuse. En ce qui concerne la culture par bouturage, les plants obtenus développent un système racinaire superficiel qui les rend sensibles à la verse et constitue un obstacle majeur pour leur maintien sur des sols pauvres ou lessivés (Nyamai et al., 2007). Face à ces différentes solutions, la culture in vitro apparait comme une voie alternative permettant de produire à la fois massivement et rapidement des plantes d'un clone productif sélectionné, voire amélioré. Plusieurs protocoles ont été mis au point pour la micropropagation de J. curcas. Leur application à l'échelle industrielle pourrait permettre de multiplier massivement et à un prix compétitif, de nouveaux cultivars plus productifs en vue de l'extension de la culture pour la production d'agrocarburants.
2. Culture in vitro de Jatropha curcas
4Parmi les différentes techniques élaborées pour la multiplication in vitro de J. curcas, on distingue la micropropagation par bourgeonnement axillaire ou adventif et l'embryogenèse somatique. Le principe de la culture in vitro des végétaux est de cultiver des explants en conditions axéniques sur des milieux nutritifs qui sont également favorables au développement de micro-organismes. Il convient donc d'assurer des conditions d'asepsie par la désinfection du matériel végétal ainsi que la stérilisation des milieux de culture et du matériel de travail (Boulay, 1993). Il s'agit ensuite de définir les milieux ainsi que les conditions de culture à appliquer aux techniques de multiplication in vitro choisies pour obtenir des taux de multiplication assez élevés pour rendre l'opération rentable.
2.1. Conditions générales de mise en culture in vitro
5Désinfection du matériel végétal. Suivant la provenance des explants, deux méthodes sont classiquement utilisées : la désinfection au chlorure de mercure, généralement employée sur du matériel potentiellement infecté, et la désinfection à l'hypochlorite de calcium.
6Deore et al. (2008), Sarika et al. (2009), Pratibha et al. (2010) et Purkayastha et al. (2010) ont utilisé la première méthode pour désinfecter des explants de J. curcas provenant de serres, de pépinières ou du champ. Elle consiste à laver d'abord les explants à l'eau courante, les tremper ensuite dans une solution fongicide (systémique et à large spectre d'action) pendant 1 à 2 h avant de les rincer 3 à 4 fois dans de l'eau distillée. Les explants sont alors plongés dans de l'alcool à 70 % pendant 30 s, puis immergés dans une solution de chlorure de mercure à 0,1 %. Le temps d'immersion dans cette dernière solution varie suivant le type d'explant : de 10 à 15 min pour des explants foliaires ou des apex et de 15 à 30 min pour des explants nodaux. Après le traitement au chlorure de mercure, le matériel est rincé quatre fois avec de l'eau distillée stérile, pour éliminer toute trace de substance désinfectante.
7Sujatha et al. (1996) ont désinfecté les explants nodaux de J. curcas à l'hypochlorite de calcium. Les explants sont d'abord lavés à l'eau courante, puis dans une solution de Dettol à 5 % et trempés dans l'alcool à 70 % pendant 30 s. Ils sont ensuite immergés dans une solution filtrée d'hypochlorite de calcium à 10 % pendant 10 à 15 min pour les feuilles, les apex et cotylédons, 20 à 30 min pour les nœuds. Enfin, on effectue trois rinçages successifs avec de l'eau distillée stérile, dont un rinçage en agitation pendant 1 min, sous une hotte à flux laminaire stérile.
8Stérilisation des milieux et du matériel de travail. En général, les milieux de culture et le matériel de travail sont stérilisés par autoclavage pendant 20 min à une température de 121 °C et sous une pression de 1,35 bar (Sujatha et al., 1996 ; Deore et al., 2008 ; Kalimuthu et al., 2007 ; Sarika et al., 2009 ; Purkayastha et al., 2010).
9Milieux et conditions de culture. Quelle que soit la technique de propagation, le milieu de base généralement utilisé est le milieu de Murashige et Skoog (1962) [MS]. Le pH est ajusté à 5,7 ± 0,1 et le milieu est solidifié avec de l'agar à une concentration variable (de 0,70 % à 0,90 %) selon la qualité du produit commercialisé par les différents fournisseurs tels que S.D. Fine, Hi-media ou Merck (Datta et al., 2007 ; Sarika et al., 2009).
10Après la mise en culture sous hotte à flux laminaire, les conteneurs sont placés dans des chambres conditionnées à une humidité relative de 70 à 80 %. Pour la micropropagation au sens strict, les cultures sont soumises à éclairement, avec une photopériode de 16 h de lumière et 8 h d'obscurité et une intensité lumineuse de 60 à 80 µM.m-².s-1 et 27 ± 2 °C de température (Deore et al., 2008 ; Khurana-Kaul et al., 2010 ; Singh et al., 2010). Pour l'embryogenèse somatique à partir d'explants cotylédonaires, les cals embryogènes sont induits à 24 ± 2 °C dans l'obscurité totale pendant 24 h, puis transférés à une photopériode de 14 h de lumière par jour à 80 µM.m-².s-1 (Kalimuthu et al., 2007). Par contre, l'embryogenèse somatique à partir d'explants foliaires est obtenue pour une photopériode de16 h de lumière par jour, une intensité lumineuse de 80 µmol.m-².s-1 et une température de 22 ± 2 °C (Jha et al., 2007).
2.2. La micropropagation
11La multiplication conforme au sens strict se fait par bourgeonnement des axillaires, à partir d'explants nodaux de jeunes tiges, et par culture d'apex. Mais elle peut également être obtenue par bourgeonnement adventif (organogenèse) sur des fragments de feuilles, de cotylédons ou de tiges (épicotyle ou hypocotyle) utilisés comme explants. On distingue alors l'organogenèse directe et indirecte lorsque les bourgeons apparaissent sans ou après la formation de cal.
12La microprapagation par culture d'axillaires. La multiplication clonale à partir des nœuds de tiges est une méthode de culture in vitro couramment utilisée chez beaucoup d'espèces végétales. Elle correspond à la régénération des plantes entières par développement de bourgeons axillaires. La composition minérale et hormonale du milieu ainsi que la succession de différents milieux de culture sont des facteurs importants dans l'obtention de taux élevés de multiplication. Chez J. curcas, les explants nodaux peuvent être prélevés sur des plantes cultivées en champ ou en conditions contrôlées (Datta et al., 2007). Les meilleurs résultats sont obtenus lorsque les explants sont cultivés sur milieu MS additionné de sulfate d'adénine (55,6 µM) et de diverses concentrations en cytokinines : kinétine, benzylaminopurine BA, thidiazuron (TDZ ) ou N6-[2-Isopentyl]adenine (2-iP). La culture sur un milieu contenant ces cytokinines, mais dont la concentration en éléments majeurs est divisée par deux (MS/2), ne permet pas la régénération de plantes. Les cytokinines donnent des réponses variables en taux de multiplication, c'est-à-dire en nombre de tiges formées par explant et par repiquage (Sarika et al., 2009 ; Khurana-Kaul et al., 2010). Ainsi, la kinétine seule (2,3 à 23,2 µM) donne des taux faibles (2,2 à 3,5) après quatre ou six semaines (Datta et al., 2007). La TDZ a un effet limité (Datta et al., 2007), alors qu'elle favorise une bonne multiplication chez certaines plantes comme Artemisia vulgaris (Sujatha et al., 2007) ou Rhododendron spp. (Pavingerová, 2009). Parmi les cytokinines, c'est la BA qui semble la plus efficace, donnant un taux de multiplication moyen de 6,8 tiges par explant après 6 semaines (Prathiba et al., 2010). Cet effet de la BA a également été démontré sur plusieurs plantes de la famille des Euphorbiaceae (Datta et al., 2007).
13La combinaison de plusieurs substances de croissance parait également très favorable. Kalimuthu et al. (2007) ont obtenu en six semaines trente à quarante plants par nœud mis en culture, en combinant de faibles concentrations de kinétine (4,64 µM), de BA (6,65 µM) et d'acide-3-indole acétique (AIA) (0,28 µM). Sujatha et al. (2005) ont démontré que le nombre de tiges produites par explant nodal mis en culture varie suivant la nature et la concentration des régulateurs de croissance présents dans le milieu d'initiation. Pour des bourgeons axillaires initiés sur MS supplémenté de 2,3 à 45,4 µM de kinétine, de TDZ ou de BA, cette équipe a obtenu respectivement 4, 10 et 24 tiges par explant après transfert des explants sur le milieu de multiplication MS contenant 2,5 µM d'acide-3-indole butyrique (AIB) et 8,9 µM de BA. D'autre part, pour des nœuds initiés sur MS additionné d'AIB (4,92 µM) et de BA (8,87 µM), Medza Mvé et al. (2010) ont obtenu, après trois semaines, un taux de multiplication de 8,4 tiges par nœud après transfert sur un milieu MS contenant 2,46 µM d'AIB et 6,65 µM de BA. L'ensemble de ces résultats montre que la présence de BA, dans les milieux d'initiation et de multiplication enrichis en d'autres substances de croissance, serait favorable à l'obtention d'un bon taux de micropropagation par culture axillaire.
14Le génotype joue également un rôle important sur le nombre de tiges produites par explant nodal en phase de multiplication. Ainsi, sur une variété de J. curcas non toxique originaire du Mexique âgée de 3 mois et cultivée en conditions contrôlées, Sujatha et al. (2005) ont obtenu un taux de 2,3 tiges par nœud après 4 semaines de culture sur un milieu de multiplication MS contenant 4,7 µM de kinétine. Pour la même durée de croissance, Datta et al. (2007) ont, quant à eux, enregistré jusqu'à 30 tiges par explant sur un milieu MS contenant 4,6 µM du même régulateur de croissance pour une variété de J. curcas toxique originaire du Bengale.
15Pour obtenir la croissance des plantules nouvellement formées, les tiges feuillées obtenues sur milieu de multiplication sont individualisées et leur élongation est réalisée sur un milieu MS contenant 4,5 µM BA et 7,5 µM AIB (Kumar et al., 2008). L'élongation des tiges peut également être obtenue grâce à une combinaison de BA (2,25 µM) et d'AIA (4,5 µM) sur MS (Kumar et al., 2010). Après cette étape, le développement de racines est réalisé sur milieu MS contenant de faibles concentrations en AIB (0,5-1 µM) (Datta et al., 2007). Cet enracinement peut aussi se faire sur un milieu MS/2 contenant 4,92 à 19,68 µM d'AIB, avec un optimum pour une concentration de 14,76 µM (Sarika et al., 2009). Mais on observe une absence de rhizogénèse et une production abondante de cals lorsque des tiges sont transférées pour enracinement sur MS/2 supplémenté en ANA et AIA (Datta et al., 2007 ; Sarika et al., 2009).
16Bien que différents protocoles de régénération de J. curcas à partir d'explants nodaux aient été mis au point, le nombre de plantules produits par cycle de culture et les taux de multiplication restent faibles, sauf pour certaines variétés, pour en envisager une application industrielle.
17La micropropagation par culture d'apex. Des apex de J. curcas mis en culture sur MS supplémenté avec diverses cytokinines développent un cal abondant à leur base et initient la formation de tiges après 7 jours. La prolifération se produit par deux voies :
18– l'élongation de la tige principale accompagnée de la formation des axillaires au niveau des nœuds,
19– l'inhibition de la croissance de la tige principale avec l'apparition de 4 à 6 bourgeons à la base du cal.
20Le type de cytokinine présent dans le milieu de culture joue un rôle déterminant sur la prolifération des apex. La BA (2,5 µM) fournit les meilleurs résultats, avec une moyenne de 6,2 tiges régénérées par apex mis en culture après 14 jours. Dans un milieu contenant la TDZ (2,5 µM), ces apex forment des bourgeons rabougris avec un taux de multiplication de 1,6 après trois semaines. Quant à la kinétine (2,5 µM) ou la 2-iP (5 µM), elles donnent des taux de multiplication respectifs de 3,2 et 2,7 (Purkayastha et al., 2010). Plusieurs auteurs ont montré que les cytokinines sont efficaces pour la multiplication de plusieurs espèces de la famille des Euphobiaceae à partir d'apex. C'est le cas d'Euphorbia lathyrus (Tideman et al., 1982 ; Ripley et al., 1986), d'Euphorbia peplus et d'Euphorbia tannensis (Tideman et al., 1982). Pour d'autres espèces de la famille, la présence d'une seule cytokinine semble favorable (Ripley et al., 1986), la combinaison de deux cytokinines n'ayant aucun effet synergique sur la prolifération des tiges, contrairement à ce qui est observé chez d'autres plantes (Purkayastha et al., 2010).
21Les apex de tiges de J. curcas cultivés sur milieu MS enrichi en BA (2,5 µM) semblent constituer un matériel idéal pour la multiplication in vitro, grâce à leur grande capacité à proliférer.
22Micropropagation par bourgeonnement adventif (organogenèse)
23Micropropagation à partir de tiges et de pétioles. La fréquence d'induction du bourgeonnement adventif dans le milieu de culture varie avec le type d'explant et les effets combinés des régulateurs de croissance (Lu et al., 2003 ; Wei et al., 2004). Ainsi, la régénération à partir d'explants d'hypocotyles et de pétioles a été tentée sur MS contenant différentes concentrations en cytokinine (zéatine, kinétine et BA), seule ou en combinaison avec l'AIB (Sujatha et al., 1996). Un faible taux de régénération de plantes entières (4 %) est obtenu après quatre semaines uniquement avec la zéatine seule, à une concentration de 9,12 µM. Sujatha et al. (2000) ont obtenu 50 et 67 % de régénération de tiges sur 60 explants mis en culture provenant respectivement de pétiole et d'hypocotyle sur un milieu MS contenant de la BA (2,21 µM), de l'AIB (4,92 µM) et de la kinétine (0,46 µM). L'augmentation de la concentration d'AIB, au-delà de 6,65 µM, inhibe la régénération des tiges à partir de ce type d'explant. Pour Wei et al. (2004), la présence de faibles concentrations en AIB (0,10 à 0,49 µM), en combinaison avec la BA, est indispensable pour la régénération. Les concentrations de ces deux régulateurs de croissance influencent fortement le potentiel de propagation (Lu et al., 2003 ; Wei et al., 2004). Au cours de la régénération des plantes entières de J. curcas à partir des explants de pétiole, on peut observer la formation de structures globulaires ressemblant à des embryons somatiques sur milieu MS contenant de la BA (4,44 µM) et de l'AIB (4,92 µM). Mais ces structures ne se développent pas en plantes entières (Sujatha et al., 2000).
24Wei et al. (2004) ont pu régénérer des plantules à partir des explants d'épicotyle. Ces explants étaient prélevés sur des vitroplants, âgés d'un mois, issus de la culture in vitro d'embryons somatiques. Mis en culture sur MS contenant 0,49 µM d'AIB en combinaison avec 0,88 à 2,21 µM de BA, 38 % de ces explants, sur un effectif de 40, ont régénéré des plantules après 30 jours.
25Bien que les pourcentages de régénération soient assez élevés lorsque l'on utilise des explants de tiges ou de pétioles, le nombre de plantules obtenues à partir d'un explant reste trop faible pour que la production de vitroplants à grande échelle soit basée sur ce type de matériel végétal.
26Micropropagation à partir de cotylédons et de feuilles. En ce qui concerne la culture de cotylédons, il semblerait que le type de cytokinine soit le facteur qui influence le plus fortement le développement de nouvelles tiges. Des fragments de cotylédons mis en culture sur MS complété avec une cytokinine, la TDZ ou la BA, ont pu régénérer des tiges feuillées au bout de 6 semaines (Kumar et al., 2010). Pour des teneurs en TDZ de 9,08 µM, on note la formation de 26,2 tiges par explant après 6 semaines sur 93 % d'explants cotylédonaires mis en culture. En présence de BA (13,5 à 54 µM), le nombre moyen de tiges régénérées varie de 3,6 à 6,9 par explant sur moins de 50 % des explants. De plus, les études montrent que les résultats sont meilleurs lorsque les cotylédons sont prélevés sur plantules de J. curcas cultivées in vitro. Selon les auteurs, la différence des teneurs endogènes en régulateurs de croissance entre les plantules issues d'in vitro et celles in vivo serait à l'origine de la disparité des résultats. Schween et al. (2003) avaient émis cette hypothèse en ce qui concerne les cytokinines endogènes pour expliquer les différences de résultats obtenus au cours de la période d'induction à partir des explants cotylédonaires.
27L'élongation des tiges est ensuite réalisée sur milieu MS contenant généralement de la BA à 2,25 µM et de l'AIA à 8,5 µM, alors que l'enracinement est obtenu sur milieu MS sans régulateur de croissance (Kumar et al., 2008).
28En fait, selon Sujatha et al. (1996) et Deore et al. (2008), les explants de feuilles représentent un matériel de choix pour la micropropagation de J. curcas. Après trois semaines de culture des explants sur milieu MS supplémenté de 8,9 µM de BA et 4,9 µM d'AIB, la régénération des plantes entières est obtenue après repiquage, toutes les quatre semaines, des tiges néoformées sur milieu MS contenant 8,9 µM de BA et 2,5 µM d'AIB. On enregistre un taux de multiplication de 4,3 sur 90 % de 60 explants foliaires mis en culture (Sujatha et al., 2005).
29Le meilleur bourgeonnement adventif est obtenu par Deore et al. (2008) après 4 à 6 semaines de culture sur milieu d'induction à base de MS contenant une combinaison de TDZ (2,27 µM), de BA (2,22 µM) et d'AIB (0,49 µM). La croissance des tiges est ensuite obtenue sur milieu MS contenant de la BA (4,44 µM), de la kinétine (2,33 µM), de l'AIA (1,43 µM) et du GA3 (0,72 µM). Ce milieu donne une moyenne de 11,5 tiges par explant foliaire après 12 semaines de culture comportant des subcultures toutes les 4 semaines. Les tiges feuillées obtenues (de 2 à 3 cm de hauteur) sont séparées et placées sur un milieu d'induction racinaire composé de milieu MS enrichi en AIB (0,5 µM). Après 30 jours de culture, 80 % des plantes ont régénéré des racines et sont prêtes à être acclimatées.
30De meilleurs résultats ont été obtenus récemment par Khurana-Kaul et al. (2010). Après 6 semaines de culture sur milieu MS contenant 0,90 μM TDZ, 0,98 μM d'AIB et 1 µM de sulfate de cuivre (CuSO4), ils ont obtenu 18,8 tiges par explant foliaire sur 80 % des explants foliaires mis en culture.
31Pratibha et al. (2010) ont montré que la position de la feuille sur la plante joue un rôle important sur son potentiel de régénération. Sur un milieu MS additionné de kinétine (2,32 µM) et d'AIB (0,98 µM), les explants prélevés sur de jeunes feuilles situées au niveau du premier nœud sécrètent abondamment des phénols dont l'oxydation entraine le brunissement et la mort des explants. Les feuilles situées sur le deuxième et le troisième nœud réagissent bien avec un taux de multiplication de 6,9 en 6 semaines de culture. Quant aux explants foliaires provenant de la feuille située sur le quatrième nœud, leur réponse est tardive, avec des taux de multiplication très faibles. Ils produisent quelques tiges, après 8 semaines, qui meurent par la suite. Les explants prélevés sur les feuilles situées au niveau du cinquième nœud ne présentent aucun potentiel de régénération, ce qui est certainement lié à leur degré de maturité. En général, les jeunes tissus et organes sont plus réactifs que les tissus et organes matures et bien différenciés (Krikorian, 1982).
2.3. L'embryogenèse somatique
32Il existe peu d'exemples d'utilisation de l'embryogenèse somatique pour multiplier J. curcas et ils sont tous basés sur la mise en culture d'explants cotylédonaires ou foliaires. Ainsi, Kalimuthu et al. (2007) ont placé des explants cotylédonaires sur milieu MS complété avec de l'eau de noix de coco ou une combinaison de BA (8,87 µM) et de kinétine (9,3 µM). De petits embryons somatiques globulaires commencent à se développer à la surface des explants entre 7 et 8 jours. Chaque explant donne entre 8 et 10 embryons somatiques après 5 semaines. Quant à Jha et al. (2007), ils ont obtenu des cals embryogènes après 4 semaines, sur 56 % de 15 explants foliaires mis en culture sur un milieu MS contenant 9,3 µM de kinétine. La moitié de ces cals embryogènes, remis en culture sur un milieu de prolifération constitué de MS contenant 2,3 µM de kinétine, 1 µM d'AIB et 13,6 µM de sulfate d'adénine, a formé en moyenne, à la périphérie, 58,5 embryons après 6 à 12 semaines. Dans ce milieu, on assiste à la formation d'embryons secondaires le long des pôles racinaires et caulinaires des embryons primaires. Cette formation d'embryons secondaires, attribuée à la synergie entre la kinétine, l'AIB et le sulfate d'adénine, est un avantage du point de vue du temps et du cout de production des plantes (Raemakers et al., 1995). La maturation des embryons somatiques est ensuite réalisée par l'adjonction de 13,6 µM de sulfate d'adénine dans le milieu de prolifération. Mais seuls 10 % de ces embryons se développent en plante entière. En fait, le passage des embryons somatiques à l'état de plantules représente une étape cruciale. Il se fait par le transfert des embryons, au stade torpille, âgés de 14 semaines dans un milieu dit de « conversion » durant 2 semaines pendant lesquelles les pôles caulinaires et racinaires deviennent bien distincts. Au cours des subcultures qui ont lieu tous les 21 jours, les embryons globulaires qui sont dominants prennent la forme de cœur, de torpille puis d'embryons cotylédonaires avec une bipolarité distincte. Les embryons bipolaires sont placés sur MS/2, sans régulateur de croissance, pour achever leur développement, avec la formation d'une tige possédant des feuilles vertes et des racines. Les plantules enracinées sont acclimatées avec un taux de survie de 90 % et transférées au champ. Elles ont une bonne stabilité génétique et ne présentent aucune anomalie morphologique.
2.4. Acclimatation des vitroplants
33Les procédés d'acclimation, qui permettent de passer les plantules du milieu de culture in vitro confiné à la culture en serre, ne sont pas fondamentalement différents d'une technique à l'autre. Suivant la méthode de Datta et al. (2007), les tiges enracinées âgées de 12-16 semaines, issues de la culture des nœuds de J. curcas, sont retirées du milieu, lavées à l'eau, trempées pendant 1 h dans une solution de fongicide systémique Bavistin à 0,1 % (carbendazime). Elles sont transplantées dans des pots en plastique contenant un mélange de terreau et de vermiculite (1:1). Les pots sont recouverts d'un film de polyéthylène transparent puis placés dans une enceinte contrôlée avec 80 % d'humidité relative et une température de 25-30 °C. Les films plastiques sont retirés après 3-5 semaines et les plants sont transférés en serre (25 ± 2 °C et 50-60 % d'humidité relative), dans des pots contenant du terreau simple. Kalimuthu et al. (2007) et Sarika et al. (2009) transfèrent les plantules enracinées sur différents types de substrats constitués par des mélanges : sol-sable (1:1), vermiculite-sable-sphaigne (1:1:1), fibres de coco décomposées-compost-perlite (1:1:1), compost-terre rouge-sable (1:1:1). Ils placent ensuite les pots en serre (75 % d'humidité relative et une température de 25 ± 2 °C), pendant 10 jours, sous un filet qui filtre 75 % de la lumière. Les plantules restent ensuite 2 semaines sous serre avant leur transplantation au champ. Pour les tiges allongées et enracinées provenant des explants cotylédonaires possédant 3 à 4 feuilles, elles sont acclimatées en serre en les plaçant dans des sacs plastiques contenant un mélange stérilisé terre-sable (1:1). Ce mélange est humidifié avec une solution de carbendazime (0,02 %) et les sacs sont recouverts d'un film plastique transparent pour conserver l'humidité. Après 3 à 4 semaines, les plantules sont mises dans des sacs contenant du terreau (Kumar et al., 2010). En général, l'origine du matériel végétal de base et la taille des plantules déterminent la méthode la mieux appropriée pour l'acclimatation des plantules de J. curcas. Cependant, l'acclimatation est toujours réalisée à une température de 25 ± 2 °C, pour une humidité relative de 50-75 % et sur des substrats bien aérés.
3. Discussion et conclusion
34Pour trouver une application au niveau industriel, les protocoles de multiplication doivent être fiables, simples et reproductibles. Ils doivent atteindre deux objectifs majeurs : la conformité des plants produits par rapport aux pieds-mères et un taux de multiplication élevé de manière à être économiquement rentables. En ce qui concerne J. curcas, les données bibliographiques montrent que le nombre de tiges régénérées, quel que soit le type d'explant et la technique utilisés, reste assez faible. Si l'on considère le tableau 1, on peut noter que seules les techniques de multiplication conforme par bourgeonnement axillaire, la régénération par culture d'explants de feuilles ou l'embryogenèse somatique sur explants cotylédonaires permettent d'obtenir des taux de multiplication assez élevés.
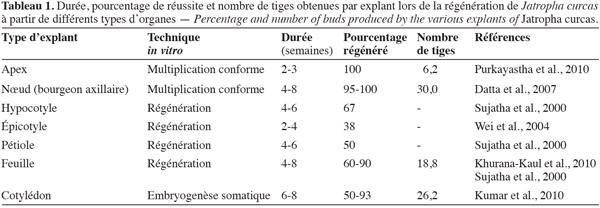
35Il faut cependant noter que l'embryogenèse somatique présente deux inconvénients. Tout d'abord, il existe une probabilité non négligeable d'apparition de variations somaclonales qui nuisent à la reproduction conforme par rapport aux pieds mères (Dubois, 1989). La technique demande alors une étape de recherche des variants en pépinière pour les éliminer. De plus, le développement asynchrone des embryons somatiques constitue un obstacle de taille car il entraine la perte d'une grande quantité de matériel végétal, immature ou trop développé au moment du prélèvement pour le passage des embryons sur le milieu de maturation (Jha et al., 2007). Il semblerait donc que les techniques de micropropagation par microbouturage ou régénération soient à privilégier. D'autre part, Deore et al. ont déposé un brevet portant sur le protocole de culture axénique des explants foliaires de J. curcas (Organisation Mondiale de la Propriété Intellectuelle, 2008). L'utilisation de cette technique pose donc un problème en termes économiques et de valorisation. Pour l'instant, seule la micropropagation par bourgeonnement axillaire semble être la technique à développer, si l'on arrive à diminuer les durées de cycle de culture et augmenter considérablement le taux de multiplication pour rentabiliser la production. On peut cependant noter qu'aucun des travaux cités n'a envisagé d'utiliser des explants de racines pour la multiplication végétative. Cet organe a pourtant donné des résultats intéressants pour la plante tropicale Aeschynomene sensitiva (Nef-Campa et al., 1996).
36Actuellement, des travaux réalisés à l'Université de Liège-Gembloux Agro-Bio Tech visent à mettre au point un protocole de multiplication in vitro de J. curcas applicable à l'échelle industrielle. Ces travaux sont axés sur la production de plants par induction d'agrégats de bourgeons à partir d'explants nodaux. Cette technique ouvre une nouvelle voie pour un accroissement significatif du taux de multiplication. Elle parait prometteuse et économiquement rentable du point de vue du nombre de plants obtenus par repiquage. Elle nécessitera cependant la vérification de la conformité des plants produits.
37Cette analyse bibliographique conduit à penser que la production de vitroplants pour la mise en culture de J. curcas sélectionnés demande encore à être améliorée. Il s'agit plus particulièrement d'améliorer les protocoles susceptibles de mettre à la disposition des exploitants de la filière un matériel végétal de plantation homogène adapté aux conditions de culture choisies et performant du point de vue des rendements.
38Remerciements
39Nous remercions le Programme d'Appui Institutionnel et de Développement des Ressources Humaines du Ministère de l'Économie, du Budget, des Comptes Publics, de la Fonction Publique et de la Réforme de l'État de la République Gabonaise ; l'Institut National Supérieur d'Agronomie et de Biotechnologies, Université des Sciences et Techniques de Masuku (USTM-INSAB), Gabon.
Bibliographie
Baker J.G., 1877. Flora of the Mauritius and the Seychelles. London: L. Reeve and Co.
Boulay J., 1993. Culture in vitro et ses applications à la culture des plantes carnivores. Bull. Dionée, 28, http://encyclo.free.fr/pages/in_vitro.htm, (5/09/10).
Cano-Asseleih L.M., 1986. Chemical investigation of Jatropha curcas L. seeds. PhD thesis: University of London (United Kingdom).
Cano-Asseleih L.M., Plumbly R.A. & Hylands P.J., 1989. Purification and partial characterization of the hemagglutination from seeds of Jatropha curcas L. J. Food Biochem., 13, 1-20.
Datta M.M., Mukherjee P., Ghosh B. & Jha T.B., 2007. In vitro clonal propagation of biodiesel plant (Jatropha curcas L.). Curr. Sci., 93(10), 1438-1442.
Deore A.J. & Johnson T.S., 2008. High frequency plant regeneration from leaf-disc cultures of Jatropha curcas L.: an important biodiesel crop. Plant Biotechnol. Rep., 2, 7-11.
Dubois J., 1989. Biotechnologie et amélioration des plantes : plantes vivrières tropicales. Paris : Éditions AUPEF-UREF, John Libbey Eurotext.
Heller J., 1996. Physic nut, Jatropha curcas L. Promoting the conservation and use of underutilized and neglected crops. n°1. Roma: International Plant Genetic Resource Institute.
Henning R.K., 2007. Jatropha curcas L. In: van der Vossen H.A.M. & Mkamilo G.S., eds. Prota 11(1): Medicinal plants/Plantes médicinales 1. [CD-Rom]. Wageningen, Pays-Bas: PROTA, http://database.prota.org/PROTAhtml/Jatropha%20curcas_Fr.htm, (02/10/2010).
Jha T.B., Mukherjee P. & Datta M.M., 2007. Somatic embryogenesis in Jatropha curcas L., an important biofuel plant. Plant Biotechnol. Rep., 1(3), 135-140.
Kalimuthu K., Paulsamy S., Senthilkumar R. & Sathya M., 2007. In vitro propagation of the biodiesel plant Jatropha curcas L. Plant Tissue Cult. Biotechnol., 17(2), 137-147.
Katwal R.P.S. & Soni P.L., 2003. Biofuels: an opportunity for socioeconomic development and cleaner environment. Indian Forester, 129(8), 939-949.
Khurana-Kaul V., Kachhwaha S. & Othari S.L., 2010. Direct shoot regeneration from leaf explants of Jatropha curcas in response to Thidiazuron and high copper contents in the medium. Biol. Plant., 54(2), 369-372.
Krikorian A.D., 1982. Cloning higher plants from aseptically cultured tissues and cells. Biol. Rev., 57, 151-218.
Kumar A. & Sharma S., 2008. An evaluation of multipurpose oil seed crop for industrial uses (Jatropha curcas L.). Rev. Ind. Crops Prod., 28, 1-11.
Kumar N., Vijay Anand K.G. & Reddy M.P., 2010. Shoot regeneration from cotyledonary leaf explants of Jatropha curcas: a biodiesel plant. Acta Physiol. Plant, 32, 917-924, http://www.springerlink.com/content/2207xwul1612xwj3/fulltext.pdf, (04/02/2010).
Lu W.D. et al., 2003. Induction of callus from Jatropha curcas and rapid propagation. Chin. J. Appl. Environ. Biol., 9(2),127-130.
Medza Mvé S.D., Mergeai G., Baudoin J.-P. & Toussaint A., 2010. Amélioration du taux de multiplication in vitro de Jatropha curcas L. Tropicultura, 28(4), 200-204.
Murashige T. & Skoog F., 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant, 15, 473-497.
Nef-Campa C., Chaintreuil-Dongmo C. & Dreyfus B.L., 1996. Regeneration of the tropical legume Aeschynomene sensitiva Sw. from root explants. Plant Cell Tissue Organ Cult., 44, 149-154.
Nyamai D.O. et al., 2007. Jatropha curcas - the untapped potential in Eastern and Central Africa: production and utilization manual. Nairobi: World Agroforestry Centre.
Openshaw K., 2000. A review of Jatropha curcas: an oil plant of unfulfilled promise. Biomass Bioenergy, 19, 1-15.
Organisation mondiale de la propriété intellectuelle, 2008. Direct regeneration of plantlets in Jatropha curcas. Johnson T.S & Deore A.C., Pub. No.: WO/2008/012832, International Application No.: PCT/IN2007/000132, http://www.wipo.int/patentscope/search/en/detail.jsf?docId=WO2008012832&recNum=65&office=&queryString=FP%3A%28+jatropha%29&prevFilter=&sortOption=Pub+Date+Desc&maxRec=77, (02/04/2010).
Parsons K., 2005. Jatropha in Africa - Fighting the desert and creating wealth, http://ecoworld.com/Home/Article2.cfm?tid=367, (03/04/2010).
Pavingerová D., 2009. The influence of thidiazuron on shoot regeneration from leaf explants of fifteen cultivars of Rhododendron. Biol. Plant., 53, 797-799.
Prabakaran A.J. & Sujatha M., 1999. Jatropha tanjorensis Ellis and Saroja, a natural interspecific hybrid occurring in Tamil Nadu, India. Genet. Resour. Crop Evol., 46, 213-218.
Pratibha M. et al., 2010. Establishment of long-term proliferating shoot cultures of elite Jatropha curcas L. by controlling endophytic bacterial contamination. Plant Cell Tissue Organ Cult., 100, 189-197.
Purkayastha J. et al., 2010. Efficient in vitro plant regeneration from shoot apices and gene transfer by particle bombardment in Jatropha curcas. Biol. Plant., 54(1), 13-20.
Raemakers C.J.J.M., Jacobsen E. & Visser R.G.F., 1995. Secondary somatic embryogenesis and applications in plant breeding. Euphytica, 81, 93-107.
Ripley K.P. & Preece J.E., 1986. Micropropagation of Euphorbia lathyris L. Plant Cell Tissue Organ Cult., 5, 213-218.
Sarika S. & Meenakshi B., 2009. Algal filtrate: a low cost substitute to synthetic growth regulators for direct organogenesis of embryo culture in Jatropha curcas (Ratanjyot). Acta Physiol. Plant., 31, 1205-1212.
Schween G. & Schwenkel H.G., 2003. Effect of genotype on callus induction, shoot regeneration, and phenotypic stability of regenerated plants in greenhouse of Primula ssp. Plant Cell Tissue Organ Cult., 72, 53-61.
Singh R.A., Kumar M. & Ekhlaq H., 2007. Synergistic cropping of summer groundnut with Jatropha curcas. A new two-tier cropping system for Uttar Pradesh. J. SAT Agric. Res., 5(1), www.icrisat.org/Journal/volume5/Groundnut/gn9.pdf, (15/10/2009).
Singh R.A., Reddy M.P., Chikara J. & Singh S., 2010. A simple regeneration protocol from stem explants of Jatropha curcas - A biodiesel plant. Ind. Crops Prod., 31, 209-213.
Sujatha M. & Mukta N., 1996. Morphogenesis and plant regeneration from tissue culture of Jatropha curcas. Plant Cell Tissue Organ Cult., 44, 135-141.
Sujatha M. & Reddy T.P., 2000. Morphogenic responses of Jatropha integerrima explants to cytokinins. Biologia, 55, 99-104.
Sujatha M., Makkar H.P.S. & Becker K., 2005. Shoot bud proliferation from axillary nodes and leaf sections of non-toxic Jatropha curcas L. Plant Growth Regul., 47, 83-90.
Sujatha G. & Kumari R.B.D., 2007. High-frequency shoots multiplication in Artemisia vulgaris L. using Thidiazuron. Plant Biotechnol. Rep., 1, 149-154.
Takeda Y., 1982. Development study on Jatropha curcas (sabu dum) oil as a substitute for diesel engine oil in Thailand. J. Agric. Assoc. China, 120, 1-8.
Tideman J. & Hawker J.S., 1982. In vitro propagation of latex producing plants. Ann. Bot., 49, 273-279.
Wei Q. et al., 2004. Plant regeneration from epicotyl explants. J. Plant Physiol. Mol. Biol., 49, 475-478.
Pour citer cet article
A propos de : Medza Mvé Samson Daudet
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : medzamve@yahoo.fr
A propos de : Guy Mergeai
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Jean-Pierre Baudoin
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : André Toussaint
Univ. Liège-Gembloux Agro-Bio Tech. Unité de Phytotechnie tropicale et Horticulture. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






