- Accueil
- Volume 11 (2007)
- numéro 3
- Régénération in vitro du Scorpiurus muricatus ssp. subvillosus via la caulogenèse
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Régénération in vitro du Scorpiurus muricatus ssp. subvillosus via la caulogenèse

Notes de la rédaction
Reçu le 7 septembre 2006, accepté le 3 mai 2007.
Résumé
La présente étude nous a permis de régénérer avec succès des plantes de Scorpiurus muricatus ssp. subvillosus à partir de bourgeons adventifs néoformés (caulogenèse). Deux principaux facteurs, connus pour leur influence sur ce processus, ont été testés. Il s’agit notamment de la nature des explants et de la composition hormonale du milieu d’induction. Pour les explants, ce sont les hypocotyles qui expriment, en termes de rendement, les meilleures réponses à la caulogenèse, suivis de loin par les cotylédons. Les racines se sont montrées récalcitrantes. Concernant la composition hormonale du milieu d’induction, ce sont les milieux pourvus de l’acide 2,4-dichlorophénoxyacétique (2,4-D) à la dose de 0,1 mg.l-1 et de la 6-benzyladénine (BA) aux doses de 3 mg.l-1 (M2) et de 1 mg.l-1 (M1) qui ont manifesté les meilleurs pouvoirs inducteurs à l’égard de la caulogenèse. De même, la combinaison hormonale établie entre l’acide naphtalène acétique (ANA) et la kinétine (KN), tous deux à la dose de 0,5 mg.l-1 (M11), a conduit à des rendements satisfaisants. L’interaction entre la nature des explants et la composition hormonale du milieu d’induction influence également de manière significative la caulogenèse.
Abstract
In vitro regeneration of Scorpiurus muricatus ssp. subvillosus via caulogenesis. The present study enabled us to successfully regenerate plants of Scorpiurus muricatus ssp. subvillosus from neoformed adventitious buds (caulogenesis). Two principal factors, known for their influence on this process, were tested. It particularly concerns the nature of explants and the hormonal composition of the induction medium. For the explants, the hypocotyls show the best answers of caulogenesis, in term of yield, followed by far by the cotyledons. The roots were recalcitrant. Concerning the hormonal composition of the induction medium, they are the mediums containing 0,1 mg.l-1 of 2,4-dichlorophenoxyacetic acid (2,4-D) and 3 mg.l-1 (M2) and 1 mg.l-1 (M1) of 6-benzyladenine (BA) which expressed the best inductive capacities of caulogenesis. In the same way, the combination established between naphthalene acetic acid (NAA) and kinetin (KN), both at 0,5 mg.l-1, led to satisfactory yield. The interaction between the nature of the explants and the hormonal composition of the induction medium also significantly influences the caulogenesis.
Table des matières
1. Introduction
1L’Algérie, à l’instar des pays du bassin méditerranéen, est très riche en ressources phytogénétiques à intérêt fourrager et pastoral. Le déficit fourrager que connaît ce pays est chronique et l’alimentation du cheptel repose essentiellement sur ces ressources fourragères et/ou pastorales provenant des milieux naturels (parcours, maquis, jachères, etc.) (Abdelguerfi, 2001 ; Abdelguerfi, Laouar, 2004b). Malheureusement, ces ressources restent peu étudiées et sous exploitées, alors qu’elles ont servi, dans d’autres pays, à enrichir de nombreuses banques de gènes internationales et à développer de nombreux cultivars dignes d’intérêt (Abdelguerfi, Laouar, 2004a).
2Le germplasme actuellement disponible en Algérie pour les fourrages n’est que de deux types : amélioré mais non adapté ou adapté mais non amélioré. L’obtention de variétés fourragères dotées à la fois d’une haute capacité d’adaptation et d’une grande productivité demeure le rêve à la fois du sélectionneur et de l’agriculteur. La préservation des ressources fourragères spontanées constitue une base génétique très précieuse devant servir dans des programmes d’amélioration et une voie très prometteuse pouvant conduire à l’obtention de telles variétés.
3Les légumineuses occupent une place très importante parmi les espèces spontanées fourragères composant la flore algérienne. Le Scorpiurus en fait partie. C’est un genre qui possède d’énormes qualités et fait actuellement l’objet de nombreuses études (Abdelguerfi, 2001 ; Hamdani, 2001 ; Abdelguerfi, Laouar, 2004a ; Khouatmiani, 2004 ; M’hammedi Bouzina et al., 2005). Selon M’hammedi Bouzina (1992), les espèces du genre Scorpiurus L., très recherchées par le cheptel, jouent un rôle important dans l’amélioration des parcours et concourent au maintien de la fertilité des sols. à cela s’ajoute aussi la qualité nutritive de ces graines.
4Le Scorpiurus est aussi une plante qui a ses inconvénients, à l’exemple de la dureté de ces graines (entraînant souvent une dormance de type tégumentaire) (M’hammedi Bouzina, Abdelguerfi, 1992 ; Khouatmiani, 2004) ou des difficultés qu’elle présente pour obtenir des hybrides issus de croisements inter-spécifiques (Dominguez, Galliano, 1974).
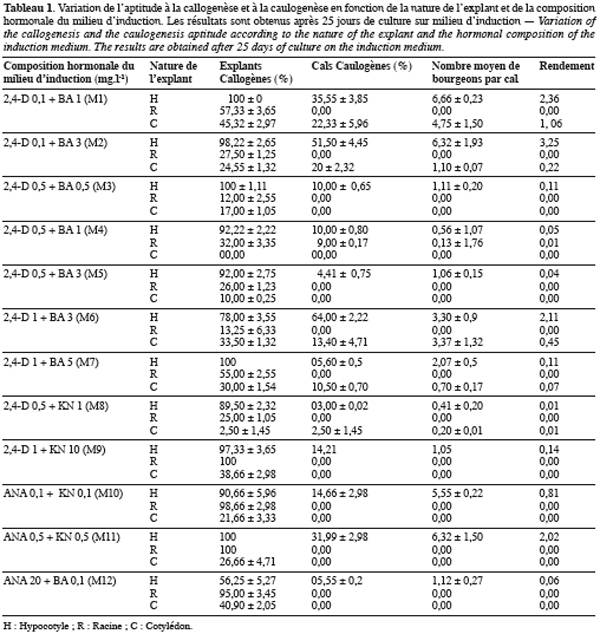
5Pour valoriser cette espèce, un travail d’amélioration et de sélection s’impose. La maîtrise de la technique de régénération in vitro de l’espèce Scorpiurus constitue un premier pas vers l’élaboration d’un tel projet. Il s’agit en fait d’une technique qui vient en amont par rapport au travail des améliorateurs et qui doit être intégrée dans un schéma général de sélection.
6Le présent travail s’inscrit dans cette perspective et entre dans le cadre d’un projet de recherche visant la régénération de plantes entières de Scorpiurus via l’organogenèse et/ou l’embryogenèse somatique. à notre connaissance, aucun travail portant sur la régénération in vitro du Scorpiurus n’a été publié jusqu’à cette date. L’étude proposée consiste à tester l’effet de trois types d’explants (cotylédons, hypocotyles et racines) et de différentes compositions hormonales du milieu d’induction sur la caulogenèse. L’expérience est conduite avec le génotype Scorpiurus muricatus ssp. subvillosus.
2. Matériel et méthodes
2.1. Matériel végétal
7Les explants utilisés, lors de cette étude, ont été obtenus à partir du génotype Scorpiurus muricatus ssp. subvillosus, appelé B6 ; génotype choisi au hasard. Les semences nous ont été fournies par Monsieur M’hammedi Bouzina M., enseignant chercheur, au département d’agronomie, de l’Université Hassiba Benbouali de Chlef.
2.2. Obtention de plantules mères et prélèvement des explants
8Les graines de Scorpiurus, comme celles de la majorité des légumineuses, présentent des difficultés de germination. Cela est dû principalement à une inhibition de type tégumentaire (téguments des graines très durs) qui empêche leur imbibition et par voie de conséquence leur germination. Pour y remédier, nous étions amenés à recourir à la scarification des graines. Il suffit pour cela, de les frotter sur du papier de verre, en se servant d’une pince métallique, afin de provoquer des lésions au niveau des téguments. Après scarification, désinfection dans une solution contenant 7 % d’hypochlorite de sodium et 4 % d’un savon liquide « Isis » (l’équivalent du Domestos) pendant 25 minutes et plusieurs rinçages à l’eau stérile, les graines sont mises à germer sur un milieu stérile composé d’eau distillée et 0,7 % d’agar (Difco-Bacto, Sigma). La germination se déroule à l’obscurité et à une température de 23±2 °C. Les plantules étiolées obtenues, après 8 jours de germination, servent à prélever les explants de cotylédons, d’hypocotyles et de racines. Chaque explant prélevé est découpé en petits fragments de 0,5 cm de longueur, puis ensemencé dans des boites de Pétri contenant les divers milieux de culture à tester.
2.3. Techniques de culture
9Choix et stérilisation des milieux. Les milieux de culture utilisés lors de cette étude sont composés des sels minéraux MS de Murashige & Skoog (1962), des vitamines MS, de saccharose (3 %) et d’agar (Difco-Bacto) (0,7 %). Ils ne différent, entre eux, que par la composition hormonale.
10Les régulateurs de croissance utilisés sont des auxines et des cytokinines. Ils sont apportés seuls ou en combinaison dans les milieux de culture. Les auxines utilisées sont : l’acide a-naphtalène acétique (ANA, Sigma), l’acide indole-3-acétique (AIA, Sigma) et l’acide 2,4-dichlorophénoxyacétique (2,4-D, Sigma). Les cytokinines sont représentées par la 6-benzyladénine (BA, Sigma) et la kinétine (KN, Sigma).
11Avant la stérilisation des milieux, le pH est ajusté à 5,8 avec une solution de NaOH 1N. La stérilisation se fait à l’autoclave à une température de 120 °C et à une pression équivalente à 2 bars pendant 20 minutes. Les milieux, une fois stérilisés, sont répartis en fractions de 16 ml dans des boites de Pétri stériles.
12Conduite des cultures. Après l’ensemencement, les boites de Pétri sont exposées dans une chambre de culture, sous une température de 23±2 °C et à une photopériode de 16/8. L’éclairage de 50 µmol.m-2.s-1 fourni par des tubes fluorescents Mazda Fluor, lumière du jour. Ces conditions sont maintenues durant toutes les phases de culture (induction, développement et enracinement).
13Souvent, après l’apparition de bourgeons adventifs, les cals caulogènes sont transférés sur un milieu dit de développement (milieu similaire au milieu d’induction mais dépourvu d’hormone). Après une exposition de 1 à 4 semaines, sur ce milieu, les bourgeons ayant poussé en tigelle sont transférés sur un milieu dit d’enracinement. Ce milieu est composé des sels minéraux MS, dilués à moitié, des vitamines MS, de l’AIA à 0,5 mg.l-1, d’hydrolysat de caséine à 1 g.l-1, de saccharose à 2 % et d’agar (Difco-Bacto) à 0,6 %.
14Le nombre total d’explants mis en culture par traitement est de 40. Chaque boite de Pétri, qui représente en fait une répétition, comprend en moyenne 10 explants.
15Suivi des cultures et expression des résultats. L’apparition des bourgeons sur les cals est suivie périodiquement, ce qui permet de calculer, pour chaque boite (répétition), le pourcentage (%) de cals caulogènes (rapport du nombre de cals portant au moins un bourgeon sur le nombre total des cals examinés). Le pourcentage moyen de cals caulogènes, ainsi que l’écart type, sont calculés. Le relevé du nombre de bourgeons néoformés par cal permet de calculer le nombre moyen de bourgeons par cal caulogène, ainsi que l’écart type. Le rendement correspond au produit du pourcentage moyen de cals caulogènes par le nombre moyen de bourgeons adventifs par cal caulogène.
2.4. Analyse des données
16Partant des rendements calculés, nous avons procédé à l’analyse de variance des deux facteurs : nature de l’explant et composition hormonale du milieu d’induction, ainsi que de leur interaction. Les comparaisons de moyennes sont réalisées au moyen du test de Tukey’s HSD (Honest Significant Difference), pour son efficacité, au seuil de confiance a=5 %.
3. Résultats et discussions
17L’objectif global de cette étude ambitionne de parvenir à régénérer des plantes entières de Scorpiurus muricatus ssp. subvillosus, via l’organogenèse et/ou l’embryogenèse somatique. Suite aux résultats des essais préliminaires, lancés sur le sujet, nous avons axé notre étude beaucoup plus sur la voie de régénération par caulogenèse que par embryogenèse somatique. Par caulogenèse, nous désignons la néoformation de bourgeons soit directement sur l’explant, soit indirectement sur un cal.
18Deux principaux facteurs, connus pour leurs influences sur la caulogenèse, ont été testés. Il s’agit de la nature de l’explant (cotylédon, hypocotyle et racine) et de la composition hormonale du milieu d’induction.
19Dans le tableau 1, nous avons rapporté uniquement les résultats des milieux dont la composition hormonale avait permis une induction de bourgeons sur au moins un type d’explant. Au vu des résultats présentés dans ce tableau, il apparaît que l’obtention de bourgeons adventifs néoformés est possible chez l’espèce Scorpiurus muricatus ssp. subvillosus et qu’elle est tributaire à la fois de la nature de l’explant et de la composition hormonale du milieu de culture.
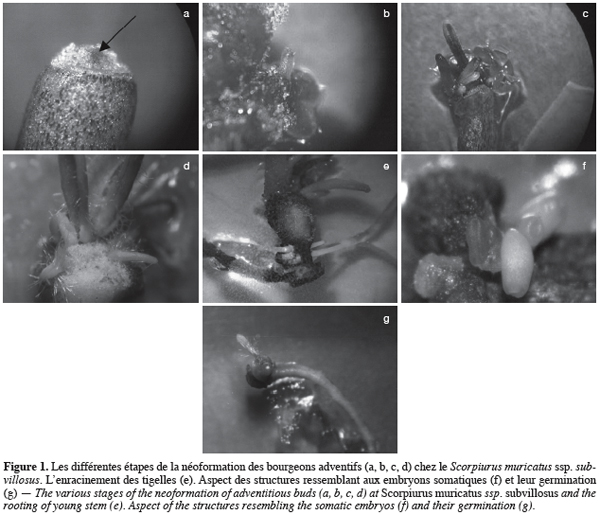
20Les bourgeons néoformés proviennent, dans leur quasi totalité, de cals (caulogenèse indirecte). Généralement, ces cals apparaissent sur les explants après une semaine de culture. Ils prennent des aspects variables : compacts, friables, de coloration verdâtre et parfois jaunâtre. Et ce n’est qu’à partir du 15e jour de culture que les premières ébauches foliaires (primordias foliaires) se différencient à partir des structures nodulaires méristèmatiques formées à la surface des cals (Figure 1a et b). Vers le 25e jour, les bourgeons continuent leur développement et finissent par envahir entièrement les cals nourriciers (Figure 1c et d). Une fois que les bourgeons se développent en petites tigelles, ils sont transférés sur un milieu d’enracinement afin d’obtenir une plante entière (Figure 1e).
3.1. Effet de la nature des explants sur l’aptitude à la caulogenèse
21La nature de l’explant est l’un des facteurs déterminants du processus de la caulogenèse. L’analyse de la variance a confirmé que ce facteur affecte de manière significative (P≤0,0001) le rendement de la caulogenèse. Les résultats du tableau 1 montrent que les trois explants testés réagissent positivement à la caulogenèse, mais à des degrés très variés.
22à une exception près, ce sont les hypocotyles qui répondent le mieux à la caulogenèse et donnent les meilleurs résultats, selon le test de Tukey’s. En effet, avec ce type d’explant le rendement a pu atteindre un maximum de 3,25 sur le milieu M2 (0,1 mg.l-1 2,4-D+3 mg.l-1 BA) contre 1,06 pour les cotylédons sur le milieu M1 (0,1 mg.l-1 2,4-D+1 mg.l-1 BA). De même, en de pourcentage de cals caulogènes, les résultats sont meilleurs avec les hypocotyles (pour lesquels on observe un maximum de 64 % sur le milieu M6 (1 mg.l-1 2,4-D+3 mg.l-1 BA)) qu’avec les deux autres types d’explants.
23Notons par ailleurs que les bonnes aptitudes à la régénération des explants d’hypocotyles ne se sont pas limitées uniquement à produire des bourgeons néoformés, mais qu’elles se sont aussi parfois exprimées en donnant des structures ressemblant aux embryons somatiques (Figure 1f). Ces structures, prenant l’aspect d’une bouteille, naissent directement sur l’explant sans passer par une phase cal. Une fois transférées sur milieu dépourvu d’hormones, ces structures germent et se développent en plantes entières (Figure 1g). Le rendement en ce type d’embryons produit et leur taux de conversion restent cependant très faibles (résultats non présentés).
24La caulogenèse s’est exprimée aussi avec les cotylédons, mais son intensité parait moins prononcée qu’avec les hypocotyles. Les rendements enregistrés avec ce type d’explants oscillent entre 0 et 1,06.
25Quand aux racines, malgré la forte callogenèse qu’elles peuvent fournir, elles paraissent plus rétives à l’égard de la caulogène que les autres types d’explants. En effet, sur l’ensemble des milieux testés, elles ne se sont exprimées qu’une seule fois (milieu M4) en enregistrant un rendement très faible de l’ordre de 0,01.
26Avec les racines, même la réalisation de certaines opérations comme le transfert des cals sur des milieux appauvris ou totalement dépourvus d’auxine ou le prolongement de la durée d’exposition des cals sur le milieu d’induction et de développement, se révèlent inefficaces pour déclencher la caulogenèse.
3.2. Effet de la composition hormonale du milieu sur l’aptitude à la caulogenèse
27à la lecture des résultats (Tableau 1), il apparaît que les réponses à la caulogenèse varient, pour un même explant, d’un milieu de culture à un autre. L’analyse de la variance a révélé que la composition hormonale du milieu influence significativement (P≤0,0001) le rendement de la caulogenèse.
28Le test de Tukey’s nous a conduit à distinguer trois classes de milieux.
29La première, regroupant les milieux pourvus de 2,4-D à la dose de 0,1 mg.l-1 et de BA aux doses de 3 mg.l-1 (M2) et de 1 mg.l-1 (M1), qui ont permis d’obtenir les meilleurs rendements (3,25 et 2,36).
30La seconde classe, représentée respectivement par les milieux M6 (1 mg.l-1 2,4-D+3 mg.l-1 BA) et M11 (0,5 mg.l-1 ANA+0,5 mg.l-1 KN), a conduit à des rendements intermédiaires de 2,11 et 2,02.
31Et enfin, la troisième et dernière classe renferme le reste des milieux où les rendements enregistrés ont été faibles à nuls.
32Par ailleurs, nous avons observé (résultats non présentés) que l’emploi seul des auxines ou des cytokinines dans le milieu d’induction n’apporte aucun effet notable sur la caulogenèse. Les milieux pourvus d’auxines seules déclenchent souvent la callogenèse sans qu’il y ait développement de bourgeons adventifs néoformés. Même le transfert de ces cals sur des milieux de développement (milieux sans hormones ou contenant uniquement des cytokinines) demeure inutile et ne conduit à aucun changement.
3.3. Effet de l’interaction « nature de l’explant » –« composition hormonale du milieu »
33L’analyse de la variance a révélé l’existence d’un effet significatif de l’interaction explant-milieu (P≤0,0001) sur le rendement de la caulogenèse. Les meilleures interactions, selon le test de Tukey’s, sont celles qui impliquent les hypocotyles comme source d’explant et les milieux M2, M1, M6 et M11 (Tableau 1). Le milieu M1 réagit aussi favorablement avec les explants de cotylédons.
3.4. Discussion
34Les résultats de cette étude nous ont permis de confirmer que la régénération in vitro de l’espèce Scorpiurus vermiculatus ssp. subvillosus via la caulogenèse est possible. L’influence de la nature des explants et de la composition hormonale des milieux d’induction sur ce processus morphogénétique est considérable. En effet, s’agissant de l’influence des explants, ce sont les hypocotyles qui présentent les meilleures aptitudes à la caulogenèse suivis de loin par les cotylédons. Les bonnes potentialités caulogènes que possèdent les hypocotyles et, à moindre degré les cotylédons, ont été signalées auparavant sur le Scorpiurus par Hamdani (2001). Les segments d’hypocotyles ont été également utilisés avec succès dans la régénération du pois par caulogenèse (Malmberg, 1979).
35Les cotylédons prélevés d’embryons zygotiques mûrs qui, dans notre étude, se sont montré moins performants, se révèlent efficaces avec d’autres légumineuses comme le pois (Atanassov, Mehandjier, 1979). Il serait judicieux de reprendre l’expérience en utilisant les cotylédons d’embryons zygotiques immatures qui pourraient répondre mieux et apporter des résultats plus probants. L’utilisation d’embryons zygotiques immatures entiers (ou des parties d’embryons) est en effet recommandée par de nombreuses études sur pois (Nadolska, Orczyk et al., 1994), soja (Tetu, 1989) et trèfles (Keyton, Wayne, 1993).
36La composition hormonale du milieu s’est, elle aussi, imposée comme facteur pouvant influencer fortement la caulogenèse. Dans notre étude, l’usage de certaines combinaisons entre 2,4-D et BA s’est révélé très inducteur. Certains mélanges réalisés entre ANA et KN ou BA peuvent également conduire à la caulogenèse. Les mêmes observations ont été faites par Hamdani (2001) et Amari et Taleb (2004), sur le Scorpiurus. Aussi, nous avons constaté que le milieu ayant servi à l’induction permet également un développement, quoique limité, des bourgeons adventifs néoformés. Les milieux qui permettent à la fois l’induction et le développement des bourgeons ont été signalés par d’autres auteurs sur luzerne (Walker et al., 1979) et trèfles (Phillips, Collins, 1979). Néanmoins, les transferts des bourgeons néoformés sur des milieux de développement (milieux sans hormones) restent très utiles pour garantir un bon développement des tiges.
4. Conclusion
37Cette étude nous a permis, tout d’abord, d’atteindre l’objectif principal que nous nous étions fixé au départ, à savoir la possibilité de régénérer in vitro de plantes entières de Scorpiurus muricatus ssp. subvillosus via la caulogenèse. Elle nous a permis de connaître l’effet que peuvent avoir la nature des explants et la composition hormonale des milieux d’induction sur ce processus organogénétique. Les hypocotyles et à moindre degré les cotylédons constituent des explants à bonnes aptitudes organogènes. Les compositions hormonales les plus adéquates pour l’induction sont, dans leur majorité, constituées d’un mélange 2,4-D-BA. Il serait intéressant de tester le potentiel d’autres explants comme : les embryons immatures, les apex, les feuilles immatures, etc. et d’autres hormones telles : le Picloram, le 4 CPA, le 2, 4, 5 T, le Dicamba, etc. en vue d’optimiser les rendements en bourgeons adventifs néoformés ou d’explorer de nouvelles pistes comme celle de l’embryogenèse somatique qui reste possible et très prometteuse.
Bibliographie
Abdelguerfi A. (2001). Ressources génétiques d’intérêt pastoral et/ou fourrager : distribution et variabilité chez les légumineuses spontanées (Médicago, Trifolium, Scorpiurus, Hedysarum et Onobrychis) en Algérie. Thèse d’état en Sciences agronomiques. El-Harrach, Algérie : Institut National Agronomique, 433 p.
Abdelguerfi A., Laouar A. (2004a). Les ressources génétiques d’intérêt fourrager et/ou pastoral : Diversité, collecte et valorisation au niveau méditerranéen. Cah. Options Méditerr. 62, p. 29–41.
Abdelguerfi A., Laouar A. (2004b). Répartition de la fétuque, du dactyle et de Lolium en fonction de quelques facteurs du milieu, en Algérie. Cah. Options Méditerr. 62, p. 43–46.
Amari A., Taleb K. (2004). Effet de la composition hormonale du milieu sur la caulogenèse chez le Scorpiurus. Mémoire d’ingéniorat. Chlef, Algérie : Université Hassiba Benbouali, 35 p.
Atanassov AI., Mehandjier AD. (1979). In vitro induced morphogenesis in pea. R. Acad. Bulg. Sci. 32, p. 115–118.
Dominguez E., Galiano EF. (1974). Revision Del genro Scorpiurus I partie experimental. Langaxalia 4 (1), p. 61–84.
Hamdani FZ. (2001). Essai de régénération de plantes entières chez le Scorpiurus via l’organogenèse et l’embryogenèse somatique. Thèse de magister. Chlef, Algérie : Université Hassiba Benbouali, 197 p.
Malmberg RL. (1979). Regeneration of whole plants from callus cultures of diverse lines of Pisum sativum L. Planta 146, p. 243–244.
M’hammedi Bouzina M. (1992). Contribution à l’étude des graines de quelques légumineuses fourragères en Algérie. Thèse de magister. El-Harrach, Algérie : Institut National Agronomique, 105 p.
M’hammedi Bouzina M., Abdelguerfi A. (1992). Caractérisation de la dureté des graines chez quelques espèces spontanées de trois genres de légumineuses en Algérie. Complexes d’espèces, flux de gènes et ressources génétiques des plantes. Colloque International en hommage à Jean Pernes, p. 662–663.
M’hammedi Bouzina M., Abdelguerfi-Laouar M., Abdelguerfi A., Guittonneau GG. (2005). Autoécologie et distribution du complexe d’espèces Scorpiurus muricatus (S. sulcatus – S. subvillosus) en Algérie. Acta Bot. Gallica 152 (1), p. 11–23.
Murashige T., Skoog F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, p. 473–497.
Nadolska-Orczyk A., Milowska L., Orczyk W. (1994). Two ways of plant regeneration from immature cotyledons of pea. Acta Soc. Bot. Pol. 63 (2), p. 153–157.
Keyton WA., Wayne AP. (1993). Repetitive somatic embryogenesis and plant recovery in white clover. Plant Cell Rep. 12, p. 125–128.
Khouatmiani K. (2004). Contribution à l’étude de la variabilité et de l’héritabilité des caractères des gousses, des graines et de la germinanation chez le genre Scorpiurus. Thèse de magister. Chlef, Algérie : Université Hassiba Benbouali, 105 p.
Phillips GC., Collins GB. (1979). In vitro tissue culture of delected legumes and plant regeneration from callus cultures of red clover. Crop Sci. 19, p. 59–62.
Tetu T. (1989). Régénération de plantes in vitro par organogenèse et embryogenèse somatique chez la betterave sucrière, le pois et le soja. études physiologiques, morphologiques, anatomiques et ultrastructurales. Thèse de doctorat. Paris : Université de Paris VI, 138 p.
Walker KA., Wendeln ML., Jaworski EC. (1979). Organogenesis in callus tissue of Medicago sativa L. The temporal separation of induction processes from differentiation processes. Plant Sci. Lett. 16, p. 23–30.
Pour citer cet article
A propos de : Abdelkader Saadi
Laboratoire de Biotechnologie végétale. Département de Biologie. Faculté des Sciences agronomiques et des Sciences biologiques. Université Hassiba Ben Bouali. Route de Sendjas. BP 151, Chlef (Algerie). E-mail : aeksaadi@voila.fr, saadiaek@yahoo.fr
A propos de : Fatma-Zohra Hamdani
Laboratoire de Biotechnologie végétale. Département de Biologie. Faculté des Sciences agronomiques et des Sciences biologiques. Université Hassiba Ben Bouali. Route de Sendjas. BP 151, Chlef (Algerie).






