- Accueil
- volume 16 (2012)
- numéro 1
- Les entérocoques : avantages et inconvénients en biotechnologie (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Les entérocoques : avantages et inconvénients en biotechnologie (synthèse bibliographique)

Notes de la rédaction
Reçu le 29 octobre 2010, accepté le 7 octobre 2011
Résumé
Les entérocoques sont des bactéries lactiques utilisées depuis des siècles dans la transformation des aliments. Ces micro-organismes jouent un rôle essentiel dans la conservation (prolongation du temps de stockage) et dans la qualité bactériologique des aliments, tout en respectant leurs propriétés nutritionnelles et organoleptiques. Cependant, ce sont des marqueurs de contamination fécale (Enteroccus faecalis et Enterococcus faecium) également impliqués dans l'apparition de maladies nocosomiales. La plasticité génétique (transfert d'éléments génétiques) de ces bactéries leur permet, d'une part de s'adapter à de nombreux écosystèmes et, d'autre part, d'être vecteurs d'antibiorésistance et de virulence bactérienne. Par conséquent, l'emploi des entérocoques dans l'industrie alimentaire est de plus en plus controversé. Impliqués dans la fermentation de nombreux aliments (lait, végétaux, viandes et poissons), les entérocoques sont capables de produire diverses molécules antimicrobiennes (acide lactique, bactériocine ou encore peroxyde d'hydrogène). Ces propriétés les rendent indispensables à l'industrie agro-alimentaire. Employés comme micro-organismes de protection, ils doivent être minutieusement caractérisés et faire l'objet d'études préalables pour démontrer leur innocuité. La grande diversité des bactériocines (entérocines) retrouvées dans ce genre bactérien pourrait être valorisée en développant des méthodes de purification qui permettraient de substituer l'utilisation de ces souches par l'emploi d'entérocines sur les matrices alimentaires.
Abstract
Enterococci: advantages and drawbacks in biotechnology, a review. Enterococci are lactic acid bacteria that have been used for centuries in food processing. These microorganisms play a vital role in conservation (extension of shelf life) and in the bacteriological quality of food while keeping their nutritional and organoleptic properties. However, Enterococcus faecium and Enterococcus faecalis are indicators of faecal contamination and are also implicated in nosocomial diseases. The genetic plasticity (transfer of genetic elements) of these bacteria allows them not only to adapt to various ecosystems, but also to be vehicles of antibiotic resistances and bacterial virulence, which is of public health concern. Thus, the use of enterococci in the food industry is becoming controversial. However, enterococci are also involved in the fermentation of many foods (milk, vegetables, meats or fish) and are able to produce various antimicrobial molecules (e.g. lactic acid, bacteriocins or hydrogen peroxide) that make them indispensable in the food industry. Their use as probiotic must therefore be carefully characterized in order to prove their safety. The wide range of bacteriocins (enterocins) found in these bacteria could also be valorized by developing purification methods to replace the bacterial strains themselves by their enterocins in foodstuffs, therefore eliminating the risk of direct use of bacteria.
Table des matières
1. Introduction
1Les bactéries lactiques jouent un rôle fondamental dans la conservation des aliments en raison d'une part, de leur pouvoir acidifiant (acide lactique) qui inhibe la croissance de la plupart des germes non lactiques et, d'autre part, grâce à leur capacité de produire d'autres substances antimicrobiennes comme les bactériocines. Les bactéries lactiques sont employées traditionnellement dans la fermentation de végétaux, de produits laitiers ou carnés et en panification.
2Les Enterococcus sont des bactéries lactiques, ubiquitaires, trouvées fréquemment dans la flore microbienne du tractus gastro-intestinal des animaux à sang chaud, ainsi que dans une variété de produits alimentaires. Ils sont utilisés dans les aliments soit comme agents antimicrobiens, soit pour leurs propriétés organoleptiques et parfois comme probiotiques. Ce genre bactérien produit une grande diversité de bactériocines, considérées comme des agents de contrôle biologique dans les aliments, en conservant leurs propriétés organoleptiques et nutritionnelles. Elles constituent ainsi une alternative à l'utilisation d'additifs chimiques ou à celle de traitements physico-chimiques employés dans la conservation des produits alimentaires. De plus, les bactériocines présentent l'avantage d'être rapidement digérées par des protéases du tractus digestif humain (Chen et al., 2003) sans produire de substances secondaires toxiques. Les bactériocines peuvent également trouver des applications dans le secteur médical (Turcotte et al., 2004) ou elles peuvent être utilisées comme agents antimicrobiens dans l'industrie pharmaceutique (Folli et al., 2003). Les entérocines (bactériocines des entérocoques) ont une importance bactériologique en raison de leur capacité à inhiber la croissance de Listeria spp. qui engendre le taux le plus élevé de mortalité (20 - 30 %) en comparaison avec d'autres micro-organismes pathogènes transmis par des aliments (FAO/OMS, 2004).
3Cette revue porte sur la nature ambigüe des entérocoques pour la santé de l'homme, sur leurs bienfaits sanitaires ainsi que sur leur utilisation comme alternative aux produits chimiques dans le secteur agro-alimentaire.
2. Les Enterococcus
2.1. Phylogenèse
4Dans les années 1930, et sur base du système Lancefield Serological Typing, les Enterococcus étaient classés dans le genre Streptococcus (groupe D), comme d'autres bactéries lactiques du genre Lactococcus et Vagococcus. Avec l'avènement de la biologie moléculaire et de nouvelles techniques telles que la détermination du pourcentage G+C, le séquençage de l'ARNr 16S et l'hybridation DNA-DNA, Schleifer et al. (1984) ont reclassé les bactéries Streptococcus faecium et Streptococcus faecalis comme Enterococcus faecium et Enterococcus faecalis, respectivement.
5Le genre Enterococcus est placé dans le domaine des Bacteria, le phylum des Firmicutes, classe des Bacilli, ordre des Lactobacillales, famille des Enterococcaceae, branche des Clostridium. Monstein et al. (1998) ont proposé de subdiviser le genre Enterococcus en groupes d'espèces. Actuellement, 35 espèces différentes ont été recensées sur la base de l'analyse de l'ARNr 16S et les groupes suivants peuvent être distingués :
6– le groupe E. avium : E. avium, E. devriesei, E. gilvus, E. hermanniensis, E. malodoratus, E. pallens, E. pseudoavium et E. raffinosus ;
7– le groupe E. cecorum : E. cecorum et E. columbae ;
8– le groupe E. dispar : E. asini, E. canintestini et E. dispar ;
9– le groupe E. faecalis : E. caccae, E. faecalis, E. haemoperoxidus, E. moraviensis, E. silesiacus et E. termitis ;
10– le groupe E. faecium : E. canis, E. durans, E. faecium, E. hirae, E. mundtii, E. phoeniculicola, E. ratti, E. thailandicus et E. villorum ;
11– le groupe E. gallinarum : E. casseliflavus et E. gallinarum ;
12– le groupe E. saccharolyticus : E. aquimarinus, E. camelliae, E. italicus, E. saccharolyticus et E. sulfureus.
13Quelques espèces appartenant au genre Enterococcus ont été reclassées. Ainsi, E. porcinus a été reclassé comme E. villorum (De Graef et al., 2003), E. flavescens comme E. casseliflavus et E. saccharominimus comme E. italicus (Naser et al., 2006). Par ailleurs, quelques bactéries ont changé de genre, E. seriolicida a été classé comme Lactococcus garvieae (Eldar et al., 1996), alors que E. solitarius est devenu Tetragenococcus solitarius (Ennahar et al., 2005).
2.2. Caractéristiques
14Les Enterococcus sont des coccoïdes Gram+ oxydase positifs, généralement catalase négatifs. Certaines espèces présentent une activité pseudo-catalase. Ils sont généralement des anaérobies facultatifs et non mobiles. Les cellules sont ovoïdes et se présentent sous forme de cellules isolées, par paire ou encore sous forme de chainette (Schleifer et al., 1984). Généralement, les entérocoques produisent des colonies de couleur blanche. Toutefois, quelques-unes sont de couleur jaune comme E. mundtii, E. casseliflavus et E. sulfureus (Higashide et al., 2005). De plus, la majorité des entérocoques sont positifs au test de Voges-Proskauer qui relie la production d'acétone à la fermentation du ribose. Ce test est largement utilisé dans la discrimination entre Enterococcus et Streptococcus.
15Les Enterococcus sont des micro-organismes mésophiles qui se développent dans une gamme de températures allant de 10 à 45 °C, avec une température optimale de 35 °C. Certaines espèces peuvent survivre à 60 °C pendant 30 min. Ils poussent dans des conditions hostiles de 6,5 % de NaCl, de lait renfermant 0,1 % de bleu de méthylène, de concentration en sels biliaires de 40 % et dans une gamme de pH comprise entre 4,4 et 9,6.
16Les Enterococcus sont homofermentaires. Ils produisent essentiellement de l'acide lactique et en quantité moindre, de l'acétate, du formiate et de l'éthanol. Les produits finaux du métabolisme peuvent changer en fonction de la présence ou non d'oxygène ou d'autres accepteurs d'électrons. Ainsi en anaérobiose, le lactate est le principal produit du métabolisme du glucose, tandis qu'en condition d'aérobiose, les produits du métabolisme sont l'acétate et le CO2. Ils sont capables de métaboliser divers types de sucres comme le N-acétyl glucosamine, l'amygdaline, l'arbutine, le cellobiose, le D-fructose, le galactose, le β-gentiobiose, le glucose, le lactose, le maltose, le D-mannose, le β-D-méthyle glucopyranoside, le ribose, la salicine et le tréhalose (Schleifer et al., 1984 ; LeBlanc, 2006).
2.3. Habitat
17Les entérocoques sont de nature ubiquiste, leur capacité d'adaptation à des environnements inhospitaliers permet de les retrouver dans différentes eaux (usées, douces et de mer), dans le sol, sur les végétaux et dans le tractus gastro-intestinal des animaux à sang chaud (y compris celui de l'homme) (Manero et al., 1999). Leur adaptabilité à différents écosystèmes a permis de retrouver trois clones d'E. faecalis et d'E. casseliflavus dans du lait, dans du fromage ou dans des matières fécales humaines (Gelsomino et al., 2002).
18La plupart des espèces du genre Enterococcus font partie intégrante de la flore intestinale de nombreux animaux, leur concentration dans les matières fécales peut varier de 105 à 107 UFC·g-1 (Kayser, 2003). Les entérocoques les plus fréquemment isolés dans les fèces de l'homme sont E. faecalis, E. faecium et E. durans (Murray, 1990 ; Leclerc et al., 1996). Dans la plupart des contenus intestinaux d'animaux (la volaille, les bovins, les porcs, les chiens, les chevaux, les moutons), E. faecalis, E. faecium et E. hirae sont représentés ; par contre, chez les chèvres et les lapins, on ne retrouve que E. faecalis et E. hirae (Devriese et al., 1987). Dans des échantillons provenant de sources environnementales (composts, eaux usées, sédiments et eaux de piscine), il a été démontré que les espèces prédominantes sont E. faecalis (ca. 40 %) et E. faecium (ca. 30 %), suivies de E. durans/E. hirae, E. casseliflavus/E. gallinaru et E. raffinosus, avec une prévalence différente de l'espèce selon la source (Pinto et al., 1999).
19D'autre part, E. mundtii, E. casseliflavus et E. sulfureus sont des bactéries qui ont été isolées d'échantillons végétaux d'ensilage d'herbe (Leclerc et al., 1996). De plus, E. mundtii a été trouvé dans de la chicorée fraiche (Bennik et al., 1998) et des graines de soja (De Kwaadsteniet et al., 2005 ; Todorov et al., 2005 ; Zendo et al., 2005).
3. Applications biotechnologiques des entérocoques
20L'incorporation de micro-organismes à des aliments peut avoir quatre objectifs différents :
21– améliorer la sécurité alimentaire (inhiber des pathogènes),
22– améliorer la stabilité (prolongation de la vie du stockage),
23– offrir une diversité de produits (modification de la matière première),
24– apporter des bénéfices pour la santé (effets positifs sur la flore intestinale).
25Des études de la microflore des produits traditionnels ont montré que les entérocoques jouent un rôle important dans la fermentation et la maturation de certains produits en contribuant au développement des caractéristiques organoleptiques telles que le gout et l'arôme, entre autres. En plus de la contribution sensorielle, les entérocoques ont la capacité de produire des substances antimicrobiennes, y compris les bactériocines. Ils peuvent aussi avoir des propriétés probiotiques. Le tableau 1 présente certains aliments sources d'Enterococcus.
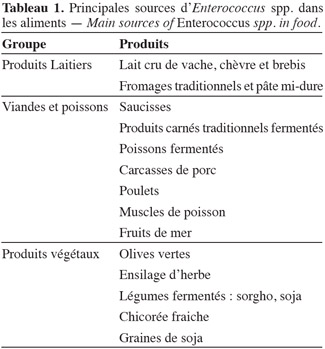
3.1. Les entérocoques dans l'alimentation
26Produits laitiers. Les entérocoques les plus couramment présents dans les fromages sont E. faecium, E. faecalis et E. durans (Giraffa, 2003), aussi bien les fromages à base de lait cru que de lait pasteurisé, provenant de chèvre, de brebis ou de vache ; on retrouve moins souvent E. casseliflavus (Burdychova et al., 2007). Les entérocoques ont un rôle important dans la maturation de plusieurs variétés de fromages, probablement en raison de leur activité protéolytique, lipolytique, de leur capacité de production du diacétyle et d'autres composants volatils contribuant à l'aromatisation, la flaveur et au gout caractéristique (Franz et al., 1999). La concentration d'entérocoques dans les fromages frais se situe entre 104 à 106 UFC·g-1, alors que celle des fromages fermentés est de l'ordre de 105 à 107 UFC·g-1 (Giraffa, 2003).
27Viandes et poissons. Comme indiqué précédemment, les entérocoques appartiennent à la microflore commensale du tractus gastro-intestinal des animaux. De ce fait, il existe de fortes probabilités qu'ils contaminent la viande au cours de l'abattage. E. faecium et E. faecalis sont les espèces prédominantes dans les produits carnés, tandis que E. hirae et E. durans (Franz et al., 2004) s'y retrouvent en moindre proportion. Knudtson et al. (1993) ont dénombré en moyenne entre 104 et 108 UFC d'entérocoques pour 100 cm2 de carcasse de porc après abattage. Dans des échantillons de poulet, Pimenta et al. (2007) ont retrouvé des entérocoques dans les proportions suivantes : E. faecalis (50,9 %) suivi d'E. casseliflavus (26,3 %), d'E. gallinarum (4,2 %) et d'E. gilvus (4,2 %). E. faecium et E. mundtii ont été mis en évidence dans du muscle de turbot par Campos et al., 2006. E. faecium a été aussi retrouvé par Sánchez et al. (2010) dans des poissons et des fruits de mer. E. faecium NKR-5-3 a été isolé dans des poissons fermentés (Wilaipun et al., 2002).
28Au niveau des produits carnés fermentés, Sabia et al. (2004) ont trouvé des souches de E. faecalis IM 388C dans des saucisses italiennes naturellement fermentées, tandis que Barbosa et al. (2010) ont isolé Enterococcus spp. dans des produits à base de viande transformés au Nord du Portugal.
29Légumes fermentés. L'origine de la présence d'entérocoques dans le règne végétal n'est pas clairement définie. Elle peut être endogène comme elle peut résulter d'une contamination environnementale. Dans les olives vertes fraiches, E. faecium et E. faecalis sont des espèces prédominantes, elles sont retrouvées également dans les olives fermentées (Fernández, 1983). Ben Omar et al. (2004) ont signalé que les entérocoques trouvés dans les olives (2,2 x 103 UFC·g-1) sont bien adaptés aux valeurs de pH initial (9,0) et à la concentration en sel de la saumure employée lors de la transformation.
30Dans les alimentations asiatique et africaine, E. faecium et E. faecalis sont généralement liés à la fermentation du sorgho (Hamad et al., 1997 ; Yousif et al., 2005) et du soja (Mulyowidarso et al., 1990 ; Yoon et al., 2008). De même, E. mundtii est retrouvé majoritairement dans le soja (De Kwaadsteniet et al., 2005 ; Todorov et al., 2005 ; Zendo et al., 2005), la chicorée fraiche (Bennik et al., 1998) et dans l'ensilage d'herbe (Kawamoto et al., 2002). Certaines de ces bactéries sont non seulement essentielles à la fermentation de ces aliments, mais elles possèdent également des propriétés technologiques intéressantes comme la dégradation du raffinose et du stachyose, sucres non digestibles, ou encore la production de bactériocines (Yousif et al., 2005).
3.2. Les entérocines (bactériocines des entérocoques)
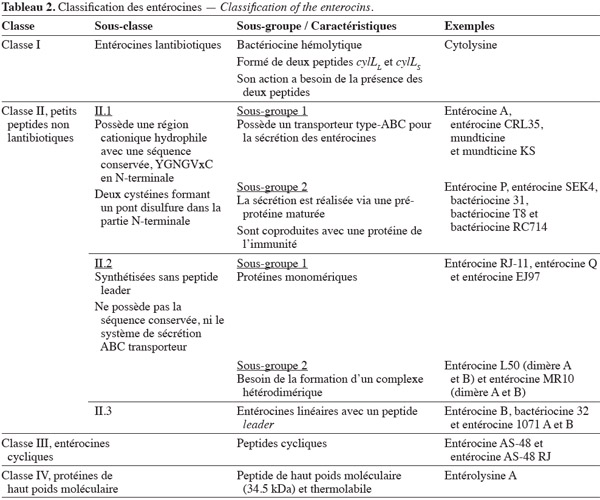
31Le genre Enterococcus produit une grande variété de bactériocines, dénommées entérocines. Ces bactériocines sont des peptides de faibles poids moléculaires constitués de 20 à 60 acides aminés cationiques et amphiphiles. Cependant, le spectre d'activité, le mode d'action, la structure, la thermostabilité et le pH d'activité varient d'un type de bactériocine à l'autre (Van Belkum et al., 2000 ; Chen et al., 2003 ; Dortu et al., 2009). Généralement, les bactériocines sont constituées de deux domaines structuraux : un domaine hydrophile et cationique en position N-terminale (appelé leader double-glycine) dont la longueur minimale est de 14 résidus et qui peut atteindre 30 résidus (Nes et al., 1996) ; la seconde région, en position C-terminale, est hydrophobe et/ou amphiphile (Johnsen et al., 2005).
32Classification des entérocines. Franz et al. (2007) ont proposé une classification des entérocines, sur base de leurs séquences et des modifications post-traductionnelles. Le schéma actuel inclut quatre classes, reprises au tableau 2. La diversité des entérocines est due au nombre important d'espèces d'entérocoques, à leur origine, à leur nature ubiquiste, ainsi qu'à leur potentialité d'acquérir du matériel génétique.
33Les entérocines et leur spectre d'action. Le spectre d'inhibition des Enterococcus a été largement étudié et caractérisé notamment au niveau de la lutte contre Listeria monocytogenes, Staphylococcus spp. et Clostridium spp. (Ghrairi et al., 2008), mais aussi contre des bactéries Gram-, des champignons et des levures. Il a été rapporté que certaines souches d'E. mundtii peuvent inhiber certains virus (virus de l'herpès, de la rougeole et de la poliomyélite) (Wachsman et al., 1999 ; Wachsman et al., 2003 ; Todorov et al., 2005). Ces chercheurs expliquent cet effet sur la propagation du virus HSV (Herpes Simplex Virus) par une inhibition de la synthèse des glycoprotéines (Wachsman et al., 2003). Pour Todorov et al. (2005), le mécanisme impliqué dans l'activité antivirale n'est pas bien connu mais il pourrait y avoir agrégation des particules virales ou blocage de leurs sites récepteurs.
3.3. Utilisation des entérocoques comme probiotiques
34Les probiotiques sont définis comme des préparations de micro-organismes viables en quantités suffisantes qui peuvent moduler la flore de l'organisme hôte, exerçant ainsi des effets bénéfiques pour la santé (FAO/WHO, 2006).
35La plupart des souches utilisées comme probiotiques sont des bactéries lactiques provenant du tractus gastro-intestinal humain. Les bactéries les plus fréquemment rencontrées sont les lactobacilles (Lb. acidophilus, Lb. rhamnosus, Lb. paracasei, Lb. plantarum et Lb. reuteri) et les bifidobactéries (B. lactis, B. bifidum, B. longum, B. adolescentis et B. animalis). Toutefois, il existe maintenant des souches appartenant aux genres Pediococcus, Propionibacterium, Enterococcus, Bacillus, Streptococcus, et même à la levure Saccharomyces, qui montrent des effets bénéfiques pour la santé de leur hôte (Champagne et al., 2008).
36L'emploi des entérocoques comme probiotiques est potentiellement possible puisqu'ils appartiennent aux bactéries lactiques et font partie intégrante de la flore commensale de l'homme et des animaux. En Suisse, l'efficacité clinique d'E. faecium SF68 a été démontrée dans la prévention de diarrhées associées aux antibiotiques chez l'adulte et dans le traitement de diarrhées chez l'enfant (Bellomo et al., 1980). Cette souche a été également testée pour traiter des diarrhées aigües, et lors d'essais cliniques en Belgique, un raccourcissement de ces diarrhées de 1 à 3 jours a été observé (Buydens et al., 1996). D'autre part, une préparation probiotique, appelée Causido®, composée d'un mélange de S. thermophilus et d'E. faecium, montre un effet hypocholestérolémiant à court terme (Bertolami et al., 2008). Parmi les souches qui ont été proposées comme probiotiques se trouvent également E. faecium EF9296 possédant une activité antimicrobienne contre Listeria spp. (Marciňáková et al., 2004) et E. mundtii ST4V (Todorov et al., 2009).
4. Le risque des entérocoques
37Les problèmes entre les entérocoques et les humains sont leur origine gastro-intestinale, leur entrée dans la chaine alimentaire, leur résistance aux antibiotiques et leur possible rôle dans des maladies d'origine alimentaire. On peut citer également leur capacité à échanger du matériel génétique ou encore, pour quelques souches, à produire de grandes quantités d'amines biogéniques associées à la fermentation.
4.1. Facteurs contribuant à la pathogenèse des entérocoques
38Les entérocoques ne sont pas des bactéries très virulentes par rapport aux Staphylococcus ou aux Pneumococcus. Pour devenir pathogènes, les entérocoques ont besoin d'exprimer des caractéristiques de virulence associées à l'adhésion, la translocation et la disparition de la réponse immunitaire (Jett et al., 1994 ; Ben Omar et al., 2004).
39Les deux espèces les plus couramment rencontrées dans ces infections sont E. faecium et E. faecalis. Cette dernière est responsable de 80 à 90 % des infections à base d'Enterococcus, alors que E. faecium n'est associé qu'à 5 à 10 % des infections (Kayser, 2003 ; Sánchez et al., 2007). D'autres espèces comme E. durans, E. avium, E. casseliflavus, E. gallinarum, E. raffinosus, E. irae et E. mundtii ont été identifiées occasionnellement comme organismes responsables d'infections chez l'homme (Jett et al., 1994).
40Résistance à des antibiotiques. Cette propriété est due à la présence intrinsèque de gènes de résistance principalement acquis par l'intermédiaire d'éléments génétiques mobiles (plasmides ou transposons). La plasticité du génome des entérocoques (voir § 4.2.) leur permet de s'adapter constamment à leur environnement et de résister à une large variété d'antibiotiques (Inoue et al., 2006 ; Sánchez et al., 2007) appartenant à différentes classes comme les bêta-lactames, les aminoglycosides, les lincosamides ou les glycopeptides.
41En 1986, certains E. faecium ont montré des résistances à des antibiotiques de type glycopeptides (la vancomycine et le teicoplanine) (LeBlanc, 2006). L'apparition de souches résistantes à la vancomycine est d'autant plus inquiétante que cet antibiotique est considéré comme étant le dernier recours dans le cadre du traitement d'infections par entérocoques. De plus, il est souvent utilisé comme une alternative à l'ampicilline, la pénicilline et aux aminoglycosides chez les personnes allergiques (Franz et al., 2004). Par ailleurs, les entérocoques vancomycine-résistants sont habituellement multi-résistants et posent dès lors un réel problème de santé publique (Inoue et al., 2006).
42Facteurs de virulence. Les facteurs de virulence permettent la colonisation et l'invasion des tissus ainsi que la perméabilisation des cellules épithéliales contournant ainsi les défenses immunitaires de l'hôte (Franz et al., 2004). Les facteurs de virulence les plus couramment étudiés chez les entérocoques sont la production de substances d'agrégation, la production de cytolysine (bactériocine) et les activités enzymatiques.
43La substance d'agrégation (SA) est une glycoprotéine codée par un gène plasmidique régulé par des phéromones. Ces dernières favorisent le lien à des récepteurs de la surface des eucaryotes, jouent un rôle essentiel dans la colonisation de l'hôte (Jett et al., 1994) et facilitent le transfert des plasmides. L'adhérence des bactéries aux tissus de l'hôte étant une étape cruciale dans le processus d'infection, la présence de SA dans les souches peut conduire à l'accroissement de la capacité de colonisation (Eaton et al., 2001).
44La cytolysine ou β-hémolysine est le facteur de virulence le plus étudié. Cette toxine peptidique lyse les cellules animales en générant des pores dans la membrane cellulaire. La production de cytolysine semble être un facteur de risque important lié aux entérocoques pathogènes, ce mécanisme de lyse étant une stratégie bactérienne pour contourner les réactions immunitaires chez l'hôte (LeBlanc, 2006). Les gènes de cytolysine sont souvent portés par des plasmides et régulés par des phéromones. La fréquence de mortalité causée par une infection par entérocoque β-hémolytique est cinq fois supérieure à celle observée par une infection à entérocoques non-β-hémolytiques (Huycke et al., 1991). Une étude suggère que la combinaison d'hémolysine et de la substance d'agrégation entraine une mortalité accrue dans l'endocardite due à E. faecalis (Chow et al., 1993).
45Les autres facteurs sont les enzymes hydrolytiques produites telles que l'hyaluronidase, la gélatinase et la sérine protéase (Fisher et al., 2009). L'hyaluronidase est une enzyme qui dégrade l'acide hyaluronique, constituant majeur de la matrice extracellulaire des cellules animales (Kayser, 2003). La gélatinase est l'un des facteurs de virulence largement étudié chez E. faecalis (Del Papa et al., 2007) : il s'agit d'une Zn-métalloprotéase (EC 3.4.24.4), capable d'hydrolyser la β-insuline, la gélatine, le collagène, la caséine, l'hémoglobine et d'autres peptides biologiquement actifs (Jett et al., 1994 ; Fisher et al., 2009). En outre, la gélatinase contribue au processus de formation de biofilm, ce qui peut accroitre la capacité des entérocoques à coloniser les tissus et à persister dans les sites d'infection (Del Papa et al., 2007).
4.2. La plasticité génétique et le transfert de gènes
46Les gènes de virulence sont connus pour être associés à certains plasmides hautement transmissibles (Eaton et al., 2001). Plusieurs caractéristiques de virulence des entérocoques indiquées précédemment, telles que la production de cytolysine, la capacité d'adhérence et la résistance aux antibiotiques, sont associées à des mécanismes de transfert de gènes (Giraffa, 2002). La résistance aux antibiotiques et la virulence chez les entérocoques sont des phénomènes en évolution. Aux États-Unis, les premiers cas cliniques d'antibiorésistance ont été observés en 1977, et c'est en 1990 que furent décrits les premiers entérocoques résistant à la vancomycine (ERV) pour aboutir en 2003 à une situation endémique dans les hôpitaux avec une proportion d'ERV de l'ordre de 25 à 30 %. Cette augmentation de l'incidence des infections à entérocoques est le résultat de deux phénomènes, à savoir l'utilisation massive d'antibiotiques aussi bien en médecine que dans l'industrie agro-alimentaire d'une part et, d'autre part, la capacité des entérocoques à échanger et intégrer du matériel génétique. Shankar et al. (2002) ont décrit chez E. faecalis un cluster de 150 kb, appelé ilot de pathogénicité, renfermant une centaine d'opérons dont certains codent pour des gènes de virulence (toxines, cytolysine, protéines de surface et substance d'agrégation). Récemment, Coburn et al. (2007) ont démontré le transfert horizontal de cet ilot de pathogénicité porté par un plasmide en réponse à des phéromones. Dans le cas de résistance aux antibiotiques de type macrolides, lincosamides et streptogramines (MLS), De Leener et al. (2005) ont mis en évidence, grâce à un marqueur génétique (ermB), le transfert horizontal de ces gènes d'une souche E. faecium d'origine animale vers une souche d'origine humaine. Ce mécanisme de propagation via le transfert d'éléments génétiques (plasmides et/ou transposons) est plus important que la dispersion clonale des souches résistantes aux antibiotiques (Van den Bogaard et al., 2002 ; De Leener et al., 2005). Ces expériences ont été menées sur des modèles animaux et n'ont pas tenu compte de l'environnement naturel qui influe fortement sur le transfert d'éléments mobiles.
4.3. Production d'amines biogènes par les entérocoques
47Les amines biogènes (AB), aussi appelées amines naturelles, sont des bases azotées de faible poids moléculaire, constituant de nombreux aliments (Burdychova et al., 2007). Les AB peuvent affecter le système vasculaire, ce qui entraine une constriction des vaisseaux sanguins, ensuite une augmentation de la pression artérielle (Omaye, 2004). Les intoxications par l'histamine peuvent provoquer des symptômes de type allergique tels que les éternuements, maux de tête/migraines ou essoufflement (Holzapfel et al., 2008). À des concentrations supérieures à 100 mg·kg-1, l'histamine et la tyramine peuvent causer une intoxication alimentaire et une crise hypertensive (Shalaby, 1996 ; Hammes et al., 2008).
48Les AB peuvent être d'origine endogène à de faibles concentrations dans les aliments non fermentés comme les fruits, les légumes, la viande, le lait et le poisson (Leuschner et al., 1999 ; McCabe-Sellers et al., 2006). Elles sont formées aussi par la décarboxylation des acides aminés ou par l'amination et la transamination des aldéhydes et des cétones (Karovičová et al., 2005) lors de la détérioration des aliments ou au cours de la fermentation microbienne contrôlée ou spontanée (Karovičová et al., 2005 ; McCabe-Sellers et al., 2006).
49La production d'AB par entérocoques est favorisée lors de la fermentation, en raison de l'acidification et de la protéolyse. À partir de deux fromages à pâte mi-dure, Burdychova et al. (2007) ont isolé 14 souches capables de produire des AB : E. durans (7 souches), E. faecalis (3 souches), E. casseliflavus (3 souches) et E. faecium (1 souche). Kučerová et al. (2009) ont trouvé des espèces d'E. faecium et d'E. faecalis avec des activités décarboxylases dans des échantillons de lait cru de vache, de fromages frais et de fromages semi-durs. Leuschner et al. (1999) ont détecté la tyramine (477 mg·kg-1) dans des fromages de type Gouda produits avec deux souches d'E. faecalis, ayant 12 jours de maturation. Gardini et al. (2008) ont montré l'influence du chlorure de sodium sur l'augmentation de la concentration finale en tyramine et l'accumulation de 2-phényléthylamine produite par E. faecalis EF37 pendant la fermentation et la maturation de saucisses sèches (Gardini et al., 2008).
5. Évaluation de l'incidence des entérocoques opportunistes et pathogènes en alimentation
50Pendant des siècles, les entérocoques ont été employés pour la conservation et la fermentation des aliments. Cependant, ces dernières années, ils font l'objet d'une attention particulière pour leur incidence dans les maladies nosocomiales et leur multi-résistance aux antibiotiques. La possibilité que les gènes de résistance aux antimicrobiens ou des gènes codant pour des facteurs de virulence puissent être transférés à des souches probiotiques dans le tractus gastro-intestinal contribue à des controverses (Franz et al., 2004). L'utilisation des entérocoques comme probiotiques et/ou starters est donc sujette à caution. C'est ainsi que le caractère pathogène opportuniste des entérocoques ne leur permet pas d'accéder au statut GRAS (Generally Reconized as Safe) ou QPS (Qualified Presumption of Safety).
51En conséquence, l'utilisation des entérocoques dans l'industrie agro-alimentaire soit comme starters, soit comme probiotiques nécessite une évaluation de leur innocuité. FAO/WHO (2006) ont reconnu que certaines souches d'entérocoques ont des propriétés probiotiques et sont sensibles à la vancomycine au moment de leur introduction dans un produit. Toutefois, le transfert de gènes de résistance aux antibiotiques ou d'autres propriétés de virulence est toujours possible.
52Avant d'employer E. faecalis ou E. faecium, leur présomption d'innocuité doit être avérée, en identifiant correctement les facteurs qui peuvent favoriser l'émergence du caractère pathogène opportuniste, ainsi que la capacité de ces espèces à acquérir des gènes d'espèces génétiquement proches (Ferreira et al., 2007). Notons que E. faecium SF68, employée pendant 20 ans comme un probiotique, ne contient ni facteurs de virulence, ni plasmide phéromone-sensible codant pour la SA (Kayser, 2003).
6. Conclusion
53Les Enterococcus font partie des aliments fermentés, principalement des produits laitiers. Ils contribuent à améliorer les propriétés organoleptiques et de conservation de certains produits alimentaires. Leur nature ubiquiste rend possible leur capacité d'adaptation à divers environnements et aux procédés technologiques de transformation des aliments. Les entérocoques sont aussi utilisés comme probiotiques, mais également en tant que producteurs d'entérocines. Celles-ci sont très importantes compte tenu de leurs capacités à inhiber la croissance de Listeria spp. et à interférer avec des bactéries d'altération des aliments, des champignons et des levures. Quelques espèces d'Enterococcus seraient par ailleurs capables d'inhiber des bactéries Gram- et de diminuer la propagation de certains virus. Malgré tous ces avantages, l'utilisation des entérocoques dans les aliments est remise en question compte tenu du caractère pathogène opportuniste de certaines souches. Par conséquent, l'utilisation de nouvelles souches d'entérocoques doit faire l'objet d'évaluations afin de déterminer leur innocuité. L'utilisation des entérocines purifiées constitue une alternative intéressante de bioconservation des aliments.
Bibliographie
Barbosa J., Gibbs P. & Teixeira P., 2010. Virulence factors among enterococci isolated from traditional fermented meat products produced in the North of Portugal. Food Control, 21, 651-656.
Bellomo G., Mangiagle A., Nicastro L. & Frigerio G., 1980. A controlled double-blind study of SF68 strain as a new biological preparation for the treatment of diarrhea in pediatrics. Curr. Ther. Res., 28, 927-936.
Ben Omar N. et al., 2004. Functional and safety aspects of Enterococci isolated from different Spanish foods. Syst. Appl. Microbiol., 27, 118-130.
Bennik M. et al., 1998. A novel bacteriocin with a YGNGV motif from vegetable-associated Enterococcus mundtii: full characterization and interaction with target organisms. Biochim. Biophys. Acta, 1373, 47-58.
Bertolami M.C. & Farnworth E., 2008. The properties of Enterococcus faecium and the fermented milk product-Gaio®. In: Farnworth E., ed. Handbook of fermented functional foods. 2nd ed. Boca Raton, FL, USA: CRC Press Taylor & Francis Group, 59-75.
Burdychova R. & Komprda T., 2007. Biogenic amine-forming microbial communities in cheese. FEMS Microbiol. Lett., 276, 149-155.
Buydens P. & Debeuckelaere S., 1996. Efficacy of SF 68 in the treatment of acute diarrhea. A placebo-controlled trial. Scand. J. Gastroenterol., 31(9), 887-891.
Campos C. et al., 2006. Preliminary characterization of bacteriocins from Lactococcus lactis, Enterococcus faecium and Enterococcus mundtii strains isolated from turbot (Psetta maxima). Food Res. Int., 39, 356-364.
Champagne C. & Møllgaard H., 2008. Production of probiotic cultures and their addition in fermented foods. In: Farnworth E., ed. Handbook of fermented functional foods. 2nd ed. Boca Raton, FL, USA: CRC Press Taylor & Francis Group, 71-88.
Chen H. & Hoover D., 2003. Bacteriocins and their food applications. Compr. Rev. Food Sci. Food Saf., 2, 82-100.
Chow J. et al., 1993. Plasmid-associated hemolysin and aggregation substance production contribute to virulence in experimental enterococcal endocarditis. Antimicrob. Agents Chemother., 37(11), 2474-2477.
Coburn P., Baghdayan A., Dolan G. & Shankar N., 2007. Horizontal transfer of virulence genes encoded on the Enterococcus faecalis pathogenicity island. Mol. Microbiol., 63(2), 530-544.
De Graef E. et al., 2003. Description of Enterococcus canis sp. nov. from dogs and reclassification of Enterococcus porcinus Teixeira et al. 2001 as a junior synonym of Enterococcus villorum Vancanneyt et al. 2001. Int. J. Syst. Evol. Microbiol., 53, 1069-1074.
De Kwaadsteniet M., Todorov S., Knoetze H. & Dicks L., 2005. Characterization of a 3944 Da bacteriocin, produced by Enterococcus mundtii ST15, with activity against Gram+ and Gram- bacteria. Int. J. Food Microbiol., 105, 433-444.
De Leener E. et al., 2005. Molecular analysis of human, porcine and poultry Enterococcus faecium isolates and their erm(B) genes. Appl. Environ. Microbiol., 71(5), 2766-2770.
Del Papa M., Hancock L., Thomas V. & Perego M., 2007. Full activation of Enterococcus faecalis gelatinase by a C-terminal proteolytic cleavage. J. Bacteriol., 189(24), 8835-8843.
Devriese L., Van De Kerckhove A., Kilpper-Bälz R. & Schleifer K., 1987. Characterization and identification of Enterococcus species isolated from the intestines of animals. Int. J. Syst. Bacteriol., 37(3), 257-259.
Dortu C. & Thonart P., 2009. Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la bioconservation des produits alimentaires. Biotechnol. Agron. Soc. Environ., 13, 143-154.
Eaton T. & Gasson M., 2001. Molecular screening of Enterococcus virulence determinants and potential for genetic exchange between food and medical isolates. Appl. Environ. Microbiol., 67(4), 1628-1635.
Eldar A. et al., 1996. Enterococcus seriolicida is a junior synonym of Lactococcus garvieae, a causative agent of septicemia and meningoencephalitis in fish. Curr. Microbiol., 32(2), 85-88.
Ennahar S. & Cai Y., 2005. Biochemical and genetic evidence for the transfer of Enterococcus solitarius Collins et al. 1989 to the genus Tetragenococcus as Tetragenococcus solitarius comb. nov. Int. J. Syst. Evol. Microbiol., 55, 589-592.
FAO/OMS, 2004. Evaluación de riesgos de Listeria monocytogenes en alimentos listos para el consumo. Roma: Organización de las Naciones Unidas para la Agricultura y la Alimentación, Organización Mundial de la Salud.
FAO/WHO, 2006. Probióticos en los alimentos. Propiedades saludables y nutricionales y directrices para la evaluación. Roma: Estudio FAO Alimentación y Nutrición 85.
Fernández M., 1983. Olives. In: Rehm H. & Reed G., eds. Biotechnology. Vol. 5. Food and feed production by microorganisms. Weinheim, Deutschland: Verlag Chemie, 379-397.
Ferreira A. et al., 2007. Characterization of enterocins produced by Enterococcus mundtii isolated from human feces. Braz. Arch. Biol. Technol., 50(2), 249-258.
Fisher K. & Phillips C., 2009. The ecology, epidemiology and virulence of Enterococcus. Microbiology, 155, 1749-1757.
Folli C. et al., 2003. Purification of bacteriocin AS-48 from an Enterococcus faecium strain and analysis of the gene cluster involved in its production. FEMS Microbiol. Lett., 221, 143-149.
Franz C., Holzapfel W. & Stiles M., 1999. Enterococci at the crossroads of food safety. Int. J. Food Microbiol., 47, 1-24.
Franz C. & Holzapfel W., 2004. The genus Enterococcus: biotechnological and safety issues. In: Salminen S., Von Wright A. & Ouwehand A., eds. Lactic acid bacteria. Microbiological and functional aspects. 3rd ed. New York, USA: Marcel Dekker, Inc., 199-248.
Franz C. et al., 2007. Diversity of enterococcal bacteriocins and their grouping in a new classification scheme. FEMS Microbiol Rev., 31(3), 293-310.
Gardini F. et al., 2008. Modeling the aminogenic potential of Enterococcus faecalis EF37 in dry fermented sausages through chemical and molecular approaches. Appl. Environ. Microbiol., 74(9), 2740-2750.
Gelsomino R. et al., 2002. Source of enterococci in a farmhouse raw-milk cheese. Appl. Environ. Microbiol., 68(7), 3560-3565.
Ghrairi T., Frere J., Berjeaud J. & Manai M., 2008. Purification and characterization of bacteriocins produced by Enterococcus faecium from Tunisian rigouta cheese. Food Control, 19, 162-169.
Giraffa G., 2002. Enterococci from foods. FEMS Microbiol. Rev., 26, 163-171.
Giraffa G., 2003. Functionality of enterococci in dairy products. Int. J. Food Microbiol., 88, 215-222.
Hamad S., Dieng M., Ehrmann A. & Vogel R., 1997. Characterization of the bacterial flora of Sudanese sorghum flour and sorghum sourdough. J. Appl. Microbiol., 83, 764-770.
Hammes W., Haller D. & Gänzle M., 2008. Fermented meat. In: Farnworth E., ed. Handbook of fermented functional foods. 2nd ed. Boca Raton, FL, USA: CRC Press Taylor & Francis Group, 291-320.
Higashide T. et al., 2005. Endophthalmitis caused by Enterococcus mundtii. J. Clin. Microbiol., 43(3), 1475-1476.
Holzapfel W., Schillinger U. & Buckenhüskes H., 2008. Sauerkraut. In: Farnworth E., ed. Handbook of fermented functional foods. 2nd ed. Boca Raton, FL, USA: CRC Press Taylor & Francis Group, 395-412.
Huycke M., Spiegel C. & Gilmore M., 1991. Bacteremia caused by hemolytic, high-level gentamicin-resistant Enterococcus faecalis. Antimicrob. Agents Chemother., 35(8), 1626-1634.
Inoue T., Tomita H. & Ike Y., 2006. Bac 32, a novel bacteriocin widely disseminated among clinical isolates of Enterococcus faecium. Antimicrob. Agents Chemother., 50(4), 1202-1212.
Jett B., Huycke M. & Gilmore M., 1994. Virulence of enterococci. Clin. Microbiol. Rev., 7(4), 462-478.
Johnsen L., Fimland G. & Nissen-Meyer J., 2005. The C-terminal domain of pediocin-like antimicrobial peptides (class IIa bacteriocins) is involved in specific recognition of the C-terminal part of cognate immunity proteins and in determining the antimicrobial spectrum. J. Biol. Chem., 280(10), 9243-9250.
Karovičová J. & Kohajdová Z., 2005. Biogenic amines in food. Chem. Pap., 59(1), 70-79.
Kawamoto S. et al., 2002. Biochemical and genetic characterization of Mundticin KS, an antilisterial peptide produced by Enterococcus mundtii NFRI 7393. Appl. Environ. Microbiol., 68(8), 3830-3840.
Kayser F., 2003. Safety aspects of enterococci from the medical point of view. Int. J. Food Microbiol., 88, 255-262.
Knudtson L. & Hartman P., 1993. Enterococci in pork processing. J. Food Prot., 56, 6-9.
Kučerová K. et al., 2009. Production of biogenic amines by enterococci. Czech J. Food Sci., 27(2) S2-50–S2-55.
LeBlanc D., 2006. Enterococcus. Prokaryotes, 4, 175-204.
Leclerc H., Devriese L. & Mossel D., 1996. Taxonomical changes in intestinal (faecal) enterococci and streptococci: consequences on their use as indicators of faecal contamination in drinking water. J. Appl. Bacteriol., 81, 459-466.
Leuschner R., Kurihara R. & Hammes W., 1999. Formation of biogenic amines by proteolytic enterococci during cheese ripening. J. Sci. Food Agric., 79, 1141-1144.
Manero A. & Blanch A., 1999. Identification of Enterococcus spp. with a biochemical key. Appl. Environ. Microbiol., 65(10), 4425-4430.
Marciňáková M., Simonová M. & Lauková A., 2004. Probiotic properties of Enterococcus faecium EF9296 strain isolated from silage. Acta Vet. Brno, 73, 513-519.
McCabe-Sellers B., Staggs C. & Bogle M., 2006. Tyramine in foods and monoamine oxidase inhibitor drugs: a crossroad where medicine, nutrition, pharmacy, and food industry converge. J. Food Compos. Anal., 19, S58-S65.
Monstein H. et al., 1998. Division of the genus Enterococcus into species groups using PCR-based molecular typing methods. Microbiology, 144, 1171-1179.
Mulyowidarso R., Fleet H. & Buckle K., 1990. Association of bacteria with the fungal fermentation of soybean tempe. J. Appl. Bacteriol., 68, 43-47.
Murray B., 1990. The life and times of the Enterococcus. Clin. Microbiol. Rev., 3(1), 46-65.
Naser S. et al., 2006. Reclassification of Enterococcus flavescens Pompei et al. 1992 as a later synonym of Enterococcus casseliflavus (ex Vaughan et al. 1979) Collins et al. 1984 and Enterococcus saccharominimus Vancanneyt et al. 2004 as a later synonym of Enterococcus italicus Fortina et al. 2004. Int. J. Syst. Evol. Microbiol., 56, 413-416.
Nes I., Diep D., Håvarstein L. & Brurberg M., 1996. Biosynthesis of bacteriocins in lactic acid bacteria. Antonie van Leeuwenhoek, 70, 113-128.
Omaye S., 2004. Food and nutritional toxicology. Boca Raton, FL, USA: CRC PRESS.
Pimenta S. et al., 2007. Antimicrobial resistance profiles of enterococci isolated from poultry meat and pasteurized milk in Rio de Janeiro, Brazil. Mem. Inst. Oswaldo Cruz., 102(7), 853-859.
Pinto B., Pierotti R., Canale G. & Reali D., 1999. Characterization of 'faecal streptococci' as indicators of faecal pollution and distribution in the environment. Lett. Appl. Microbiol., 29, 258-263.
Sabia C. et al., 2004. Study of two bacteriocins produced by Enterococcus casseliflavus and Enterococcus faecalis. Lett. Appl. Microbiol., 38, 99-105.
Sánchez J. et al., 2007. Antimicrobial and safety aspects, and biotechnological potential of bacteriocinogenic enterococci isolated from mallard ducks (Anas platyrhynchos). Int. J. Food Microbiol., 117, 295-305.
Sánchez A. et al., 2010. Isolation and identification of Enterococcus faecium from seafoods: antimicrobial resistance and production of bacteriocin-like substances. Food Microbiol., 27, 955-961
Schleifer K. & Kilpper-Bälz R., 1984. Transfer of Streptococcus faecalis and Streptococcus faecium to the genus Enterococcus nom. rev. as Enterococcus faecalis comb. nov. and Enterococcus faecium comb. nov. Int. J. Syst. Bacteriol., 34(1), 31-34.
Shalaby A., 1996. Significance of biogenic amines to food safety and human health. Food Res. Int., 29, 675-690.
Shankar N., Baghdayan A. & Gilmore M., 2002. Modulation of virulence within a pathogenicity island in vancomycin resistant Enterococcus faecalis. Nature, 417(13), 746-750.
Todorov S. et al., 2005. An antibacterial and antiviral peptide produced by Enterococcus mundtii ST4V isolated from soya beans. Int. J. Antimicrob. Agents, 25, 508-513.
Todorov S. et al., 2009. Evaluation of potential probiotic properties of Enterococcus mundtii, its survival in Boza and in situ bacteriocin production. Food Technol. Biotechnol., 47(2), 178-191.
Turcotte C. et al., 2004. A rapid turbidometric microplate bioassay for accurate quantification of lactic acid bacteria bacteriocins. Int. J. Food Microbiol., 90, 283-293.
Van Belkum M. & Stiles M., 2000. Nonlantibiotic antibacterial peptides from lactic acid bacteria. Nat. Prod. Rep., 17, 323-335.
Van den Bogaard A. et al., 2002. Antibiotic resistance of faecal enterococci in poultry, poultry farmers and poultry slaughterers. J. Antimicrob. Chemother., 49, 497-505.
Wachsman M. et al., 1999. Antiviral activity of enterocin CRL35 against herpesviruses. Int. J. Antimicrob. Agents, 12, 293-299.
Wachsman M. et al., 2003. Enterocin CRL35 inhibits late stages of HSV-1 and HSV-2 replication in vitro. Antiviral Res., 58, 17-24.
Wilaipun P. et al., 2002. Influence of physical factors and various complex media on growth and bacteriocin production of two-synergistic peptides with heat stable bacteriocin producer, Enterococcus faecium NKR-5-3, isolated from thai fermented fish. Kasetsart J. Nat. Sci., 36, 268-277.
Yoon M., Jun Y. & Hwanga H., 2008. Properties and safety aspects of Enterococcus faecium strains isolated from Chungkukjang, a fermented soy product. LWT Food Sci. Technol., 41, 925-933.
Yousif N. et al., 2005. Molecular characterization, technological properties and safety aspects of enterococci from 'Hussuwa', an African fermented sorghum product. J. Appl. Microbiol., 98, 216-228.
Zendo T. et al., 2005. Identification and production of a bacteriocin from Enterococcus mundtii QU 2 isolated from soybean. J. Appl. Microbiol., 99, 1181-1190.
Pour citer cet article
A propos de : Ana Aguilar-Galvez
Universidad Nacional Agraria La Molina. Instituto de Biotecnología. Av. La Molina s/n. Lima (Perú). – Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium). E-mail : bioindus.gembloux@ulg.ac.be
A propos de : Robin Dubois-Dauphin
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
A propos de : Jacqueline Destain
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).
A propos de : David Campos
Universidad Nacional Agraria La Molina. Instituto de Biotecnología. Av. La Molina s/n. Lima (Perú).
A propos de : Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Passage des Déportés, 2. B-5030 Gembloux (Belgium).






