- Home
- volume 16 (2012)
- numéro 3
- Réponse des stades larvaires de Helicoverpa armigera (Hübner) (Lepidoptera : Noctuidae) à l'application de champignons entomopathogènes Metarhizium anisopliae et Beauveria bassiana
View(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Réponse des stades larvaires de Helicoverpa armigera (Hübner) (Lepidoptera : Noctuidae) à l'application de champignons entomopathogènes Metarhizium anisopliae et Beauveria bassiana

Editor's Notes
Reçu le 27 octobre 2010, accepté le 9 février 2012
Résumé
Deux expérimentations ont été mises en place pour étudier la réponse effet/dose de deux souches de champignons entomopathogènes, Metarhizium anisopliae, Met 31 et Beauveria bassiana, Bb 11 sur les stades larvaires de Helicoverpa armigera. Dans la première expérimentation, la souche Met 31 de M. anisopliae a été testée sur le stade L3 de H. armigera, tandis qu'à la deuxième, les deux souches Met 31 et Bb 11 ont été testées sur le stade L4 du même insecte. Pour les deux expérimentations, les doses de 0, 104, 105, 106, 107 conidies par insecte ont été utilisées. Les observations ont porté sur la mortalité des larves, la sporulation des cadavres, la formation des chrysalides et l'émergence des adultes. La formule d'Abbott a été utilisée pour corriger les taux de mortalité au niveau des insectes traités. La régression de Cox a été utilisée pour déterminer la DL50. Pour la première expérimentation, les taux de mortalité des larves L3 de H. armigera n'étaient pas significativement différents entre les doses d'application de Met 31 de 106 et 107 conidies par insecte. Lors de la deuxième expérimentation, le taux de mortalité des larves L4 (74 %) soumises à la dose d'application de Met 31 de 107 conidies par insecte a été significativement le plus élevé. Pour la souche Bb 11, malgré l'écart observé entre les taux de mortalité causés par 106 (58 %) et ceux causés par 107 conidies par insecte (90 %), aucune différence significative n'a été enregistrée au seuil de 5 %. Les cadavres des chenilles L4 issus des plus faibles doses n'ont pas sporulé. Les témoins ont enregistré le plus fort taux de chrysalides et d'adultes. Ces deux paramètres ont été fonction de la dose : plus la dose est forte, moins élevés sont les taux de chrysalides et d'adultes. Pour toutes les souches de champignons utilisées, quel que soit le stade larvaire de H. armigera, la réponse effet/dose a été significative.
Abstract
Response of the nymphs of Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) to entomopathogenic fungi Metarhizium anisopliae and Beauveria bassiana. Two experiments on dose/mortality response between the instars of Helicoverpa armigera and two strains of entomopathogenic fungi, Metarhizium anisopliae (Met 31) and Beauveria bassiana (Bb 11) were carried out in laboratory conditions. In the first experiment, M. anisopliae Met 31 was tested on the third instar of H. armigera, while in the second experiment, both Met 31 and Bb 11 were tested on the fourth instar. In all the experiments, the following different doses of conidia per insect were used: 104, 105, 106, 107. The following parameters were measured: mortality and sporulation rates, the number of pupae formed and the number of adults that emerged. Abbott’s formula was used to correct the treatment mortality rates. LD50 was determined using Cox-regression. For the third instar in experiment one, no significant difference was observed between high doses (106 and 107 conidia per insect). For instar L4, only the dose of 107 conidia per insect showed high mortality rates (74%). For the strain Bb 11, in spite of the variation observed between the mortality rates induced by high doses (106 and 107 conidia per insect), no significant difference was recorded at the 5% level. No mycosis was observed from cadavers resulting from lower doses when tested on L4. The control recorded the highest numbers of pupae and adults. These two parameters were related to the level of dosage: the higher the dose, the lower the numbers of pupae and adults that emerged. For all the strains of fungi used, whatever the larval stage of H. armigera, the dose/mortality response was significant.
Table of content
1. Introduction
1Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) est signalé comme provoquant de sérieux dégâts, en particulier sur le cotonnier, la tomate et le maïs. Sur le cotonnier, deux ou trois larves sur une plante peuvent détruire toutes les capsules en 15 jours (CABI et al., 2003). De même, selon Parry (1982), une seule chenille de troisième ou de quatrième stade de H. armigera peut dévorer cinq à six boutons floraux en une nuit. La lutte chimique est la méthode le plus souvent utilisée contre les larves des lépidoptères ravageurs des plantes. Elle a été, en général, très efficace pour détruire les ravageurs sur un grand nombre de cultures. Ainsi, de nombreux produits chimiques, notamment les pyréthrinoïdes, les organochlorés (dont le DDT), les carbamates et les régulateurs de croissance, ont été utilisés dans la lutte contre ces ravageurs (Vandamme et al., 1966 ; Ascher et al., 1991 ; Rao et al., 1992). Malheureusement, l'utilisation de ces produits chimiques a entrainé des effets néfastes, tels que l'apparition de nouveaux ravageurs, la pollution de l'environnement et la détérioration de la santé humaine et animale. Face à ces inconvénients, les espoirs se sont portés sur des alternatives.
2Divers biopesticides à base de champignons entomopathogènes, Metarhizium sp. et Beauveria bassiana (Balsamo) Vuillemin, sont disponibles dans le commerce pour la gestion des insectes ravageurs d'importance agricole comme le foreur de caféier Hypothenemus hampei Ferrari et diverses espèces de Curculionidae (Adane et al., 1996 ; De la Rosa et al., 1997), les locustes et les sauteriaux (Johnson et al., 1993 ; Bateman, 1997 ; Lomer et al., 1999 ; Lomer et al., 2001), les lépidoptères (Deshpande et al., 2001 ; Abdel-Razek et al., 2006 ; Godonou et al., 2009 ; James et al., 2009).
3Les espèces les plus utilisées dans cette lutte sont Metarhizium anisopliae (Metchnikoff) Sorokin et Metarhizium flavoviride Gams and Roszypal. Kulkarnia et al. (2008) ont réalisé des essais avec plusieurs souches de ce champignon sur les larves de H. armigera au laboratoire. Toutes les souches utilisées étaient infestives et les plus virulentes ont causé des mortalités allant de 50 % à 92,5 %. Gopalakrishan et al. (1989) précisent que tous les stades de l'insecte, hormis l'œuf, peuvent être touchés. Les adultes mis en contact avec une suspension de conidies ne meurent pas, mais les femelles pondent des œufs stériles.
4La pathogénicité de Beauveria bassiana a été démontrée pour la première fois par Bassi (1835). Ce champignon a été utilisé dans le monde entier contre plusieurs insectes nuisibles : en ex-URSS pour la gestion du doryphore de la pomme de terre (Leptinotarsa decemlineata [Say]) (Coleoptera : Chrysomelidae) ; en Chine contre le Bombyx du pin (Dendrolimus punctata [Walker]) (Lepidoptera : Lasiocampidae). Dans le Nord de l'Amérique, des essais à base de B. bassiana ont été réalisés en laboratoire (aux États-Unis dans le comté d'Arlington et dans l'État de Massachusetts) contre la pyrale du maïs Ostrinia nubilalis (Hübner) (Lefebvre, 1931a ; Lefebvre, 1931b). D'autres études, menées par Gowda et al. (1992) indiquent des taux d'infection de 6 à 12 % par B. bassiana pour des chenilles de H. armigera collectées sur du pois d'Angole en Inde. Wilson (1983) a noté en Australie une mortalité naturelle due à B. bassiana touchant 15 à 20 % des chrysalides hivernantes. La pathogénicité de B. bassiana vis-à-vis de H. armigera a été étudiée au laboratoire dans différentes conditions d'humidité et de température. Lujuan et al. (2001) ont montré qu'à 25 ˚C, avec une humidité relative élevée (95 %), la mortalité des larves de l'insecte traitées avec différentes concentrations de B. bassiana était très rapide et très élevée.
5Les travaux préliminaires effectués sur les larves de troisième stade de H. armigera avec les souches de champignons entomopathogènes M. anisopliae et B. bassiana au Laboratoire de l'Institut International d'Agriculture Tropicale (IITA, Bénin) ont montré que ces dernières sont pathogènes au ravageur (Douro Kpindou et al., 2012). La présente investigation a été réalisée pour évaluer l'efficacité de ces pathogènes à diverses doses sur certains stades de H. armigera.
2. Matériel et méthodes
2.1. Milieu d'étude
6Les expérimentations ont été conduites dans les laboratoires de l'IITA (Bénin) de mars à mai 2009. Les conditions ambiantes de la salle étaient de 26 ± 0,5 °C et de 65,5 ± 5 % RH.
2.2. Provenance des larves de H. armigera utilisées
7Les larves de H. armigera utilisées ont été fournies par le Laboratoire d'Élevage de l'IITA (Bénin). Ce sont des insectes ramenés de prospections. Ils ont été élevés sous un régime alimentaire artificiel composé de haricots, d'agar, de maïs, de levure de brasserie, d'acide ascorbique, d'acide sorbique, de miel, de formaldéhyde et de p-hydroxybenzoate de méthyle (Teakle et al., 1985).
2.3. Provenance des champignons entomopathogènes
8Les souches des champignons entomopathogènes M. anisopliae et B. bassiana utilisées proviennent de l'unité de collection de l'IITA (Bénin) et avaient déjà été testées pour leur pathogénicité (Douro Kpindou et al., 2012). Les conidies de ces champignons ont été produites par l'Unité de Production de l'IITA par un procédé diphasique (liquide, solide) (Cherry et al., 1999). Le taux de germination après 24 h d'incubation à 26 °C était de 93,06 ± 0,04 %.
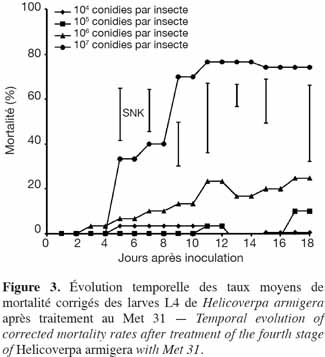
2.4. Protocole expérimental
9Deux expérimentations ont été mises en place. Dans la première, pour raison de disponibilité de l'hôte, seule une souche de M. anisopliae (Met 31) a été utilisée pour inoculer les larves de 3e stade de H. armigera. Lors de la deuxième expérimentation, deux souches, l'une de M. anisopliae (Met 31) et l'autre de B. bassiana (Bb 11) ont été utilisées pour inoculer les larves de 4e stade de H. armigera.
10Chaque expérimentation a consisté en cinq traitements constitués d'une formulation témoin (uniquement de l'huile d'arachide) et de quatre différentes concentrations des conidies de chaque souche de champignon utilisée (Tableau 1). Ces traitements ont été répétés, chacun, dans trois blocs aléatoires complets. Dix larves de H. armigera de même stade ont été utilisées par répétition. L'application topique a été la méthode utilisée pour inoculer les larves (Bateman et al., 1996 ; Peveling et al., 1997). Les larves ont été mises individuellement dans des boites (3,8 x 2,9 x 4,0 cm, avec des couvercles perforés pour l'aération) et soumis au même régime alimentaire que celui du laboratoire d'élevage.

11Le prélèvement des cadavres a été fait de manière quotidienne. Ces cadavres prélevés ont été sèchés pendant 24 h, puis incubés dans des boites de Petri contenant du papier buvard légèrement imbibé pour l'observation d'éventuelles sporulations.
12Le nombre de chrysalides mortes et le nombre d'adultes émergés ont été enregistrés. Pour les traitements où les deux sexes ont émergé, les adultes ont été mis en accouplement et les œufs pondus ont été comptés.
2.5. Analyse des données
13Les taux moyens de mortalité des larves et des chrysalides, de sporulation, de formation et d'émergence des chrysalides obtenus à la fin des observations, ont été utilisés pour tracer les histogrammes. Les taux de mortalité des insectes traités ont été corrigés en utilisant la formule d'Abbott (1925) :
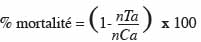
14
15où nTa est le nombre d'individus survivants dans les insectes traités après traitement et nCa est le nombre d'individus survivants dans les témoins après traitement.
16Les taux de sporulation ont été calculés sur la base des individus (larves ou chrysalides) morts dans chaque traitement. Le taux d'émergence a été calculé sur la base du nombre de chrysalides formées dans chaque traitement.
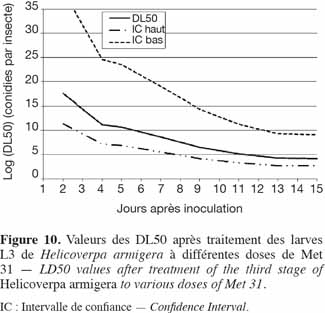
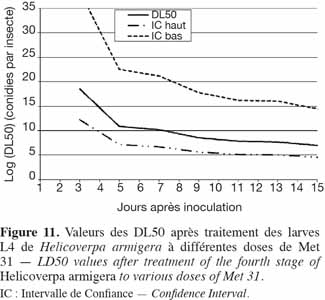
17Après une transformation arc-sinus, une analyse de variance a été faite. Lorsque l'ANOVA a révélé des différences significatives entre traitements, le test SNK (Student-Newman Keuls), au seuil de 5 %, a été conduit afin de séparer les moyennes des différents traitements. Les valeurs des SNK ont été représentées par des traits verticaux au niveau des figures de manière à faciliter la comparaison. Lorsque les valeurs successives sont égales, pour éviter l'encombrement des figures, une seule de ces valeurs a été représentée. Pour toutes ces analyses, le logiciel SAS version 9.1 (2003) a été utilisé.
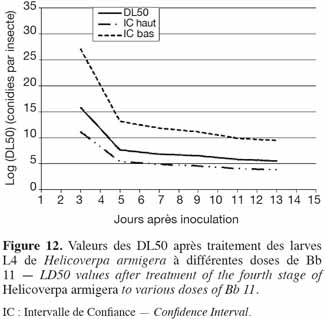
18Estimation de la DL50 (Dose Létale 50). L'analyse et la modélisation des données temps-dose-mortalité ont été effectuées en utilisant le modèle « Cox regression » (SPSS, 1989-20071). Les modèles de régression de Cox utilisent la fonction de risque pour estimer le risque d'échec relatif. La fonction de risque, h(t) est une évaluation de la mort potentielle d'un individu par unité de temps à un moment donné, étant donné que l'individu a survécu jusqu'à ce moment. Les modèles de Cox regression sont exprimés en termes de fonction de risque comme suit :

19où X représente log (dose), B le coefficient de régression qui est le risque relatif (ici risque instantané de décès) associé à un traitement par rapport à un autre traitement, e la base du logarithme népérien et h0(t) est la fonction de risque lorsque X est égal à 0.
20La fonction cumulative de risque, H(t), est liée à la fonction de survie et peut être dérivée de la fonction de survie comme suit :

21La fonction de risque et la fonction de survie sont étroitement liées, et toutes les deux ont été calculées en utilisant le procédé de Cox regression (SPSS, 1989-2007).
22La DL50 est définie comme la dose d'un agent (chimique ou biologique) nécessaire pour produire la mort de la moitié des organismes testés à un moment donné après application (Maddox, 1982). La DL50 peut être dérivée des équations (1) et (2) comme suit :
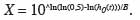
23Les intervalles de confiance pour la DL50 ont été calculés sur la base des mêmes équations, utilisant les informations suivantes : écart-type (SE) de B et écart-type (SE) de h0(t).
3. Résultats
3.1. Mortalité et sporulation des cadavres
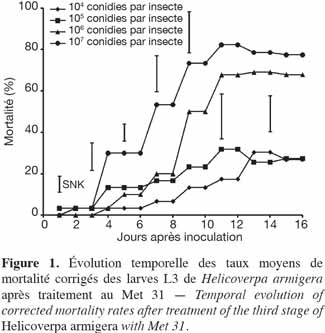
24Expérimentation I. L'évolution des taux de mortalité enregistrés pour toutes les doses de Met 31 utilisées avait suivi la même allure (Figure 1). La dose 107 conidies par insecte a significativement tué plus de larves L3 de H. armigera que les doses 104 et 105 conidies par insecte. Entre les doses 107 et 106 conidies par insecte, la différence a été significative du 4e au 10e jour après inoculation pour s'estomper à partir du 11e jour après inoculation (Figure 1). Les taux de mortalité corrigés obtenus au bout de 16 jours étaient de 17,7 ± 19,4 %, 20,6 ± 10,4 %, 65,0 ± 6,5 %, 74,5 ± 7,6 % respectivement pour les doses de 104, 105, 106 et 107 conidies par insecte. La dose de 106 conidies par insecte ne s'est démarquée des plus faibles doses qu'à partir du 9e jour après inoculation. Les doses 104 conidies par insecte et 105 conidies par insecte ont eu des taux de mortalité similaires.
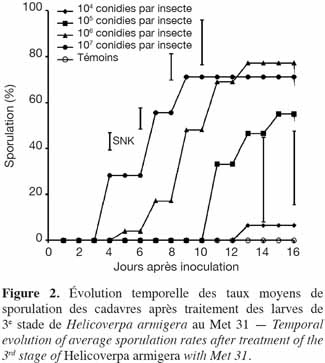
25La tendance a été la même pour les taux de sporulation observés au niveau des cadavres issus des différentes doses (Figure 2). Le taux de sporulation observé au niveau des cadavres engendrés par la dose 105 conidies par insecte a été plus élevé et significativement différent de celui de la dose 104 conidies par insecte. Malgré ces taux de sporulation relativement plus élevés observés au niveau des fortes doses, aucune différence significative n'a été enregistrée entre elles et la dose 105 conidies par insecte.
26Expérimentation II
27Application de M. anisopliae (Met 31). À la dose de 107 conidies par insecte, les taux de mortalité corrigés enregistrés pour les larves du 4e stade de H. armigera étaient similaires à ceux obtenus pour les larves du 3e stade (74 %). Les taux de mortalité au niveau des autres doses étaient faibles. Dix-huit jours après inoculation des larves, ils étaient de 25 % et 10 % pour 106 conidies par insecte et 105 conidies par insecte, respectivement. Ces taux étaient significativement plus faibles au seuil de 5 % par rapport à ceux de la forte dose, 107 conidies par insecte ; il y en a qui s'étaient d'ailleurs annulés (0,5 %) (104 conidies par insecte) (Figure 3).
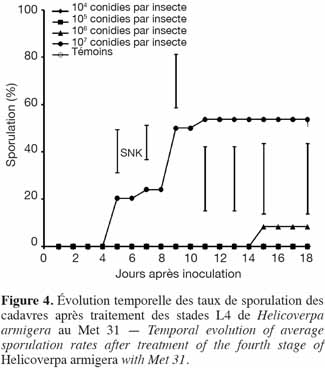
28Le plus fort taux de sporulation obtenu était de 54 %. Seuls les cadavres issus des doses les plus élevées (107 et 106 conidies par insecte) avaient sporulé (Figure 4).
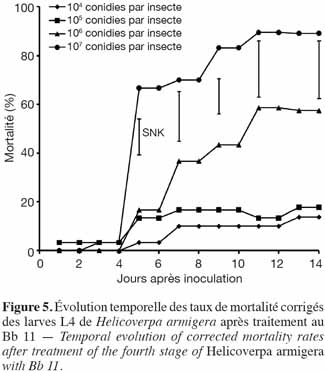
29Application de B. bassiana (Bb 11). Les taux de mortalité corrigés enregistrés au niveau du 4e stade larvaire de H. armigera étaient de 13,3 ± 14,9 % ; 18,1 ± 4,1 % ; 57,8 ± 11,0 % et de 90,0 ± 10,0 % pour les doses 104, 105, 106 et 107 conidies par insecte, respectivement. Malgré le grand écart observé entre les doses les plus élevées, les taux moyens finaux de mortalité n'étaient pas significativement différents au seuil de 5 % (Figure 5).
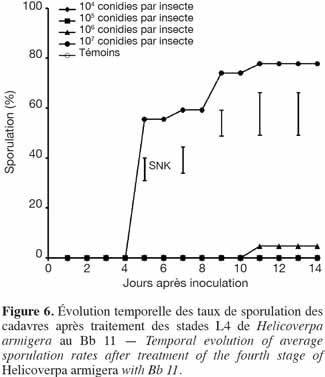
30Tout comme pour la souche de Metarhizium Met 31, seuls les cadavres issus des doses les plus élevées (107 et 106 conidies par insecte) avaient sporulé, avec 77,8 % pour 107 conidies par insecte et 4,8 % pour 106 conidies par insecte (Figure 6).
3.2. Formation des chrysalides, émergence des adultes et oviposition
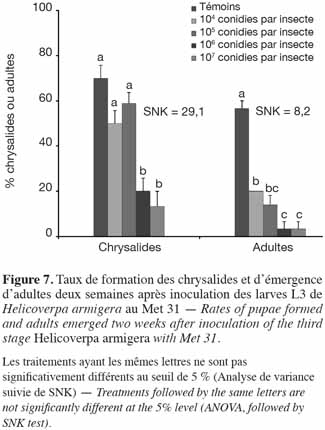
31Expérimentation I. Les taux moyens de chrysalides formées ont varié de 13,3 ± 6,7 % (107 conidies par insecte) à 66,7 ± 14,5 % (Témoins). Les plus faibles taux de formation de chrysalides avaient été enregistrés au niveau des doses les plus élevées (107 et 106 conidies par insecte) avec les plus faibles taux d'émergence des adultes (Figure 7). En dehors des témoins, les adultes issus des larves traitées à la souche Met 31 étaient presque tous des mâles malformés (ailes endommagées). Aucune des femelles issues de l'expérimentation I n'avaient pondu d'œuf (Tableau 2).
32Expérimentation II
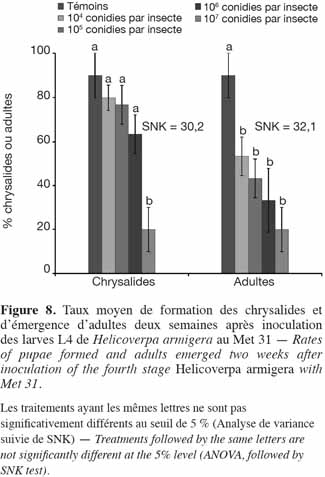
33Application de M. anisopliae (Met 31). Avec les larves de stade 4 de H. armigera, les taux de chrysalides formées avaient été plus élevés comparativement à ceux obtenus avec le 3e stade larvaire. Ces taux étaient de 90,0 ± 10 %, 80,0 ± 5,8 %, 76,7 ± 8,8 %, 63,3 ± 8,8 % et 20,0 ± 10 % respectivement pour le témoin, les doses 104, 105, 106 et 107 conidies par insecte. Seule la plus forte dose, 107 conidies par insecte, a eu un taux significativement inférieur aux autres (SNK = 30,2) (Figure 8). En dehors des témoins, les taux d'émergence étaient similaires pour tous les autres traitements. Le nombre de mâles, de femelles et le nombre d'œufs pondus sont présentés dans le tableau 2. Lorsque les larves du stade 4 avaient été traitées, le nombre d'adultes émergés était plus élevé, mais aussi avec une plus forte proportion de mâles. La dose de 107 conidies par insecte n'a enregistré aucune émergence femelle. Tous les adultes émergés au niveau des témoins étaient tous sains et les femelles avaient pondu jusqu'à 590 œufs (Tableau 2).
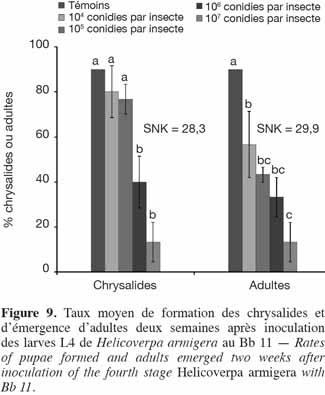
34Application de B. bassiana (Bb 11). Tout comme pour le Metarhizium, les taux de chrysalides formées ont été élevés pour le 4e stade comparativement à ceux obtenus avec le 3e stade exposé à Met 31. Ils ont varié entre 13,3 ± 3,3 % (107 conidies par insecte) et 90 ± 0,0 % (Témoins). La formation des chrysalides et l'émergence des adultes ont été doses dépendantes. Néanmoins, aucune différence significative n'a été observée entre les témoins et les plus faibles doses (104 et 105 conidies par insecte). Toutes les chrysalides formées au niveau des témoins sont devenues adultes (Figure 9). Les mâles étaient en nombre plus important que les femelles (Tableau 2). Tout comme pour la souche de Metarhizium Met 31, aucune femelle n'a émergé pour la dose de 107 conidies par insecte de la souche de Beauveria Bb 11.
35Estimation de la DL50. L'analyse de régression de Cox a indiqué que les différentes doses des champignons utilisés étaient un prédicateur significatif et indépendant de la survie des larves de H. armigera testées (P < 0,05) (Tableau 3) et que le modèle a fourni une bonne régression.
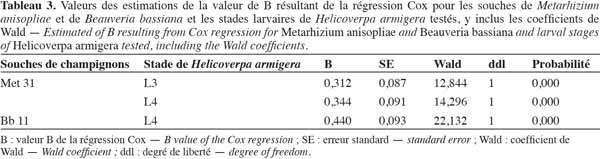
36Les valeurs de B. Les valeurs de B ont montré l'existence d'une relation de dose-réponse. Cette relation a été forte pour la souche de B. bassiana, Bb 11, qui a eu une valeur de B plus élevée (B = 0,440).
3.3. Évolution de la DL50 après l'application des champignons
37Application du Metarhizium sur les stades 3 et 4 de H. armigera. Les courbes de DL50 des stades 3 et 4 de H. armigera sont représentées dans les figures 10 et 11, respectivement. L'effet dose-réponse a été significatif pour toutes les souches utilisées et était fonction de la valeur de B. Plus B était élevé, moins larges étaient les intervalles de confiance. Il fallait 3,47 x 1018, 7,40 x1010, 1,60 x 1010 et 3,72 x 108 conidies par insecte pour tuer 50 % des larves de 4e stade en, respectivement, 3, 5, 7 et 9 jours, tandis qu'il fallait 3,85 x 1017, 4,67 x 1010, 4,23 x 108 et 3,19 x 106 conidies par insecte pour tuer 50 % des larves de 3e stade, en respectivement 2, 5, 7 et 9 jours (Figures 10 et 11).
38Application du Beauveria sur les larves de stade 4 de H. armigera. La souche de Beauveria a donné la valeur B (0,440) la plus élevée et par conséquent, les valeurs de DL50 les moins élevées. La relation dose-réponse a été très bonne pour Bb 11 (Figure 12). Ainsi, il faut 4,6 x 107 conidies par insecte pour tuer 50 % des larves de 4e stade en 5 jours, alors qu'il faut 7,4 x 1010 conidies par insecte pour la souche de Metarhizium, Met 31. Ceci se remarque également par la diminution de la largeur des intervalles de confiance, comparativement à celle des intervalles de confiance de Met 31.
4. Discussion
4.1. Mortalité et sporulation des cadavres
39Les différents résultats obtenus montrent que la mortalité des larves de H. armigera est fonction de la quantité de conidies qu'elles reçoivent. Les deux souches de champignons ont été infectieuses pour tous les stades utilisés en adéquation avec les résultats de Kulkarnia et al. (2008). Au stade L3, les doses 106 et 107 conidies par insecte pour le Metarhizium s'équivalent statistiquement, malgré le taux de mortalité plus élevé enregistré avec la dose de 107 conidies par insecte. Ce taux de mortalité a été nettement supérieur pour 107 lorsque ces mêmes doses ont été appliquées sur les stades L4 ; ceci est dû probablement à la taille plus élevée des larves L4, comparativement à celle des L3. Ces résultats sont similaires à ceux obtenus par Bateman et al. (1996) qui ont trouvé que l'infection des criquets par les champignons est fonction de leur poids. De même, Gundannavar et al. (2006) ont observé que, après application de différentes concentrations (102, 103, 105, 107 et 108 conidies·ml-1) de B. bassiana sur les larves de H. armigera, les jeunes étaient plus sensibles que les plus âgées.
40Au-delà de 106 conidies par insecte, la réponse effet/dose n'est plus perceptible sur les larves L3 et L4 avec, respectivement, le Metarhizium et le Beauveria, en raison probablement de la grande variabilité dans la mortalité d'une répétition à l'autre. Le nombre de chenilles L3 mortes après inoculation du Metarhizium et qui ont sporulé est également fonction de la dose. Il ressort qu'une dose de 106 conidies par insecte, soit une concentration de 5 x 108 conidies·ml-1 permettra d'atteindre les mêmes taux de mortalité que 107 conidies par insecte en deux semaines, vu que l'insecte déjà infecté n'arrive plus à s'alimenter correctement (Thomas et al., 1997). Les cadavres des chenilles L4 issus des faibles doses (104, 105 conidies par insecte) n'ont pas sporulé, ce qui serait dû probablement à la faible quantité de conidies reçues par rapport à leur poids.
4.2. Formation des chrysalides et émergence des adultes
41D'une manière générale, la formation des chrysalides et l'émergence des adultes ont été doses dépendantes, aussi bien pour tous les stades larvaires de H. armigera utilisés que pour les champignons testés. Le nombre de chrysalides formées et celui des adultes émergés sont de loin plus faibles pour le stade 3 que pour le stade 4. Ceci serait dû aux forts taux de mortalité enregistrés au niveau des larves de stade 3 et de leurs chrysalides. En effet, au stade 3, les conidies ont beaucoup plus le temps de se développer dans l'organisme de la larve avant sa chrysalidation. De ce fait, même au stade chrysalide, l'infection continue, tel que l'ont souligné Gopalakrishan et al. (1989). Wilson (1983) a noté en Australie des mortalités naturelles de chrysalides de Heliothis spp. allant de 15 à 20 % dues au B. bassiana. De nos résultats obtenus, il ressort que les chrysalides femelles sont beaucoup plus vulnérables que les chrysalides mâles. Plus la dose est élevée, moins nombreuses sont les femelles qui émergent. De plus, les mâles qui émergent sont malformés (ailes endommagées), limitant ainsi leur déplacement. Ces résultats corroborent ceux de Prasad et al. (2010) qui, après avoir appliqué différentes concentrations (0,1 ; 0,125 ; 0,2 et 0,25 x 108 conidies·ml-1) de B. bassiana sur le troisième stade larvaire de H. armigera, ont observé, en dehors des taux élevés de mortalité, des larves à corps gonflé, des larves léthargiques couvertes de mycélium fongique. Ces larves anormales ont été incapables de muer en quatrième stade, ce qui est un résultat intéressant pour la gestion du ravageur avec les biopesticides à base de champignons entomopathogènes.
4.3. Modèle de régression de Cox et la DL50
42Le modèle de régression de Cox est plus flexible dans l'analyse des essais biologiques de biopesticides que les modèles précédents tels que des analyses de Probit et de Logit. L'analyse de Probit et l'analyse de régression Logit ont trouvé leur large utilisation en modélisant la probabilité d'une réponse par rapport à la dose (Finney, 1971 ; Robertson et al., 1992). Preisler et al. (1989) ont discuté des problèmes liés à l'analyse des données des expériences de temps-dose-réponse et ont conclu que la manière classique de procéder à une analyse des données indépendantes sur le temps ou la dose est de séparer soit l'effet de la dose ou l'effet du temps des données temps-dose-mortalité utilisées dans les essais biologiques. Ces modèles qui considèrent des effets de temps et de dose semblent être plus appropriés pour évaluer l'efficacité d'un microbe pathogène ou d'un pesticide sur la cible (Robertson et al., 1992). Les modèles de régression de Cox ont bien fonctionné en modélisant des liens existant dans temps-dose-survie des isolats fongiques infectant les larves de H. armigera dans ces expérimentations.
43Toutes les régressions de Cox, adaptées aux données de survie obtenues à partir des larves L3-L4 traitées avec différentes doses des différents isolats, ont montré des valeurs relativement élevées de B. Les ajustements des valeurs de B étaient tous significatifs, indiquant que les données montrent une réponse effet/dose significative. Pour la même raison, les courbes de DL50 ne sont pas très raides et leurs intervalles de confiance sont relativement moins grands. Nos résultats sont conformes à ceux de Abebe (2002) qui a utilisé certaines souches de M. anisopliae et de B. bassiana virulentes contre les termites.
44Nos résultats montrent également que pour un même stade larvaire, le temps mis pour mourir est fonction de la dose appliquée. De même, à un temps donné, la dose à appliquer est fonction du stade larvaire : plus le stade est évolué, plus la quantité de conidies à appliquer sera élevée (i.e. à 5 jours, il faut 4,67 x 1010 conidies pour L3 contre 7,40 x 1010 conidies pour L4).
5. Conclusion
45De ces expérimentations, on peut conclure que :
46– La réponse effet/dose a été significative pour tous les stades larvaires de H. armigera utilisés et pour tous les champignons entomopathogènes utilisés ;
47– Des deux stades larvaires de H. armigera utilisés, le stade L3 est le plus vulnérable. Les doses 106 et 107 conidies par insecte (concentrations de 5 x 108 et de 5 x 109 conidies·ml-1) ont donné des résultats similaires permettant de choisir la moins élevée ;
48– Des résultats obtenus, les concentrations de 109, 1010 conidies·ml-1 peuvent être testées en milieu semi-champ et champ afin de déterminer la dose et le volume d'application pour la gestion de H. armigera ; en milieu semi-champ et au champ, la probabilité d'atteindre une larve est plus faible compte tenu des barrières (plantes de cotonnier) pour une bonne couverture de l'application.
49Remerciements
50Nous remercions l'Ambassade Royale des Pays-Bas près le Bénin qui a financé ce travail. Nous remercions également les autres membres du Projet « Méthodes Alternatives de Lutte contre les Ravageurs du Cotonnier au Bénin ».
Bibliographie
Abbott W. S., 1925. A method for computing the effectiveness of an insecticide. J. Econ. Entomol., 18, 265-267.
Abdel-Razek A.S., Abbas M.H., El-Khouly M. & Abdel-Rahman A., 2006. Potential of microbial control of diamondback moth, Plutella xylostella (Linnaeus) (Lepidoptera: Plutellidae) on two cabbage cultivars under different fertilization treatments. J. Appl. Sci. Res., 2, 942-948.
Abebe H., 2002. Potential of entomopathogenic fungi for the control of Macrotermes subhyalinus (Isoptera: Termitidae). PhD thesis: Universität Hannover (Germany).
Adane K., Moore D. & Archer S.A., 1996. Preliminary studies on the use of Beauveria bassiana to control Sitophilus zeamais (Coleoptera: Curculionidae) in the laboratory. J. Stored Prod. Res., 32, 105-113.
Ascher K.R.S., Eliyahu M. & Nemmy N.E., 1991. Inherent toxicity of the acylureas hexaflumuron and clorfluazuron against larvae of the cotton bollworm, Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae). Z. Planzenkrankheiten Planzenschutz, 98, 391-397.
Bassi A., 1835. Del mal del segno, calcinaccio o moscardino, malattia che affligge I bachi da seta. Lodi, Italy: Tipografia Orcesi [English translation by Yarrow P.J., 1958. On the mark disease, calcinacccio or muscardine, a disease that affects silk worms. Ainsworth G.C. & Yarrow P.J., eds. APS Phytopathol. Classics, 10, 1-49].
Bateman R.P., 1997. The development of a mycoinsecticide for the control of locusts and grasshoppers. Outlook Agric., 26, 13-18.
Bateman R.P. et al., 1996. Screening for virulent isolates of entomopathogenic fungi against the desert locust, Schistocerca gregaria (Forskål). Biocontrol Sci. Technol., 6, 549-560.
CABI & OEPP, 2003. Fiche informative sur les organismes de quarantaine : Helicoverpa armigera, http://www.eppo.org/QUARANTINE/insects/Helicoverpa_armigera/F-heliar.pdf, (06/10/2009).
Cherry A. et al., 1999. A West African pilot scale production plant for aerial conidia of Metarhizium sp. for use as a mycoinsecticide against locusts and grasshoppers. Biocontrol Sci. Technol., 9, 35-51.
De la Rosa W., Alatorre R., Trujillo J. & Barrera J.F., 1997. Virulence of Beauveria bassiana (Deuteromycetes) strains against the coffee borer (Coleoptera: Scolytidae) J. Econ. Entomol., 90, 1534-1538.
Deshpande M.V. et al., 2001. Entomopathogenic fungi as myco-insecticides. In: National Symposium on Plant Protection Strategies for Sustainable Agri-Horticulture, October 12-13, 2001, Jammu, India.
Douro Kpindou O.K., Djegui D.A., Glitho I.A. & Tamo M., 2012. Sensitivity of Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae) to the entomopathogenic fungi. Int. J. Trop. Insect Sci., (sous presse).
Finney D.J., 1971. Probit analysis. 3rd ed. Cambridge: Cambridge University Press.
Godonou I. et al., 2009. Potential of Beauveria bassiana and Metarhizium anisopliae isolates from Benin to control Plutella xylostella L. (Lepidoptera: Plutellidae). Crop Prot., 28, 220-224.
Gopalakrishan C. & Narayanan K., 1989. Studies on the susceptibility of Heliothis armigera Hübner (Lepidoptera: Noctuidae) to the entomopathogenic fungus Metarhizium anisopliae (Metschnikoff) Sorokin var. anisopliae Tulloch. Entomon, 14, 191-197.
Gowda J. & Prasad T.N.R., 1992. Occurrence of Beauveria bassiana (Balsamo) Vuillemin on the red gram pod borer Heliothis armigera Hüb. J. Biol. Control, 6, 48-49.
Gundannavar K.P., Lingappa S. & Giraddi R.S., 2006. Susceptibility of Helicoverpa armigera (Hübner) to Beauveria bassiana (Balsamo) Vuill. Kartanaka J. Agric. Sci., 19(4), 952-953.
James B., Godonou I. & Atcha-Ahowe C., 2009. Promoting biopesticide candidates from experimental to commercial level for sustainable vegetable production. Pestic. Manage. West Afr., 7, 34-52.
Johnson D.L. & Goettel M., 1993. Reduction of grasshopper populations following field. Application of the fungus Beauveria bassiana. Biocontrol Sci. Technol., 3, 165-175.
Kulkarnia S.A. et al., 2008. Comparison of Metarhizium isolates for biocontrol of Helicoverpa armigera (Lepidoptera: Noctuidae) in chickpea. Biocontrol Sci. Technol., 18, 809-828.
Lefebvre C.L., 1931a. Preliminary observations on two species of Beauveria attacking the corn borer, Pyrausta nubilalis Hübn. Phytopathology, 21, 1115-1128.
Lefebvre C.L., 1931b. A destructive fungus disease of the corn borer. Phytopathology, 21, 124-125.
Lomer C.J. et al., 1999. Development of strategies for the incorporation of biological pesticides into the integrated management of locusts and grasshoppers. Agric. Forest Entomol., 1, 71-88.
Lomer C.J. et al., 2001. Biological control of locusts and grasshoppers. Annu. Rev. Entomol., 46, 667-702.
Lujuan S., Kongming W. & Yuyuan G., 2001. The pathogenicity of Beauveria bassiana to Helicoverpa armigera under different temperatures and humidities. Acta Entomol. Sinica, 44(4), 501-506.
Maddox J.V., 1982. Use of insect pathogens in pest management. In: Metcalf R.L. & Luckmann W.H., eds. Introduction to insect pest management. 2nd ed. New York, USA: Wiley, 175-216.
Parry G., 1982. Le cotonnier et ses produits. Collection Techniques agricoles et productions tropicales. Paris : Maisonneuve et Larose.
Peveling R. & Demba S.A., 1997. Virulence of the entomopathogenic fungus Metarhizium flavoviride gams and rozsypal and toxicity of diflubenzuron, fenitrothion-esfenvalerate and profenofos-cypermethrin to nontarget arthropods in Mauritania. Arch. Environ. Contam. Toxicol., 32, 69-79.
Prasad A. & Syed N., 2010. Evaluating prospects of fungal biopesticide Beauveria bassiana (Balsamo) against Helicoverpa armigera (Hübner): an ecosafe strategy for pesticidal pollution. Asian J. Exp. Biol. Sci., 1(3), 596-601.
Preisler H.K. & Robertson J.L., 1989. Analysis of time-dose-mortality data. J. Econ. Entomol., 82, 1534-1542.
Rao N.V., Rao K.T. & Reddy A.S., 1992. A note on the efficacy of insect growth regulators to manage gram caterpillar, Helicoverpa armigera Hübner. J. Insect Sci., 5, 169-171.
Robertson J.L. & Preisler H.K., 1992. Pesticide bioassay with arthropods. London: CRC Press.
SAS Institute Inc., 2003. SAS® 9.1 2003. Qualification Tools User's Guide. Cary, NC, USA: SAS Institute Inc.
Teakle R.E. & Jensen J.M., 1985. Heliothis punctigera. In: Singh P. & Moore R.F., eds. Handbook of insect rearing. Amsterdam, The Netherlands: Elsevier, 313-322.
Thomas M.B., Blanford S. & Lomer C.J., 1997. Reduction of feeding by the variegated grasshopper, Zonocerus variegatus, following infection by the fungal pathogen, Metarhizium flavoviride. Biocontrol Sci. Technol., 7, 327-334.
Vandamme P. & Angelini A., 1966. Complexe pathogène chez Helicoverpa armigera Hübner. Coton Fibres Trop., 21, 333-338.
Wilson A.G.L., 1983. Abundance and mortality of overwintering and spring emergence of Heliothis spp. J. Aust. Entomol. Soc., 22, 191-199.
Notes
To cite this article
About: Ouorou Kobi Douro Kpindou
Institut International d'Agriculture Tropicale (IITA). 08 B.P. 0932. Tri Postal. Cotonou (Bénin). E-mail : d.kpindou@cgiar.org
About: Denis Assouan Djegui
Institut International d'Agriculture Tropicale (IITA). 08 B.P. 0932. Tri Postal. Cotonou (Bénin).
About: Isabelle Adolé Glitho
Université de Lomé. Faculté des Sciences. Laboratoire d’Entomologie Appliquée. B.P. 1515. Lomé (Togo).
About: Manuele Tamò
Institut International d'Agriculture Tropicale (IITA). 08 B.P. 0932. Tri Postal. Cotonou (Bénin).






