- Startpagina tijdschrift
- Volume 17 (2013)
- numéro 2
- Munkoyo : des racines comme sources potentielles en enzymes amylolytiques et une boisson fermentée traditionnelle (synthèse bibliographique)
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Munkoyo : des racines comme sources potentielles en enzymes amylolytiques et une boisson fermentée traditionnelle (synthèse bibliographique)

Résumé
Le munkoyo est une boisson fermentée à base de céréales. La spécificité de cette boisson est l’utilisation de racines, appelées également munkoyo, comme source d’enzymes amylolytiques dans le procédé de fabrication de la boisson. Cette revue résume l’état actuel des connaissances scientifiques sur le munkoyo. Les points développés sont : la description botanique, les aires de distribution et la multiplication de la plante munkoyo ; la composition chimique des racines ; les enzymes amylolytiques dans les racines et leurs propriétés ; la description du procédé de fabrication de la boisson ; les différents processus biochimiques intervenant pendant la fabrication de la boisson ; la valeur nutritionnelle de la boisson. Dans le but de valoriser les racines de munkoyo et d’orienter les recherches sur l’optimisation et/ou l’industrialisation du procédé de fabrication de la boisson, les discussions sont focalisées sur la comparaison avec d’autres boissons fermentées et d’autres sources végétales d’enzymes amylolytiques.
Abstract
Munkoyo: roots as potential sources of amylolytic enzymes and a traditional fermented beverage. A review. Munkoyo is a fermented cereal-based beverage. The special feature of this beverage is the use of munkoyo roots as the source of amylolytic enzymes for manufacturing the beverage. This review summarizes the scientific knowledge on munkoyo. The following points are discussed: botanical description; distribution areas; propagation; chemical composition of roots; amylolytic enzymes in the roots and their properties; production process of the beverage; biochemical processes involved in the production of the beverage; and nutritional values and toxicity of the beverage. In order to highlight the value of munkoyo roots and to orientate research towards the optimization and/or industrialization of the production process, discussions are focused on a comparison of munkoyo with other fermented beverages and sources of amylolytic enzymes.
Inhoudstafel
1. Introduction
1Le munkoyo est une boisson fermentée à base de céréales, opaque, acide, alcoolisée et ressemblant à un porridge liquéfié. La boisson est consommée dans la province du Katanga, au sud de la République Démocratique du Congo (R.D. Congo) et en Zambie. La particularité de cette boisson est la mise en œuvre d’enzymes amylolytiques exogènes provenant de racines, appelées également munkoyo, lors de sa fabrication (Ergo et al., 1994).
2Cette fabrication est une activité exclusivement féminine, dans les villages comme dans les banlieues des villes. Les activités économiques subsidiaires générées sont la commercialisation de la boisson, des racines et du maïs. Bouillenne-Walrand et al. (1959) ont observé en 1959 un commerce extrêmement actif des racines dans la province du Katanga. Bien que la production du munkoyo soit artisanale et se situe à l’échelle du ménage, la moyenne de la consommation quotidienne et individuelle dans la province du Katanga est de l’ordre de 0,75 l, ce qui représente une production de 75 à 150 millions de litres par an (Delaude et al., 1993). Mais de plus en plus, des boissons importées concurrencent le munkoyo en milieu urbain et dans les villages et ce, à cause de problèmes de mauvaise présentation et de conservation limitée. En Afrique subsaharienne, quelques boissons, le chikubu (Zimbabwe), le kaffir et le mahewu (Afrique du Sud et Zimbabwe), ont pu être valorisées grâce à l’industrialisation du procédé de fabrication (Hesseltine, 1979 ; Gadaga et al., 1999 ; Steinkraus, 2004). Le manque d’intérêt pour l’industrialisation du munkoyo est dû aux connaissances éparses et incomplètes sur les enzymes amylolytiques des racines de munkoyo et les étapes de fabrication de la boisson. Dans ce contexte, l’objectif de cette revue est de résumer les connaissances actuelles sur les enzymes amylolytiques des racines de munkoyo et la boisson. Le but est de promouvoir les racines de munkoyo comme sources d’enzymes amylolytiques, de proposer les pistes pour optimiser et industrialiser le procédé de fabrication de la boisson et, par conséquent, apporter un revenu supplémentaire aux populations locales.
2. Le munkoyo, une racine d’intérêt
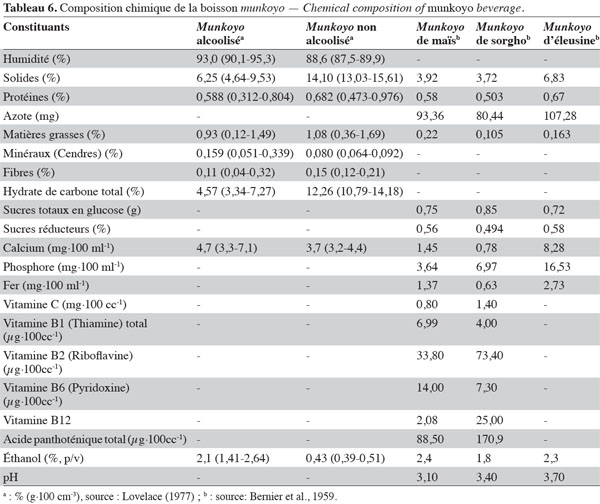
2.1. Description botanique de la plante
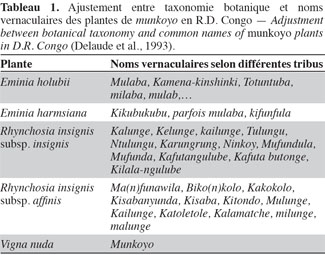
3Les racines de munkoyo sont ligneuses et proviennent de plantes appartenant à la famille des Fabaceae. Les plantes de munkoyo sont regroupées en trois genres : Eminia, Rhynchosia et Vigna. En R.D. Congo, les plantes de munkoyo identifiées sont Eminia holubii (Hemsl.) Taub. (synonyme Eminia polyadenia Hauman), Eminia harmsiana De Wild., Rhynchosia insignis (O.Hoffm.) R.E.Fr. subsp. insignis, Rhynchosia insignis (O.Hoffm.) R.E.Fr. subsp. affinis (De Wild.) Pauwels et Vigna nuda N.E. Br. Dans la région zambézienne, d’autres plantes ont été identifiées : Eminia antennulifera (Baker) Taub. (Malawi, Mozambique, Zambie, Tanzanie et Zimbabwe), Eminia benguellensis Torre (Angola), Rhynchosia venulosa (Hiern) K.Schum. (Afrique du Sud) et Rhynchosia heterophylla Hauman (Zambie, R.D. Congo et Tanzanie) (Delaude et al., 1993).
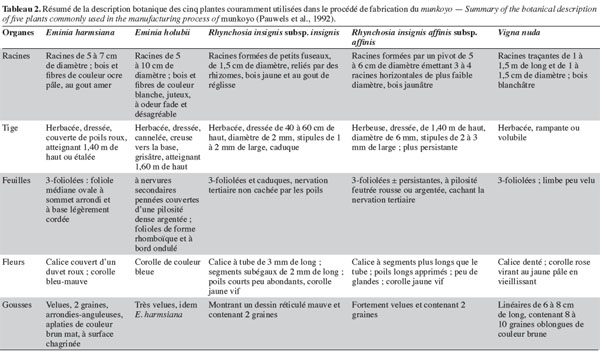
4Les populations locales distinguent les plantes de munkoyo par leurs feuilles, leur tige et leur racine. Chaque espèce possède un nom vernaculaire particulier selon le groupe ethnique (Tableau 1), même si le terme « munkoyo » est attribué à toutes les racines employées pour la fabrication de la boisson. Pauwels et al. (1992) ont établi deux clefs pour distinguer les plantes : la première est basée sur le spécimen fleuri et la seconde, peu classique, sur les racines. Cependant, la description de différents organes (racine, feuille, tige, fleur et gousse) ont permis de distinguer et de classer les espèces et les sous-espèces (Tableau 2).
2.2. Distribution et propagation de la plante
5Les plantes de munkoyo sont présentes uniquement dans la région zambésienne (R.D. Congo, Zambie, Zimbabwe, Angola, Tanzanie, Malawi, Namibie, Botswana et Mozambique). En R.D. Congo, les plantes de munkoyo sont observées au sud de la province du Katanga (frontalière à la Zambie). Elles poussent dans les forêts claires et les savanes arbustives, mais elles n’ont pas toutes la même distribution géographique. Eminia spp. pousse sur des sols ferralitiques et argileux, parfois même rocailleux des flancs des montagnes. Par contre, R. insignis est moins exigeante, elle peut aussi se retrouver dans la steppe herbeuse inondée périodiquement (Delaude et al., 1993). Sur base des données climatiques, les plantes de munkoyo peuvent être introduites dans d’autres régions d’Afrique sub-saharienne telles que le plateau de Jos au Nigeria, le massif de l’Amadoua au Cameroun et en République Centrafricaine, le sud du Soudan dans le massif frontalier de l’Ouganda, le sud-ouest de l’Éthiopie, le sud-est et le nord-ouest du lac Nyassa, à la frontière Mozambique-Zambie-Malawi et dans le Fouta Djalon en Guinée (Ergo et al., 1994).
6Malgré l’exploitation intense dans la province du Katanga, la culture de plantes de munkoyo n’est pas encore développée. Dans ce contexte, une étude a été menée sur la possibilité de multiplier les plantes de munkoyo par éclats de souches et par semis de graines (Delaude et al., 1993). Le meilleur rendement de culture a été obtenu avec E. holubii. Les essais de multiplication d’E. holubii par les éclats de souches produisent une moyenne de 1,8 kg de racines par plante en 26 mois et par semis de graines, une moyenne de 1,3 kg de racines par plante en 14 mois. Cette étude montre que les plantes d’E. holubii se multiplient facilement par semis et produiraient 50 à 100 t de racines par hectare au terme de la cinquième année.
2.3. Sources d’enzymes amylolytiques
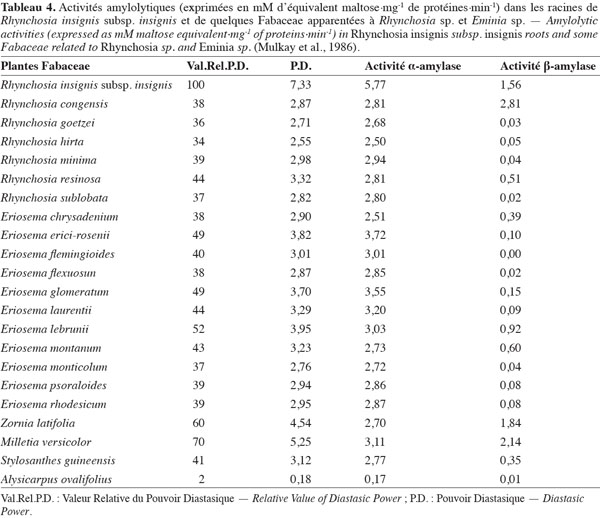
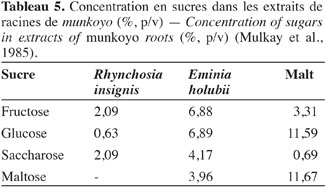
7Accumulation des enzymes amylolytiques. Les racines de munkoyo accumulent des concentrations en enzymes amylolytiques comparables au malt d’orge (Tableau 3). Cette accumulation ne requiert pas une germination préalable (Tiendrebreogo, 1981 ; Delaude et al., 1993). Comparativement à d’autres plantes apparentées, l’abondance de ces enzymes amylolytiques dans les racines de munkoyo est également une particularité. Le tableau 4 montre que les racines de munkoyo sont plus riches en activités amylases que les Fabaceae apparentées au genre Rhynchosia récoltées au Burundi et en R.D. Congo. À ce jour, aucune étude ne traite du processus d’accumulation et du rôle des enzymes dans les racines de munkoyo. Pour les grains de céréales (orge, maïs, blé, sorgho, etc.) et certaines graines de légumineuses (soja et haricots), l’accumulation et/ou l’activation des enzymes amylolytiques requiert une germination contrôlée, appelée le maltage. Le maltage permet de produire les enzymes amylolytiques qui dégradent la réserve d’amidon en sucre, source d’énergie pour le germe (Subbaro et al., 1998 ; Gupta et al., 2010). Les racines de munkoyo, constituées de fibres à plus de 75 % (Simwamba et al., 1986), n’ont probablement pas des évolutions physiologique et biochimique similaires. Pour les racines tubéreuses, l’accumulation des enzymes amylolytiques demeure également inexpliquée. Selon Gana et al. (1998), elles seraient des protéines de réserve parce qu’il n’existe pas une corrélation entre l’évolution de la concentration de l’amidon et de l’activité amylasique durant le cycle de vie de la plante. Dans les racines de R. venulosa, Simwamba et al. (1986) ont observé que les enzymes amylolytiques représentent la majorité des protéines. Par conséquent, les enzymes pourraient être également des substances de réserve dans les racines de munkoyo. D’autre part, aucune étude ne traite de la présence de l’amidon, alors que les racines de munkoyo contiennent des sucres. Le tableau 5 montre que les racines d’E. holubii et de R. insignis contiennent du glucose, du fructose, du maltose (uniquement chez E. holubii) et du saccharose. Dans les racines tubéreuses de Cynara cardunculus, l’inuline serait une substance de réserve (Raccuia et al., 2010). Ces auteurs ont observé une augmentation de la concentration de glucose, fructose et saccharose pendant les périodes froides, lors de la formation de la tige et de la maturation des grains et entre la période de dormance et la reprise de croissance de la plante. Les plantes de munkoyo poussent dans la région zambézienne où le climat est caractérisé par des saisons bien distinctes et de durées sensiblement égales : une saison chaude avec des pluies abondantes et des orages violents (entre novembre et avril) et une saison fraiche, période de grande sècheresse (entre mai et octobre). L’accumulation des enzymes amylolytiques et la présence de sucres dans les racines de munkoyo permettraient donc à la plante de lutter contre l’impact de la rigueur du climat.
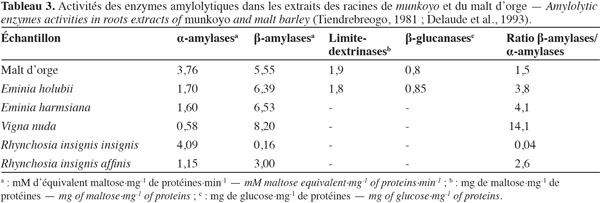
8Les différentes activités amylolytiques. Selon l’étude faite sur les racines d’E. holubii, le complexe amylolytique, constitué de l’α et la β-amylase, la limite-dextrinase et la β-glucanase, est similaire à celui du malt d’orge (Tableau 3). Comme chez les céréales et d’autres végétaux, les α- et β-amylases sont les enzymes amylolytiques prépondérantes dans les racines de munkoyo. Les proportions des activités α- et β-amylases varient selon les genres. La concentration en activité β-amylase dans les racines d’Eminia sp. est supérieure à celle de Rhynchosia sp. (Tableau 3). Pour les racines de V. nuda, le ratio β-amylase/α-amylase est plus élevé, mais la plante est difficilement exploitable en raison du faible diamètre des racines (Tableau 2). D’autre part, le ratio β-amylase/α-amylase dans les racines de munkoyo est supérieur à celui du malt d’orge (Tableau 3). En considérant le diamètre des racines et le rendement de culture, les racines d’E. holubii sont des sources d’amylases équivalentes au malt d’orge (Delaude et al., 1993).
9Propriétés des α- et β-amylases. Les études des propriétés des α- et β-amylases de racines de munkoyo sont menées essentiellement sur les effets de la température et du pH. La caractérisation concerne les enzymes partiellement purifiées d’E. holubii et les extraits de racines de R. insignis insignis (Tiendrebreogo, 1981 ; Mulkay et al., 1985). Le pH optimal de l’α-amylase de R. insignis insignis et d’E. holubii est de 5,2 (Tiendrebreogo, 1981 ; Mulkay et al., 1985), valeur comparable à celle du malt de céréales (pH 4,5-5,5) (Brena et al., 1996 ; Muralikrishna et al., 2005). Le pH optimum de la β-amylase de racines d’E. holubii est également de 5,2 (Tiendrebreogo, 1981), donc très voisin de celui du malt d’orge (pH 5,7) (Brena et al., 1996). Les températures optimales des activités α-amylases d’E. holubii et de R. insignis subsp. insignis sont respectivement de 78 °C et 50-55 °C (Tiendrebreogo, 1981 ; Mulkay et al., 1985). Comme les études sont faites sur des enzymes partiellement purifiées, les valeurs d’E. holubii pourraient être comparables à celles de la fève de soja et de Vigna angularis (70 °C) et celles de R. insignis insignis, aux malts de blé et de millet (entre 40 et 55 °C) (Mar et al., 2003 ; Muralikrishna et al., 2005 ; Kumari et al., 2010). L’activité de la β-amylase d’E. holubii est optimale à 65-67 °C (Tiendrebreogo, 1981). Ces valeurs sont probablement comparables à celle du soja (60 °C) (Brena et al., 1996) mais par contre, elles sont supérieures à celles des malts de céréales (50 à 55 °C) (Yoshigi et al., 1995 ; El Nour et al., 2010 ; Kolawole et al., 2011).
3. Le munkoyo, une boisson traditionnelle fermentée
3.1. Matières premières
10Les ingrédients de la production traditionnelle du munkoyo sont l’eau, la farine de maïs et les racines de munkoyo. Le maïs est la source d’amidon la plus utilisée et la plus disponible dans la province du Katanga. Cependant, d’autres plantes peuvent être utilisées : le sorgho (Sorghum sp.), l’éleusine (Eleusine coracana (L.) Gaertn.), plus rarement le manioc (Manihot esculenta Crantz), la patate douce (Ipomoea batatas (L.) Poir.) et le millet (Panicum miliaceum L.) (Pauwels et al., 1992). Traditionnellement, les grains de maïs subissent des traitements préliminaires avant leur emploi. Les grains sont d’abord débarrassés de leur enveloppe et du germe. Pour ce faire, ils sont immergés dans l’eau pendant 2 à 3 jours, séchés au soleil et ensuite pilés avec du sable et tamisés plusieurs fois (Bernier et al., 1959). Selon les populations locales, l’utilisation de grains dégermés et dépelliculés permettrait d’éviter une coloration et un gout désagréable (Griffon, 1985). D’après Asiedu (1989), le gout désagréable proviendrait de l’oxydation de la matière grasse lors de la cuisson. Comme le germe de maïs contient en moyenne 33 % de matière grasse (Singh et al., 2011), la pratique traditionnelle de dépelliculage et dégermage permettrait en effet de réduire la teneur en matière grasse dans la farine.
11Les racines de munkoyo sont les sources d’enzymes amylolytiques, contrairement à plusieurs boissons traditionnelles africaines (Kaffir beer, Bouza, Pito, Busaa, Mahewu) qui utilisent les grains de céréales maltés (blé, sorgho et maïs) (Steinkraus, 1983 ; Zvauya et al., 1997). En effet, le munkoyo est la seule bière tropicale qui met en œuvre une source enzymatique (d’origine végétale) exogène. Comparativement à d’autres boissons fermentées à base de céréales, l’emploi des racines de munkoyo permet d’éviter l’étape de maltage lors de la fabrication du munkoyo. Les racines de munkoyo contribuent aussi à la coloration et à la saveur caractéristique de la boisson (Lovelace, 1977). La coloration jaunâtre de la boisson est attribuée aux pigments des racines à bois et à fibres jaunâtres. En R.D. Congo, les racines pouvant contenir ces pigments sont celles de R. insignis, à bois et à fibres jaunâtres. Dans deux variétés de R. heterophylla, Zulu et al. (1994) ont identifié des flavonoïdes de la sous-famille des flavones c-glycosides, de coloration jaune à orange-jaune. Dans la plupart des fruits et légumes comestibles, les flavonoïdes sont reconnus comme protecteurs contre les maladies coronariennes et ont des effets antioxydant, anti-inflammatoire, oestrogénique et antibactérien (Tripoli et al., 2007). Comme le procédé de fermentation n’affecte que légèrement la concentration en flavonoïdes, les racines de munkoyo pourraient donc apporter des effets bénéfiques à la boisson (Zulu et al., 1994). Les racines de munkoyo subissent aussi un traitement préliminaire avant leur emploi. Les racines sont battues sur du bois ou sur une surface dure de façon à séparer les fibres. La pratique favoriserait la libération des enzymes amylolytiques. Ces fibres sont parfois récupérées et réutilisées une seconde fois, surtout celles d’E. holubii. Ainsi, Griffon (1985) a décrit ces enzymes comme étant immobilisées sur les fibres, contrairement à Simwamba et al. (1986) qui ont démontré qu’elles sont plutôt hydrosolubles. En effet, la disponibilité des enzymes devrait être améliorée en broyant plus finement les fibres. Dans certaines contrées, les producteurs de munkoyo utilisent les extraits de racines obtenus par macération dans l’eau pendant 1 h (Bernier et al., 1959).
3.2. Étapes de production du munkoyo
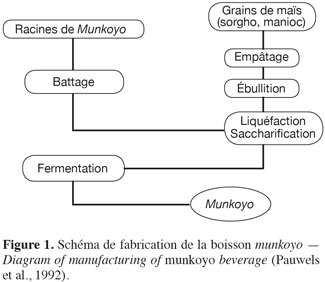
12Les étapes de production du munkoyo sont l’empâtage, la liquéfaction-saccharification et la fermentation (Figure 1). Ce procédé est plus simple comparativement à d’autres boissons fermentées à base de céréales. Généralement, la production de boissons à base de céréales (Kaffir, Mahewu, Bouza, Pito) nécessite une étape préliminaire de maltage de grains de 3 à 7 jours (Steinkraus, 1983).
13Empâtage. Cette étape consiste à gélatiniser l’amidon de farine de maïs dans l’eau. L’utilisation de bois de chauffe comme source d’énergie entraine une variation de la durée d’empâtage. Selon Steinkraus (1983), cette durée varie de 1 à 5 h lors de la préparation traditionnelle des boissons fermentées à base de céréales. Selon Bernier et al. (1959), 15 kg de farine sont utilisés pour produire 125 à 130 l de boisson. Traditionnellement, la farine est obtenue à partir des grains de maïs dépelliculés et dégermés. Selon Guraya et al. (1997), la gélatinisation de l’amidon provenant des grains de maïs entiers n’est pas optimale. Les propriétés de l’amidon sont modifiées par la formation d’un complexe amylose-lipide lors du traitement thermique (Malumba et al., 2011). La formation de ce complexe augmente la température de gélatinisation et réduit la solubilité et la digestibilité (15-33 %) de l’amidon (Guraya et al., 1997).
14Liquéfaction-saccharification. L’étape consiste à introduire les fibres de racines de munkoyo dans l’empois d’amidon (le porridge) légèrement refroidi. Selon Bernier et al. (1959), 3,5 kg de fibres de racines sont mis en œuvre pour produire 125 à 130 l de boisson. L’introduction de fibres sous agitation vigoureuse induit une liquéfaction presque immédiate (Bernier et al., 1959 ; Bouillenne-Walrand et al., 1959). Selon Bernier et al. (1959), les racines de munkoyo liquéfient en 30 s 100 l de pâte amylacée épaisse. La saccharification est obtenue après 6 à 7 h, en laissant les fibres dans le porridge liquéfié. La filtration grossière à l’aide d’un tamis en osier a pour but d’éliminer les fibres des racines et d’arrêter la saccharification. La suspension sucrée obtenue, appelée munkoyo frais, peut être consommée généralement par les enfants.
15En effet, l’étape permet la dégradation de l’amidon en sucres. Selon Zulu et al. (1997), les extraits de racines de R. heterophylla dégradent plus de 75 % d’amidon de maïs en sucres (le maltose constituant 80 % des sucres totaux, le maltotriose, 17 % et le glucose, 3 %) lorsque la température est maintenue à 45 °C. Le rendement de dégradation dépend de la source d’amidon et de la température d’incubation. Selon Sarikaya et al. (2000), l’amidon de riz est le meilleur substrat pour l’hydrolyse enzymatique par les α- et β-amylases. La substitution de maïs par le riz pourrait être envisagée pour la préparation du munkoyo. La température d’incubation se situe entre 30 et 37 °C lors de la fabrication traditionnelle de boissons fermentées et par conséquent, un faible taux d’hydrolyse d’amidon (Hesseltine, 1979 ; Steinkraus, 1983). Pour le munkoyo, le taux d’hydrolyse serait également faible étant donné que les conditions ne sont pas connues.
16Fermentation. Le porridge sucré est réparti dans plusieurs calebasses et conservé à température ambiante durant 1 à 4 jours (Bernier et al., 1959 ; Bouillenne-Walrand et al., 1959). La fermentation observée lors de la conservation est responsable des principales caractéristiques du munkoyo. La boisson devient aigre (acide), ressemblant au yaourt, et alcoolisée. Le pH de la boisson varie entre 3,1 et 3,7 (Poot, 1954) et la teneur en alcool, entre 1,4 et 2,6 % (Tableau 6). Ces caractéristiques sont similaires aux autres boissons fermentées à base de céréales. Pour le mahewu et le kaffir, boissons à base de maïs, le pH est de 3,2 à 3,9 et son acidité titrable correspondante est de 0,4-0,5 % (Steinkraus, 1983 ; Steinkraus, 2004). La teneur en alcool dans le munkoyo est également similaire aux boissons fermentées traditionnelles. Selon Jespersen (2003), la teneur varie entre 2 à 3 % dans les boissons fermentées à base de céréales. Les consommateurs distinguent deux types de munkoyo selon leur teneur en alcool (Tableau 6) : la boisson non alcoolisée, fermentée au maximum pendant 24 h, sa teneur en alcool est en moyenne de 0,4 % et la boisson alcoolisée, obtenue en poursuivant la fermentation de 48 à 72 h, contient en moyenne 2,1 % d’alcool. Les concentrations résiduelles en sucres dans le munkoyo sont de l’ordre de 0,72 à 0,85 % (Tableau 6). Comme les sucres sont les principaux substrats de fermentation des produits fermentés traditionnels (Zvauya et al., 1997), les faibles concentrations en sucres démontrent donc une activité fermentaire importante dans les calebasses. Comme plusieurs boissons fermentées traditionnelles à base de céréales (Blandino et al., 2003), la fermentation du munkoyo est spontanée et dominée par les fermentations lactiques et alcooliques (Zulu et al., 1997). Selon Poot (1954), les ferments de munkoyo proviendraient soit des racines, des récipients et/ou des mains des productrices. Les études faites sur les boissons fermentées à base de céréales ont montré que les ferments lactiques proviennent de malts de céréales (blé, sorgho ou millet) (Steinkraus, 1983 ; Iwuoha et al., 1996 ; Nout et al., 1997 ; Gadaga et al., 1999) et les ferments alcooliques, des équipements de fermentation (Jespersen, 2003). Les principales bactéries lactiques responsables de l’acidification des boissons fermentées à base de céréales sont Lactobacillus, Lactococcus, Leuconostoc et Pediococcus (Oyewole, 1997). Le Lactobacillus est le genre prédominant et les principales espèces sont L. fermentum, L. plantarum et L. delbrueckii (Blandino et al., 2003 ; Muyanja et al., 2003 ; Ramos et al., 2010). Pour le munkoyo, Zulu et al. (1997) ont identifié une souche hétérofermentaire, Lactobacillus confusus LZ1. Les bactéries lactiques hétérofermentaires sont les souches prédominantes dans plusieurs boissons fermentées traditionnelles à base de céréales et elles acidifient la boisson par un mélange équimolaire des isomères DL lactate (Kostinek et al., 2007). L’isomère D (-)-lactate n’est pas métabolisé par les humains (Puwanant et al., 2005). Selon FAO/WHO (1968), le seuil maximum est de 100 mg de D (-)-lactate·kg-1 de poids corporel. Pour un individu de 50 kg, la consommation d’1 l de boisson fermentée contenant 1 % de DL-lactate pourrait donc entrainer l’acidose (Holzapfel, 2002). Une consommation excessive du munkoyo pourrait également causer le même problème. C’est ainsi que l’OMS recommande l’acidification de produits fermentés par des starters producteurs stricts de L-lactate (FAO/WHO, 1968).
17Selon Zulu et al. (1997), Saccharomyces cerevisiae YZ20 est responsable de la production d’alcool. Cette levure est une espèce prédominante dans plusieurs boissons fermentées à base de céréales (Jespersen, 2003). Pour développer le starter adéquat pour le munkoyo, la levure devrait être isolée à partir de la boisson, comme le recommande Jespersen (2003).
18Les conditions de fermentation du munkoyo sont incontrôlées. Selon Bouillenne-Walrand et al. (1959), la fermentation se déroule à température ambiante. Selon Steinkraus (1983), la fermentation à des températures non contrôlées entraine un allongement du temps d’acidification, une acidification trop irrégulière et une augmentation de la concentration de certains acides organiques responsables de la dégradation de la qualité organoleptique. Selon Sanni et al. (1999), une fermentation de plus de 72 h entraine une augmentation de la concentration en acide acétique, acide organique caractéristique de la dégradation de boissons à base de céréales. Pour réduire le temps d’acidification, Steinkraus (1983) rapporte que la fermentation à 48-50 °C avec des souches lactiques thermophiles comme starter est recommandée.
19La fermentation contribue aussi à la préservation, à la saveur et à l’arôme de boissons à base de céréales (Nout et al., 1997). La préservation contre les micro-organismes pathogènes est due aux substances antimicrobiennes : les acides organiques, le peroxyde d’hydrogène, le dioxyde de carbone, le diacétyle et les bactériocines (Dortu et al., 2009). À ce jour, aucune étude ne traite des substances responsables de la préservation du munkoyo. Ainsi, l’acidité du munkoyo permettrait de contrôler le développement des micro-organismes. Selon Blandino et al. (2003), le pH acide en dessous de 4,0 ne permettait pas le développement des micro-organismes dans les produits fermentés à base de céréales. La saveur et les arômes de produits fermentés à base de céréales sont dus respectivement aux acides organiques (principalement l’acide lactique) et aux composés volatils, l’éthanol et les alcools supérieurs (Steinkraus, 1983). Dans l’emmer (produit fermenté à base de riz), les composés volatils responsables des arômes sont les alcools (les plus abondants), les aldéhydes, les cétones, les furanes, les alcanes, les alcènes, les terpènes, les acides carboxyliques et des composés divers (ammoniac, trichlorométhane et sec-butylamine) (Coda et al., 2011). Selon Jespersen (2003), ces composés sont produits essentiellement par les levures. Pour le munkoyo, aucune étude ne traite des composés responsables de la saveur et des arômes, mais les résultats des études antérieures sur les produits fermentés à base de céréales seraient donc transposables.
3.3. Valeur nutritionnelle, substances anti-nutritionnelles et toxicologie
20Le munkoyo devrait être considéré comme une boisson énergétique. Dans les boissons fermentées à base de céréales, les matières solides en suspension, constituées de gruaux de grains non gélatinisés, représentent la matière sèche et sont les sources en calories. Selon Steinkraus (2004), le mahewu, boisson à base de maïs contenant 10 % de matières sèches, apporte 4 000 kj·l-1 de calories. Le munkoyo pourrait être une boisson plus énergétique étant donné que la matière sèche est de l’ordre de 6,3 à 14,1 % (Tableau 6). Comme toutes les boissons fermentées à base de céréales, la valeur nutritive du munkoyo est inférieure aux produits laitiers. Le munkoyo contient de faibles teneurs en protéines (0,31-0,80 %), en fibres (0,04-0,32 %), en acides aminés (1,40 mg·g-1), en vitamines et en minéraux (0,05-0,34 %) (Tableau 6). Pour les protéines, cela s’explique par leurs faibles teneurs dans les grains de céréales, en moyenne 10 % (Shewry, 2007), et la faible proportion de la farine de céréales dans la boisson. Pour améliorer la valeur nutritive des boissons fermentées à base de céréales, Hesseltine (1979) et Steinkraus (1983) proposent l’enrichissement en protéines en additionnant des grits de soja, de la farine de poisson, du petit lait, ou autres suppléments riches en protéines. Le munkoyo contient des vitamines, les vitamines B1 (thiamine), B2 (riboflavine), B6 (pyridoxine), B12 (cobalamine) et B5 (acide pantothénique) (Tableau 6). Bien que le processus de fermentation permette l’amélioration de la disponibilité de certaines vitamines telles que la riboflavine, la thiamine, la niacine et l’acide ascorbique (Jespersen, 2003), les concentrations en vitamines restent faibles dans les boissons fermentées. D’après Steinkraus (2004), l’étape de cuisson (empâtage) détruit 30 % des vitamines. Pour améliorer l’apport en vitamines, Steinkraus (1983) propose une supplémentation en levure sèche dans la boisson.
21Aucune étude ne traite de la présence des substances anti-nutritionnelles dans le munkoyo. Toutefois, il est connu que la fermentation spontanée de produits à base de céréales permet de réduire la concentration des substances anti-nutritionnelles telles que les phytates, tannins, polyphénols et les poly- et oligosaccharides non digestibles (Blandino et al., 2003).
22Les consommateurs considèrent le munkoyo comme une boisson bénéfique à la digestion. À ce jour, aucune étude ne traite de cette propriété. Cependant, il est reconnu que la consommation des aliments fermentés par des micro-organismes producteurs d’activité α-galactosidase permet de réduire la concentration des oligosaccharides non digestibles (Holzapfel, 2002). Dans les produits fermentés à base de végétaux, les principales bactéries lactiques productrices de ces enzymes sont L. plantarum, L. fermentum, L. brevis, L. buchneri et L. reuteri (Cruz et al., 1981). La présence de ces souches pourrait être responsable de propriétés digestives du munkoyo. C’est ainsi que plusieurs études sont menées sur l’expression et les propriétés de l’α-galactosidase (Leblanc et al., 2004 ; Cao et al., 2010).
23À ce jour, aucun problème toxicologique n’a été relevé dans la littérature. Généralement, les boissons traditionnelles fermentées à base de céréales sont contaminées par les grains de céréales mal conservés (Stenkraus, 1983 ; Holzapfel, 1997). Dans la thobwa (bière traditionnelle malawite), Matumba et al. (2011) ont détecté une contamination aux aflatoxines provenant du malt de sorgho, malgré les effets antifongiques des bactéries lactiques tels que rapportés par Dalié et al. (2010) et Ndagano et al. (2011). Par conséquent, l’utilisation de grains sains et bien conservés est fortement recommandée (Holzapfel, 1997).
4. Conclusion et perspectives
24Les racines de munkoyo proviennent de plantes appartenant à la famille de Fabaceae. Les plantes de munkoyo se regroupent en trois genres : Eminia, Rhynchosia et Vigna. Elles se propagent facilement par semis. Leur particularité est l’accumulation abondante d’enzymes amylolytiques, essentiellement les amylases, dans leurs racines. Cette accumulation ne requiert pas une germination préalable, d’où l’intérêt de ces racines par rapport à d’autres sources végétales. En considérant les concentrations des activités enzymatiques et le rendement de culture, les racines des espèces Eminia sont des sources potentielles d’amylases. Cependant, leur valorisation nécessite des études approfondies sur l’expression et les propriétés des activités enzymatiques. Les racines de munkoyo contiennent aussi des flavonoïdes. Une étude approfondie sur ces pigments étendrait le champ d’utilisation de racines de munkoyo.
25Les racines de munkoyo sont principalement utilisées comme sources d’enzymes amylolytiques dans le procédé de fabrication du munkoyo. Comme la présence des activités enzymatiques ne nécessite pas une germination préalable (maltage), l’emploi de ces enzymes exogènes permet de simplifier le procédé de fabrication de cette boisson en trois étapes (empâtage, liquéfaction-saccharification et fermentation). Ainsi, la promotion de ces racines comme sources d’amylases permettrait de supprimer l’étape de maltage lors de la fabrication de plusieurs boissons fermentées traditionnelles. Pour optimiser et industrialiser le procédé de fabrication du munkoyo, cette synthèse bibliographique relève quelques pistes : l’emploi du riz et des grains de maïs dégermés comme source d’amidon ; la détermination de propriétés biochimiques des enzymes amylolytiques de racines de munkoyo ; le contrôle de la température lors de l’étape de saccharification et de la fermentation et la mise au point d’un starter microbien approprié et pouvant aussi apporter des propriétés probiotiques à la boisson.
26Remerciements
27Nous remercions la Coopération Technique Belge (CTB) pour le soutien financier et Monsieur Ngoy Kinamashinda pour la documentation.
Bibliographie
Asiedu J.J., 1989. Processing tropical crops. A technological approach. London: Pub. Macmillan, 234 -235.
Bernier G. & Lamberchts A., 1959. Étude sur les boissons fermentées indigènes du Katanga. Bruxelles : Académie Royale des Sciences coloniales. Classe des sciences naturelles et médicales, Mémoire in 8°.
Blandino A. et al., 2003. Cereal-based fermented foods and beverages. Food Res. Int., 36, 527-543.
Brena B.M., Pazos C., Franco-Fraguas L. & Batista-Viera F., 1996. Chromatographic methods for amylases. J. Chromatogr. B, 684, 217-237.
Bouillenne-Walrand M. & Bouillenne R., 1959. Sur l'isolement et les propriétés d'un nouveau complexe amylolytique puissant, l'Éminiase, extrait de Eminia sp. Bull. Séances Acad. R. Sci. Outre-Mer, 5, 1335-1355.
Cao Y. et al., 2010. Properties of a novel α-galactosidase from Streptomyces sp. S27 and its potential for soybean processing. Enzyme Microb. Technol., 47, 305-312.
Coda R., Rizzello C.G., Trani A. & Gobbetti M., 2011. Manufacture and characterization of functional emmer beverages fermented by selected lactic bacteria. Food Microbiol., 28, 526-536.
Cruz R., Bastistela J.C. & Wosiacki G., 1981. Microbial α-galactosidase for soymilk processing. J. Food Sci., 46, 1196-1200.
Dalié D.K.D., Deschamps A.M. & Richard-Forget F., 2010. Lactic acid bacteria-potential for control of mould growth and mycotoxins: a review. Food Control, 21, 370-380.
Delaude C., Mulkay P., Ngoy K. & Pauwels L., 1993. Munkoyo. Les boissons fermentées africaines. Liège, Belgique : Éd. Antoine Degive.
Dortu C. & Thonart P., 2009. Les bactériocines des bactéries lactiques : caractéristiques et intérêts pour la conservation des produits. Biotechnol. Agron. Soc. Environ., 13(1), 143-154.
El Nour M.E.M & Yagoub S.O., 2010. Partial purification and characterization of α- and β-amylases isolated from Sorghum bicolor cv. (Feterita) malt. J. Appl. Sci., 10, 1314-1319.
Ergo A.B., Breyene H. & Delaude C., 1994. Les possibilités théoriques d’introduire Eminia holubii en Afrique hors de l’aire de distribution de l’espèce. Bull. Soc. R. Sci. Liège, 63(6), 439-454.
FAO/WHO, 1967. Toxicological evaluation of some antimicrobials, antioxidants, emulsifiers, stabilizers, flour-treatment agents, acids and bases. FAO Nutrition Meetings Report Series, 1966 No. 40 A, B, C. WHO/Food add./67.29. Roma: FAO.
Gadaga T.H., Mutukumira A.N., Narvhus J.A. & Feresu S.B., 1999. A review of traditional fermented foods and beverages of Zimbabwe. Int. J. Food Microbiol., 53(1), 1-11.
Gana J.A., Kalengamaliro N.E., Cunningham S.M. & Volenec J.J., 1998. Expression of β-amylase from Alfalfa taproots. Plant Physiol., 118, 1495-1505.
Griffon D., 1985. Contribution à l’étude des alternatives technologiques de saccharification enzymatique des substrats amylacés tropicaux. Thèse de doctorat : Institut National Polytechnique de Lorraine, Nancy (France).
Gupta M., Abu-Ghannam N. & Gallaghar E., 2010. Barley for brewing: characteristic changes during malting, brewing and applications of its by-products. Compr. Rev. Food Sci. Food Saf., 9, 318-328.
Guraya H.S., Kadan R.S. & Champagne E.T., 1997. Effect of rice starch-lipid complexes on in vitro digestibility, complexing index, and viscosity. Cereal Chem., 74(5), 561-565.
Hesseltine C.W., 1979. Some important fermented foods of Mid-Asia, the Middle East, and Africa. J. Am. Oil Chem. Soc., 56(3), 367-374.
Holzapfel W.H., 1997. Use of starter cultures in fermentation on a household scale. Food Control, 8(5/6), 241-258.
Holzapfel W.H., 2002. Appropriate starter culture technologies for small-scale fermentation in developing countries. Int. J. Food Microbiol., 75, 197-212.
Iwuoha C.I. & Eke O.S., 1996. Nigerian indigenous fermented foods: their traditional process operation, inherent problems, improvements and current status. Food Res. Int., 29(5-6), 527-540.
Jespersen L., 2003. Occurrence and taxonomic chatacteristics of strains of Saccharomyces cerevisiae predominant in African indigenous fermented foods and beverages. Yeast Res., 3, 191-200.
Kolawole A.O., Ajele J.O. & Sirdeshmukh R., 2011. Purification and characterization of alkaline-stable β-amylase in malted African finger millet (Eleusine coracana) seed. Process Biochem., 46(11), 2178-2186.
Kostinek M. et al., 2007. Characterisation and biochemical properties of predominant lactic acid bacteria from fermenting cassava for selection as starter cultures. Int. J. Food Microbiol., 114, 342-351.
Kumari A. et al., 2010. α-amylase from germinating soybean (Glycine max) seeds-purification, characterization and sequential similarity of conserved catalytic amino acid residues. Phytochemistry, 71, 1657-1666.
Leblanc J.G. et al., 2004. Reduction of non-digestible oligosaccharides in soymilk: application of engineered lactic bacteria that produce α-galactosidase. Genet. Mol. Res., 3(3), 432-440.
Lovelace C.E.A., 1977. Estimation of nutrient content of two fermented beverages from Zambia opaque maize beer and munkoyo. Symposium on indigineous fermented foods, Bangkok, Thailand. In: Steinkraus K.H., ed., 1983. Handbook of indigenous fermented foods. New York, USA: Marcel Dekker, 371-373.
Malumba P.K. et al., 2011. Structure de l’amidon de maïs et principaux phénomènes impliqués dans sa modification thermique. Biotechnol. Agron. Soc. Environ., 15(2), 315-326.
Mar S.S. et al., 2003. Purification, characterization, and sequence analysis of two α-amylase isoforms from Azuki bean, Vigna angularis, showing different affinity towards β-cyclodextrin Sepharose. Biosci. Biotechnol. Biochem., 67(5), 1080-1093.
Matumba L., Monjerezi M., Khonga E.B. & Lakudzala D.D., 2011. Aflatoxins in sorghum, sorghum malt and traditional opaque beer in southern Malawi. Food Control, 22, 266-268.
Mulkay P., Delaude C., Huls R. & Breyne H., 1985. Le pouvoir amylolytique de Rhynchosia insignis (Fabaceae). Bull. Soc. R. Sci. Liège, 54(3), 187-193.
Mulkay P. & Delaude C., 1986. Le pouvoir amylolytique de quelques Fabaceae africaines. Bull. Soc. R. Sci. Liège, 55(5-6), 627-631.
Muralikrishna G. & Nirmala M., 2005. Cereal α-amylases–an overview. Carbohydr. Polym., 60(2), 163-173.
Muyanja C.M.B.K., Narvhus J.A., Treimo J. & Langsrud T., 2003. Isolation, characterization and identification of lactic acid bacteria from bushera: a Ugandan traditional fermented beverage. Int. J. Food Microbiol., 80, 201-210.
Ndagano D. et al., 2011. Antifungal activity of 2 lactic bacteria of the Weissella genus isolated from food. J. Food Sci., 76(6), 305-311.
Nout M.J.R. & Motarjemi Y., 1997. Assessment of fermentation as household technology for improving food safety: a joint FAO/WHO workshop. Food Control, 8, 221-226.
Oyewole O.B., 1997. Lactic fermented foods in Africa and their benefits. Food Control, 8(5/6), 289-297.
Pauwels L., Mulkay P., Ngoy K. & Delaude C., 1992. Eminia, Rhynchosia et Vigna (Fabacées) à complexes amylolytiques employés dans la région zambésienne pour la fabrication de la bière « Munkoyo ». Belg. J. Bot., 125(1), 41-60.
Poot A., 1954. Le « Munkoyo », boisson des indigènes Bapende (Katanga). Bull. Inst. R. Colonial Belg., 25(1), 386-389.
Puwanant M., Mo-Suwan L. & Patrapinyokul S., 2005. Recurrent D-lactic acidosis in a child with short bowel syndrome. Asia Pac. J. Clin. Nutr., 14(2), 195-198.
Raccuia S.A. & Melilli M.G., 2010. Seasonal dynamics of biomass, inulin, and water-soluble sugars in roots of Cynara cardunculus L. Field Crops Res., 116, 147-153.
Ramos C.L. et al., 2010. Determination of dynamic characteristics of microboiata in a fermented beverage produced by Brazilian Amerindians using culture-dependent and culture-independent methods. Int. J. Food Microbiol., 140, 225-231.
Sanni A.I., Onilude A.A., Fadahunsi I.F. & Afolabi R.O., 1999. Microbial deterioration of traditional alcoholic beverages in Nigeria. Food Res. Int., 32, 163-167.
Sarikaya E., Higasa T., Adachi M. & Mikami B., 2000. Comparison of degradation abilities of α- and β-amylases on raw starch granules. Process Biochem., 35, 711-715.
Shewry P.R., 2007. Improving the protein content and composition of cereal grain. J. Cereal Sci., 46(3), 239-250.
Simwamba C.G. & Elahi M., 1986. Studies on the nutrient composition of Rhynchosia venulosa (munkoyo roots) and physicochemical changes in munkoyo roots and maize porridge mixture during preparation of munkoyo beverage. J. Agric. Food Chem., 34, 573-575.
Singh N., Singh S. & Shevkani K., 2011. Maize: composition, bioactive constituents, and unleavened bread. Chapter 9. In: Preedy V.R., Watson R.R. & Patel V.B., eds. Flour and breads and their fortification in health and disease prevention. Amsterdam, The Netherlands; Boston, USA: Elsevier/Academic Press, 89-99.
Steinkraus K.H., 1983. Handbook of indigenous fermented foods. New York, USA: Marcel Dekker.
Steinkraus K.H., 2004. Industrialization of indigenous fermented foods. 2nd ed. New York, USA: CRC Press.
Subbaro K.V., Datta R. & Sharma R., 1998. Amylases synthesis in scutellum and aleurone layer of maize seeds. Phytochemistry, 49(3), 657-666.
Tiendrebreogo F., 1981. Étude des systèmes amylolytiques d’Eminia polyademia et des propriétés enzymatiques des amylases immobilisées de malt et de munkoyo. Thèse de doctorat : Institut National Polytechnique de Lorraine, Nancy (France).
Tripoli E. et al., 2007. Citrus flavonoids: molecular structure, biological activity and nutritional properties: a review. Food Chem., 104, 466-479.
Yoshigi N. et al., 1995. Construction of a plasmid used for the expression of a seven-fold-mutant barley β-amylase with increased thermostability in Escherichia coli and properties of the sevenfold-mutant β-amylase. J. Biochem., 118, 562-567.
Zulu R.M. et al., 1994. Flavonoids from the roots of two Rhynchosia species used in the preparation of a Zambian beverage. J. Sci. Food Agric., 65(3), 347-354.
Zulu R.M., Dillon V.M. & Owens J.D., 1997. Munkoyo beverage, a traditional Zambian fermented maize gruel using Rhynchosia root as amylase source. Int. J. Food Microbiol., 34, 249-258.
Zvauya R., Mygochi T. & Parawira W., 1997. Microbial and biochemical changes occurring during production of masvusvu and mangisi, traditional Zimbabwean beverages. Plant Foods Hum. Nutr., 51, 43-51.
Om dit artikel te citeren:
Over : Roland Kibwega Foma
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : bioindus.gembloux@ulg.ac.be – Institut facultaire des Sciences agronomiques de Yangambi. Département de Chimie et Industries Agricoles. Kisangani (R.D. Congo).
Over : Jacqueline Destain
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Over : Kalenga Kayisu
Institut facultaire des Sciences agronomiques de Yangambi. Département de Chimie et Industries Agricoles. Kisangani (R.D. Congo).
Over : Philippe Thonart
Univ. Liège - Gembloux Agro-Bio Tech. Unité de Bio-industries. Centre Wallon de Biologie Industrielle (CWBI). Passage des Déportés, 2. B-5030 Gembloux (Belgique).






